急性顱腦損傷患兒血清HMGB1的變化及其臨床意義
王林霞等
[摘要] 目的 探討TBI患兒早期外周血HMGB1表達變化及其臨床意義。 方法 將87例急性TBI患兒根據格拉斯哥評分分成三組:嚴重組(≤8分)、中度組(9~12分)、輕度組(13~15分),分別在傷后3 h、6 h、12 h、24 h、48 h采集靜脈血,采用酶聯免疫吸附試驗(ELISA)檢測血清HMGB1含量;同時根據嚴重組患兒28 d內是否死亡、是否發生膿毒癥或急性肺損傷分組,比較組間HMGB1的表達。 結果 重度組在各時間點HMGB1水平均顯著高于輕、中度組(P<0.01);中度損傷組較輕度損傷組在6 h、12 h、24 h、48 h明顯升高(P<0.01);死亡組患者血清HMGB1水平較存活組顯著升高(P<0.01);發生膿毒癥及急性肺損傷病例血清HMGB1顯著均高于未發生膿毒癥及急性肺損傷病例(P<0.01)。 結論 顱腦損傷患兒早期血清HMGB1即升高,且可能作為一種“預警信號”預測損傷嚴重度及預后、并發癥的發生。
[關鍵詞] 急性顱腦損傷;高遷移率族蛋白B1;兒童患者;膿毒癥;急性肺損傷
[中圖分類號] R651.15 [文獻標識碼] A [文章編號] 1673-9701(2015)22-0005-04
The changes and clinical significance of serum high mobility group box-1 protein level of childrens patients with acute traumatic brain injury
WANG Linxia TANG Luming WANG Min YAN Chunxue PAN Guoquan
Department of Pediatric Intensive Care Unit, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou 325027, China
[Abstract] Objective To investigate the serum high mobility group box-1 protein level of childrens patients with acute traumatic brain injury and its expression changes and clinical significance. Methods A total of 87 childrens patients with acute traumatic brain injury were randomly divided into three groups: severe group (≤8 scores), moderate group(9 to 12 scores) and minor group(13 to 15 scores) according to the patients Glasgow Coma Scale on admission. Their venous blood were drawn at 3 h, 6 h, 12 h, 24 h, 48 h after injury and the serum HMGB1 were determined by enzyme linked immunosorbent assay(ELISA). The serum HMGB1 concentration were compared between different groups, survivors and non-survivors in 28 days, patients who developed acute lung injury(ALI) or sepsis and who did not develope ALI or sepsis in severe injury group. Results Compared with the minor and moderate group, the serum HMGB1 level in severe group were significantly elevated at each time points(P<0.01). At 6 h, 12 h, 24 h, 48 h time points, the serum HMGB1 level in the moderate group increased significantly compared with the minor group(P<0.01). The serum HMGB1 levels at 24 h after injury were higher in non-survivors compared with survivors(P<0.01). The serum HMGB1 levels in those patients who developed acute lung injury(ALI) or sepsis were higher than who did not develope ALI or sepsis (P<0.01). Conclusion The serum HMGB1 concentration is increased early and may be a‘alarm signal prognosticating prognosis and complication after acute traumatic brain injury in children.
[Key words] Acute traumatic brain injury; High mobility group box-1 protein; Children patients; Sepsis; Acute lung injury
急性創傷性腦損傷(traumatic brain injury,TBI)在兒童人群中極為常見,是引起兒童神經系統損傷和機體功能、精神障礙的重要原因之一,具有較高的致殘率和致死率[1,2]。近年來除了強調原發性腦損傷外,TBI后所引起的各種繼發性損傷因素已備受關注,且認為減少顱腦損傷后的繼發性損害能有效降低TBI患者致殘率、死亡率以及改善預后。研究表明多種因素可引起TBI后的繼發性損害,造成二次打擊,而炎癥因子的大量釋放是其中一個重要原因[3,4]。高遷移率族蛋白1(high mobility group box-1,HMGB1)是一種存在于細胞核內的非組蛋白,其含量豐富,且進化高度保守,具有調控DNA穩定、復制、轉錄及翻譯等功能。研究表明,HMGB1可由受損的細胞、組織被動釋放入血,作為一種損傷相關分子模式(damage-associated molecular pattern,DAMP)誘發炎癥反應、細胞凋亡及分化等[5]。本研究擬根據TBI損傷嚴重程度、死亡與否及是否發生膿毒癥、急性肺損傷比較各組患兒外周血HMGB1的表達水平,初步分析及探討其臨床意義。
1 資料與方法
1.1 一般資料
選擇2009年1月~2013年12月我院急診科收治的87例急性單純顱腦外傷患兒作為研究對象,其中男45例,女42例;致傷原因包括高處墜落傷45例,車禍傷32例,擊打傷10例。入選條件:①3 h內有明確的頭部外傷史。②年齡≤14歲。③入院時行CT等影像學檢查證實顱腦損傷。排除標準:①合并有其他部位嚴重損傷者。②排除既往有肺部、神經系統疾病及肝腎功能不全等。③損傷時間超過3 h以上。所有病例進行常規治療,其中急診手術干預15例;急診開始進行非手術保守治療,24 h內顱內病變加重需手術干預者16例;而非手術保守治療者24例。
1.2 方法
①患兒送達醫院時根據睜眼、言語、運動進行格拉斯哥昏迷評分(Glasgow coma scale,GCS)分成三組,嚴重損傷組(8分及以下,34例)、中度損傷組(9~12分,26例)、輕度損傷組(13~15分,27例);每例患兒分別在傷后3 h、6 h、12 h、24 h、48 h靜脈采血2 mL置于干燥試管中,立即送至本院醫學實驗中心,3 000 r/min離心20 min后取上清液,置于-80℃保存待測;嚴重損傷組每例患兒隨訪28 d,分別定期檢測血氣分析、血常規、血壓等,分別根據急性肺損傷(Acute lung injury,ALI)和膿毒癥(sepsis)診斷標準判定是否發生ALI、膿毒癥。②血清HMGB1的檢測:采用人HMGB1酶聯免疫吸附試驗(ELISA)試劑盒(日本Shino-Test公司)檢測,嚴格按照說明書操作,分別計算出標準曲線和回歸方程,將樣品吸光度值代入標準曲線計算出HMGB1水平。
1.3 統計學處理
應用SPSS 16.0軟件對資料進行分析,計量資料以均數±標準差(x±s)表示,組間比較采用單因素方差分析或t檢驗;相關性分析采用Pearson相關分析,用相關系數r的變化范圍判斷兩指標間的相關程度:0為完全不相關;0.10以下為無相關;0.10~0.39為低度相關;0.40~0.69為中度相關;0.7~0.99為高度相關;1為完全相關;P<0.05為差異有統計學意義,P<0.01為差異有高度統計學意義。
2 結果
2.1 不同損傷程度的患兒外周血HMGB1的比較
如表1所示,與輕、中度損傷組相比較,重度損傷組3 h開始HMGB1水平顯著升高(與輕度損傷組比較:t=2.386,P<0.01,與中度損傷組比較:t=1.896,P<0.01),24 h達到高峰(與輕度損傷組比較:t=4.914,P<0.01,與中度損傷組比較:t=3.836,P<0.01),48 h時開始回落;中度損傷組較輕度損傷組6 h開始升高(t=0.946,P<0.01),亦在24 h達到高峰(t=1.078,P<0.01),48 h時開始回落,提示顱腦損傷早期外周血HMGB1即開始升高,持續時間在48 h以上;24 h時間點HMGB1的表達與GCS評分相關性分析結果顯示,兩者呈顯著負相關(r=-0.928,P<0.01),說明顱腦損傷程度越重,其傷后24 h外周血HMGB1水平越高。
2.2 死亡組與存活組HMGB1比較
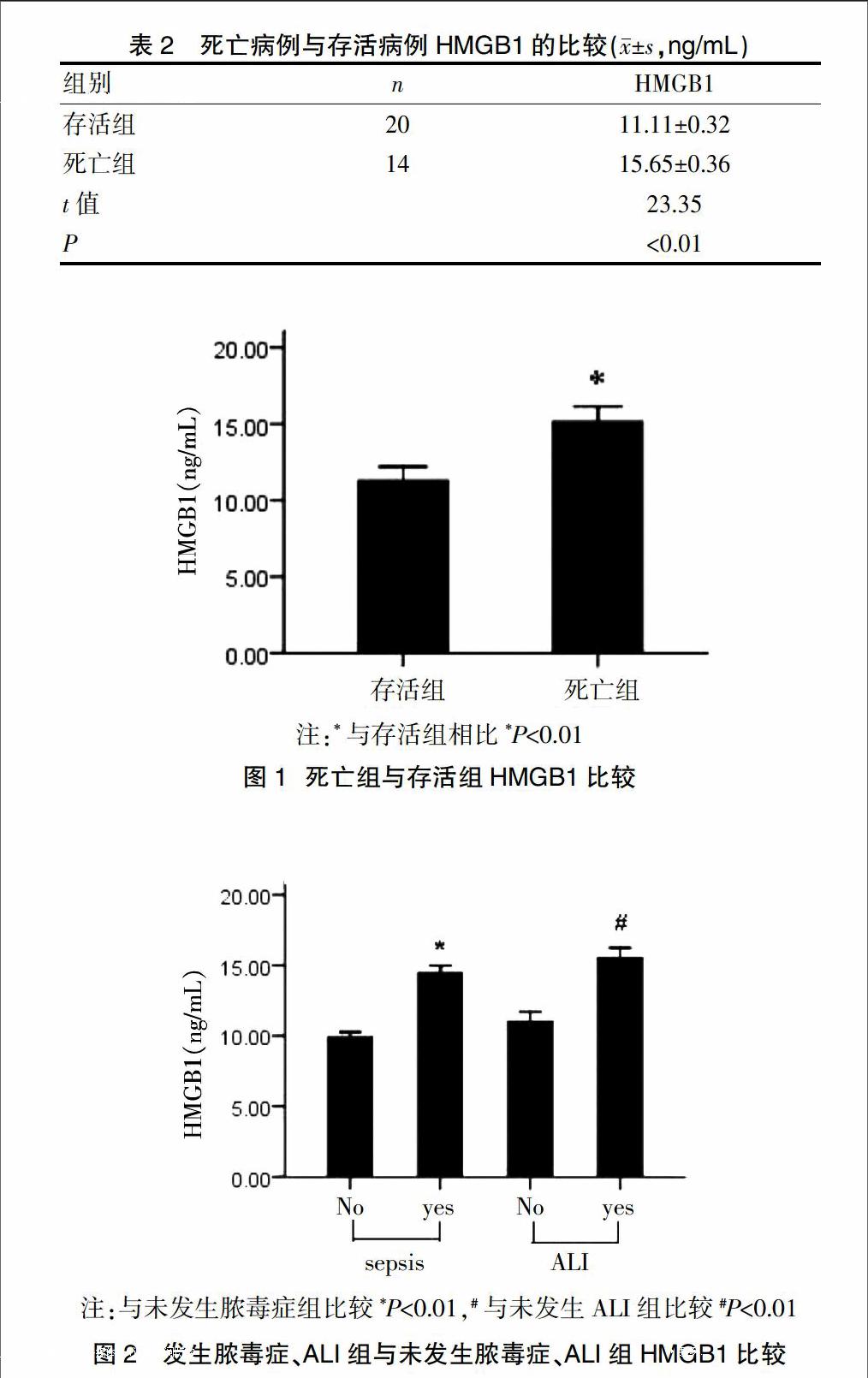
嚴重損傷組中每例患兒隨訪28 d,其中死亡14例,存活20例;采用t檢驗比較死亡組與存活組傷后24 h血清HMGB1水平;結果如表2及圖1所示,傷后24 h血清HMGB1水平死亡組顯著高于存活組(t=23.35,P<0.01)。
2.3 是否發生膿毒癥、ALI患兒之間HMGB1比較
鑒于HMGB1作為一種炎癥介質在膿毒癥和急性肺損傷發生過程中具有重要作用[6,7],我們在實驗中比較嚴重損傷組患兒發生膿毒癥、ALI病例與未發生膿毒癥、ALI病例血清HMGB1的水平,其中15例發生膿毒癥,18例發生ALI;如圖2所示,發生膿毒癥及ALI組血清HMGB1水平顯著高于未發生膿毒癥及ALI組(是否發生膿毒癥比較:t=4.584,P<0.01,是否發生ALI比較:t=4.528,P<0.01)。
注:與未發生膿毒癥組比較*P<0.01,#與未發生ALI組比較#P<0.01
圖2 發生膿毒癥、ALI組與未發生膿毒癥、ALI組HMGB1比較
3討論
HMGB1是一種含量豐富、進化高度保守、廣泛存在于細胞核內的非組蛋白。在細胞核內,其與DNA緊密結合,具有調控DNA穩定、復制、轉錄以及翻譯等功能。近年來研究表明,HMGB1可由免疫細胞主動分泌或損傷、壞死細胞被動釋放的方式轉移至細胞外,并且作為一種“晚期炎癥介質”參與膿毒癥的發生發展過程[8,9]。而在嚴重外傷或缺血中,損傷早期HMGB1即升高,參與損傷后炎癥反應的發生。據報道,嚴重外傷患者30 min內血清HMGB1即顯著升高,其與機體炎癥反應、并發癥、預后密切相關[10]。Gu等[11]發現TBI大鼠傷后24 h HMGB1從細胞核內轉移至胞漿,而腦組織內蛋白及mRNA水平顯著升高。另有資料顯示,TBI患者腦脊液HMGB1濃度和血清HMGB1濃度早期明顯升高[12],但在TBI兒童患者中尚未見報道。我們的資料證實,中重度TBI患兒血清HMGB1在傷后3~6 h即已經升高,在24 h或以上達到高峰,持續48 h以上,顱腦外傷發生后,受損的神經元及神經膠質細胞釋放大量化學物質和細胞因子,如S-100蛋白、神經元特異性烯醇化酶(neuronspecific enolase,NSE)、促炎因子白介素-1(interleukin-1,IL-1)、IL-6、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和抗炎因子IL-10、轉化生長因子-β(transforming growth factor-β,TGF-β)等。這些化學物質通過破壞的血腦屏障進入血循環誘發全身炎癥反應,從而造成全身組織器官的繼發性損害。因此,我們推測HMGB1作為其中的一種重要化學物質,在TBI后其大量釋放入血循環,進一步造成繼發性損害,而相對于其他物質來說,HMGB1在外周血升高更為早期,敏感度更高。我們的實驗結果提示在顱腦損傷患兒中,HMGB1可能是一種良好的早期“預警信號”以判斷損傷嚴重程度、預后及并發癥的發生。
鑒于HMGB1在膿毒癥(sepsis)和急性肺損傷(ALI)的發病過程中具有重要作用[6,7],本研究資料根據TBI患兒不同預后及是否發生并發癥之間血清HMGB1比較,發現死亡組傷后24 h血清HMGB1較存活組顯著升高,而發生膿毒癥病例較未發生膿毒癥病例HMGB1水平高,急性肺損傷患兒較未發生ALI患兒血清HMGB1水平亦顯著升高,提示HMGB1可能與TBI患兒發生膿毒癥和ALI密切相關。既往研究表明,HMGB1作為一種重要炎性介質,其可以與細胞表面受體——糖基化終末產物受體(advanced glycation endoproducts receptors, RAGE)、Toll樣受體(Toll-like receptors,TLRs)結合,激活細胞內復雜的信號通路,誘發其他炎性介質的大量產生,同時這些炎癥介質亦可誘導HMGB1的生成,形成炎癥因子級聯反應,促使機體發生炎癥反應[13,14]。在TBI大鼠模型中發現血清HMGB1升高的同時,其相應受體RAGE、TLR4和核因子NF-κB表達顯著升高,相應細胞因子IL-1β、IL-6和TNF-α升高,而甘草甜素(glycyrrhizin)的干預能夠抑制HMGB1的產生和RAGE、TLR4的表達,減輕炎癥反應及腦水腫程度[11]。Okuma等[15]采用HMGB1單克隆抗體治療TBI大鼠,發現其可以抑制HMGB1的轉移,保護血腦屏障的完整性以及降低炎癥反應。據報道,HMGB1對機體具有雙重作用,即中低濃度的HMGB1對宿主反應是有益的,能夠限制炎癥或組織損傷進展,促進損傷修復和組織再生;隨著HMGB1劑量蓄積及作用時間的延長則導致炎癥反應失控,促使原有損傷進一步惡化甚至出現廣泛組織損害和器官衰竭。而我們的研究結果提示HMGB1的大量分泌可能是顱腦損傷后誘發炎癥反應、造成繼發性損傷的啟動因素之一,而針對于HMGB1的干預可能有利于減輕炎癥反應,減少并發癥的發生,改善預后。
綜上所述,我們的資料證實顱腦損傷患兒早期血清HMGB1即升高,且能一定程度上判斷患兒的預后及并發癥的發生,同時提示針對HMGB1的靶向干預治療可能可以減輕TBI患兒的繼發性損害及并發癥的發生。
[參考文獻]
[1] Keenan HT,Bratton SL. Epidemialogy and outcomes of pediatric traumatic brain injury[J]. Dev Neurosci,2006,28:256-263.
[2] 王振芳,梁秀清,王曉紅,等. 高壓氧綜合治療兒童顱腦損傷并發運動障礙32例療效觀察[J]. 中華航海醫學與高氣壓醫學雜志,2013,20(4):267-268.
[3] 賈進明,姜雪峰,周建良,等. 急性中、重度顱腦損傷伴全身炎癥反應綜合征的臨床分析[J]. 中華神經外科雜志,2012,9(1):42-43.
[4] 齊向前,于明琨. 顱腦損傷后炎癥反應與腦水腫[J]. 中華神經醫學雜志,2007,6(8):850-852.
[5] Abraham E. Unraveling the role of highmobilitygroupboxprotein1 in severe trauma[J]. Crit Care,2009,13(6):1004.
[6] Waterer GW. High-mobility group box 1(HMGB1) as a potential therapeutic target in sepsis-more questions than answers[J]. Crit Care Med,2007,35(4):1205-1206.
[7] Abraham E,Arcaroli J,Carmody A,et al. HMG-1 as a mediator of acute lung inflammation[J]. J Immunol,2000, 165(6):2950-2954.
[8] Wang H,Yang H,Czura Wang H,et al. HMG-1 as a late mediator of endotoxin lethality in mice[J]. Science,1999, 285(5425):248-251.
[9] 徐海洲,何建. HMGB1與臨床疾病關系的研究進展[J]. 中國急救醫學,2011,32(3):264-268.
[10] Cohen MJ,Brohi K,Calfee CS,et al. Early release of high mobility group box nuclear protein 1 after severe trauma in humans: role of injury severity and tissue hypoperfusion[J]. Crit Care,2009,13(6):R174.
[11] Gu XJ,Xu J,Ma BY,et al. Effect of glycyrrhizin on traumatic brain injury in rats and its mechanism[J]. Chin J Traumatol,2014,17(1):1-7.
[12] 張鯤鵬,劉德昭. 急性顱腦損傷患者血清及腦脊液HMGB1的表達及臨床意義[J]. 臨床醫學工程,2012,19(2):37-39.
[13] 湯魯明,盧中秋,姚詠明. 高遷移率族蛋白B1的胞外作用與免疫效應[J]. 生理科學進展,2011,42(3):188-194.
[14] Huang WC,Tang YQ,Li L. HMGB1,a potent proinflammatory cytokine in sepsis[J]. Cytokine,2010,51(2):119-126.
[15] Okuma Y,Liu K,Wake H,et al. Anti-high mobility group box-1 antibody therapy for traumatic brain injury[J]. Ann Neurol,2012,72(3):373-384.
(收稿日期:2015-01-16)

