長鏈非編碼RNA與胃癌診斷 預后及耐藥性研究進展*
徐天蔚 王朝霞
·國家基金研究進展綜述·
長鏈非編碼RNA與胃癌診斷 預后及耐藥性研究進展*
徐天蔚①王朝霞②
長鏈非編碼RNA(long non-codingRNA,lncRNA)是一組長度超過200bp的非編碼RNA。其缺少完整蛋白編碼功能,具有調控基因表達作用。近年來研究發現,lncRNA與胃癌的診斷、預后及耐藥性密切相關。本文結合國內外最新報道,對lncRNA在胃癌的診斷,預后及耐藥性方面的研究進展做一綜述。
長鏈非編碼RNA胃癌診斷預后耐藥性
Correspondence to:Zhaoxia WANG;E-mail:zhaoxiawang88@hotmail.com
1Department of Clinical Medicine,the First School of Clinical Medicine of Nanjing Medical University,Nanjing 210029,China;2Department of Oncology,the SecondAffiliated Hospital of Nanjing Medical University,Nanjing 210011,China
This work was supported by grants from the National Natural Science Foundation of China(No.81272601),the Key Clinical Research Funds from the Science and Technology Bureau of Jiangsu Province(No.BL2014096),and the Key Medical Talents Foun dation of Jiangsu Province(No.RC2011080)
中國胃癌發病率已占惡性腫瘤發病率第二位,病死率居惡性腫瘤第三位[1],其發生發展的生理學過程受多種因素調控。長鏈非編碼RNA(long non-codingRNA,lncRNA)是一類長度大于200nt,缺乏蛋白編碼能力的非編碼RNA(ncRNA),是現今ncRNA的研究熱點。通過lncRNA微陣列芯片及RT-PCR等方法檢測分析胃癌組織,發現多種lncRNAs表達異常。如在胃癌組織中,lncRNA FER1L4、uc001lsz等基因顯著下調而H19、HMlincRNA717等顯著上調,提示了lncRNAs在胃癌的發生發展中具有重要的生物學作用,并且可能成為胃癌診斷、預后及耐藥性等方面的生物學指標,為胃癌的治療方法提供新的思路[2-4]。本文結合國內外最新報道,對lncRNAs在胃癌的診斷、預后及耐藥性方面的研究進展做一綜述。
1 lncRNA與胃癌的診斷價值
1.1血漿中lncRNAs與胃癌診斷
Arita等[5]探究了血漿lncRNAs的穩定性。通過前置放大法來確定lncRNA試驗的合理性,并分析了胃癌患者和健康對照血漿中lncRNAs的水平。發現僅在少數嚴苛條件下血漿lncRNA表現最小限度的不穩定性。特別是胃癌患者血漿中H19顯著高于對照組。術后樣本中血漿H19水平也明顯降低。Shao等[6]使用RT-PCR技術檢測了335份不同階段的胃癌患者和健康對照的血漿樣品,發現胃癌患者血漿中lncRNA AA174084水平在術后15天對比術前明顯減少。其診斷性ROC曲線下面積為0.848。
1.2胃液中lncRNAs與胃癌診斷
Shao等[6]使用RT-PCR技術檢測了130份不同階段的胃癌患者和健康對照的胃液樣品發現胃癌患者胃液中lncRNA AA174084的水平明顯高于正常胃黏膜或是患有最小限度的胃炎、胃潰瘍、萎縮性胃炎的患者。Pang等[7]發現胃癌患者胃液中LINC00152水平也明顯高于正常對照,且該結果具有統計學意義。1.3胃癌組織中lncRNAs與胃癌診斷
Liu等[8]探測得到胃癌組織中對比癌旁無瘤組織lncRNA ncRuPAR水平顯著下調。截斷值為4.97時lncRNA ncRuPAR的ROC曲線下面積為0.84。靈敏度為88.41%,特異度為73.91%。胃癌的預測正確率為81.16%。這些結果顯示了lncRNA ncRuPAR可被認為是胃癌診斷的標志物。Shao等[9]基于lncRNA陣列的結果,運用RT-PCR檢測了313例樣本發現對比正常胃黏膜上皮細胞系,lncRNA HMlincRNA717在多種胃癌細胞系中表達明顯下調,表達水平與腫瘤的遠端轉移及血管、神經的入侵有關。還發現lncRNA HMlincRNA717的下調不僅發生于胃癌組織,在癌前病變中也存在。Lin等[10]對比胃癌組織及癌旁正常組織,發現在胃癌組織中ABHD11-AS1的表達明顯上調,其診斷性ROC曲線下面積為0.613。Pang等[7]使用qRT-PCR技術檢測了71對胃癌及癌旁正常組織發現對比正常組織LINC00152的表達明顯增長。在多種胃癌細胞系中,LINC00152的水平也各自比胃正常上皮細胞系顯著上調。建立ROC曲線以區分胃癌與良性胃部疾病,其曲線下面積為0.645。Sun等[11]運用RT-PCR發現在胃癌組織中lncRNA AC096655.1-002的表達對比癌旁正常組織明顯下調。運用ROC曲線評價其診斷價值,曲線下面積為0.731。這一結果顯示在胃癌探測方面,lncRNA AC096655.1-002的使用相比血漿癌胚蛋白的使用有很大的進步,有可能成為胃癌潛在的新的診斷生物學標記。Mei等[12]使用qRT-PCR檢測發現與對照相比,胃癌組織中SUMO1P3表達上調,ROC曲線下面積為0.666。SUMO1P3是一種假基因表達的lncRNA (pseudogene-expressed lncRNA)。這是第一次有報道顯示假基因表達的lncRNA SUMO1P3可能成為胃癌早期診斷的生物學指標。
表1概述了lncRNAs在胃癌中相關的表達及診斷性ROC曲線下面積的情況。以上研究表明,胃癌患者血漿、組織、胃液中多種lncRNAs表達水平的變化具有一定的胃癌診斷學意義。組織中lncRNAs的研究較全面而血液、胃液相關的研究卻不足。臨床中血液、胃液相對于組織獲取更加方便,因此在血液、胃液中的胃癌特異性相關的lncRNAs變化具有篩查早期胃癌的潛力,而組織中lncRNAs不僅對于胃癌的確診具有意義,且在癌前病變中相關lncRNAs的變化也可提示該病變的發展是否傾向于胃癌,有利于實施針對胃癌的第一級預防。lncRNAs有望成為胃癌預防與診斷新的突破口。
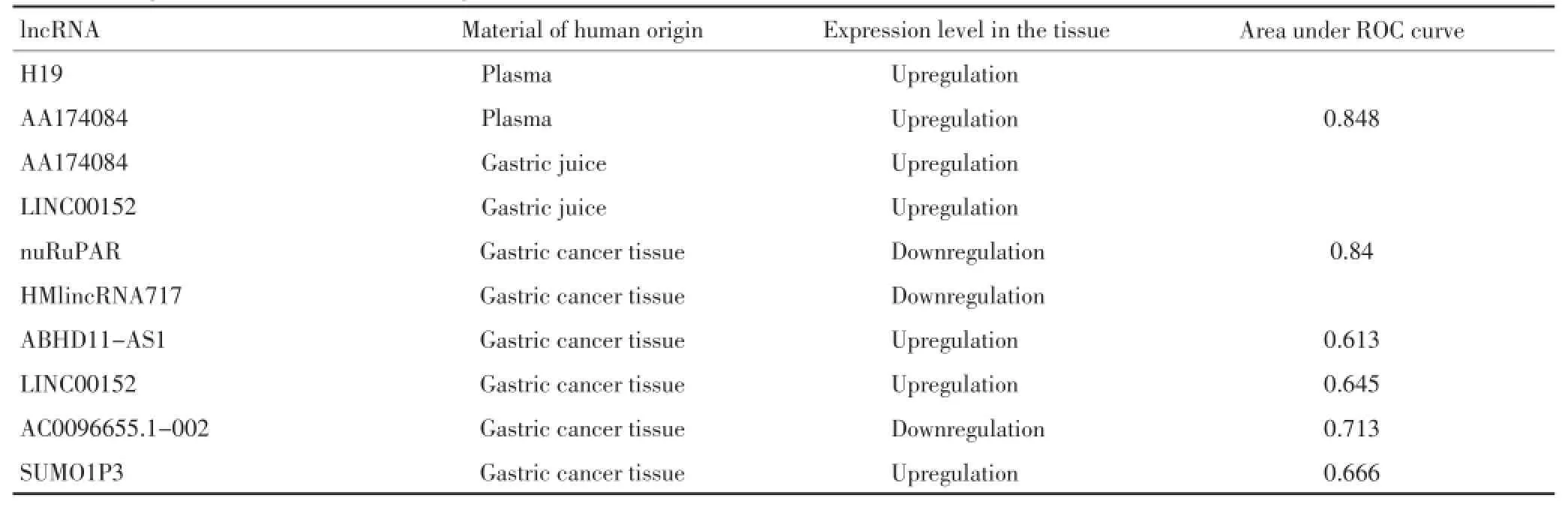
表1 胃癌診斷相關lncRNATable 1 Diagnosis-associated lncRNAs for gastric cancer
2 lncRNA與胃癌的發生發展和預后
2.1lncRNA H19與胃癌的發生發展和預后
H19基因位于人染色體11p15.5,編碼一個2.3 kb 的lncRNA,命名為H19。Yang等[13]通過PCR發現胃癌組織及細胞系中H19顯著上調。使用流式細胞技術和RNA免疫沉淀反應發現異常的H19表達促進了細胞的增殖。干擾H19的表達可導致AGS細胞系中的細胞凋亡增加。進一步證實H19會引起部分P53的失活。Zhuang等[14]發現miR-675隨著H19積極表達,是H19誘導的胃癌細胞增殖的重要的中介。利用熒光素酶報告實驗及Western blot實驗證實,腫瘤抑制因子RUNX1是miR-675直接作用的靶基因。拯救實驗顯示RUNX1中介H19/miR-675誘導的胃癌細胞的表型轉變。此外,在胃癌組織及胃癌細胞系中也顯示出RUNX1和H19/miR-675表達的負相關。Li等[15]建立了MKN45細胞系中H19/miR-675敲除模型和SGC7901細胞系異常表達模型,結果顯示H19的過表達促進了胃癌的惡性轉化和侵襲轉移。H19的共表達網絡鑒定了作為H19的結合蛋白的ISM1,它的表達與H19正相關。CALN1被鑒別為miR-675的靶基因,其表達與miR-675負相關。Li等的結果顯示胃癌中H19作用既通過ISM1的直接上調,也通過miR-675間接抑制CALN1的表達。Zhang等[16]發現對比癌旁正常組織H19在腫瘤組織中過表達。晚期腫瘤淋巴結轉移分級與H19表達的增長正相關。體外MTT和克隆形成實驗確認H19的表達影響胃癌細胞的增殖。Zhang等還發現外生的c-Myc明顯介導H19的表達,且在本研究使用的80份樣品中H19的表達與c-Myc的水平正相關。其研究揭示了c-Myc介導H19的表達通過調節細胞增殖來參與胃癌的發展和進程。使用Kaplan-Meier法和Cox比例風險分析評價發現。高H19表達與較差的總生存時間有關。可以被認為是一個獨立的胃癌患者總生存時間的預測標志。H19可成為潛在胃癌患者預后的靶點。
2.2lncRNA HOTAIR與胃癌的發生發展和預后
HOTAIR定位于12q13.13,是具有反式轉錄調控作用的lncRNA。Hajjari等[17]發現胃腺癌樣本中對比正常胃部上皮組織HOTAIR的異常上調且HOTAIR的異常表達與胃癌TNM分級和淋巴結轉移有關。Xu等[18]使用RT-PCR來定量檢測胃癌患者腫瘤樣本發現對比癌旁正常組織,癌組織中HOTAIR的表達水平上調,HOTAIR的表達水平與淋巴結轉移和TNM分期有很大關聯。隨后調查了HOTAIR的水平與臨床病理學因素和預后的關系,高表達的HOTAIR可作為胃癌患者總生存時間較差的預測標志。體外,胃癌細胞中HOTAIR的抑制可減少侵襲與MMP1和MMP3的表達,而且可以逆轉EMT的進程。Endo等[19]利用qRT-PCR發現在散播性胃癌中,對比低HOTAIR表達組,高HOTAIR表達組顯示出更多的神經侵襲、頻繁的淋巴結轉移和更低的總生存率。利用克隆形成試驗發現腫瘤細胞集落的形成能力隨著HOTAIR的上調而增強。HOTAIR過表達或抑制的胃癌細胞被注射免疫缺陷小鼠的尾靜脈或腹腔發現小鼠尾靜脈注射后HOTAIR過表達的MKN74細胞系與對照相比形成了更多的肝臟轉移。此外,抑制了HOTAIR表達的KATOⅢ細胞系中腹腔擴散也被抑制。
Liu等[20]發現HOTAIR的上調與腫瘤大小晚期病理學分級和廣泛轉移有關,也與胃癌患者更短的生存期相關。通過體內外的過表達和RNA干擾方法發現HOTAIR的過表達提升了細胞增殖惡化和胃癌細胞的侵襲。而體內外試驗中HOTAIR的減少抑制了細胞侵襲和細胞活性并誘導生長阻滯。通過免疫組織化學和二變量分析,本課題組認定并復核了HOTAIR/HER2的積極交互作用。HOTAIR可能作為ceRNA,有效降低miR-331-3p的水平,從而調節HER2的脫落抑制作用并形成附加的轉錄后水平的調解。最終,HOTAIR/HER2的表達與晚期胃癌正相關。HOTAIR的過表達代表了胃癌不良預后的生物學標志,并可能使腫瘤細胞呈現惡性表型。HOTAIR通過ceRNA調控網絡與HER2形成正交互作用從而對胃癌細胞產生影響。這一過程有助于更好地理解胃癌發病機理以及從IncRNA的層面來促進胃癌的診斷和治療的發展。
2.3lncRNA MEG3與胃癌的發生發展及預后
Maternally expressed gene 3(MEG3)是一個位于14q32的印記基因,它編碼與不同人類腫瘤有關的一種lncRNA,MEG3在包括胃癌的一系列性腫瘤中被報道為腫瘤抑制因子。Sun等[21]使用qRT-PCR發現對比癌旁正常組織,胃癌組織中MEG3的水平明顯下降。其表達水平與TNM分級侵襲深度和腫瘤大小有關。此外,低MEG3表達水平的患者預后相對較差。而通過siRNA將MEG3表達抑制可提升細胞增殖,MEG3的異常表達則抑制細胞增殖,促進細胞的凋亡并調節胃癌細胞系中p53的表達。通過5-aza-CdR處理,可觀察到MEG3的表達可被DNA的甲基化調節。Sun等的發現顯示了MEG3的下調可被認為是胃癌預后不良的生物學標記并且體外調節細胞的增殖和凋亡。一些研究顯示MEG3的調節歸于啟動子的甲基化。MiR-148a能夠通過調節靶基因如DNA methyltransferase 1(DNMT-1)的表達抑制胃部腫瘤的發生。Yan等[22]在SGC-7901和BGC-823胃癌細胞系中進一步確定了MEG3和miR-148a的正相關。通過methylation-specific PCR鑒定了MEG3甲基化中不同的甲基化區域,發現胃癌細胞中MEG3的表達隨著siRNA對DNMT-1的抑制而增長。此外,MEG3 siRNA進入胃癌細胞的轉染則削弱了miR-148a過表達介導的細胞增殖的抑制。結果顯示胃癌中miR-148a的抑制可通過調節DNMT-1引起MEG3的下調從而促進胃癌細胞增殖。因此MEG3可能是胃癌發生發展中一個重要的調節位點。
2.4其他lncRNA與胃癌的發生發展及預后
Zhang等[23]發現lncRNA ANRIL在人類胃癌組織中普遍上調,lncRNA ANRIL的表達水平與TNM分期和腫瘤大小正相關。該課題組也發現作為生長調控因子,lncRNA ANRIL與microRNA有交互作用促進胃癌細胞增殖。多因素分析顯示lncRNA ANRIL可作為獨立的總生存的預測指標。Zhao等[24]研究顯示胃癌細胞系和胃癌組織中lncRNA HULC過表達,過表達與淋巴結轉移、遠端轉移、晚期TNM分級有關。在SGC7901細胞系中過表達的lncRNA HULC能促進細胞增殖和侵襲,抑制了細胞凋亡。而敲低lncRNA HULC則顯示相反效應。該課題組還發現lncRNA HULC過表達可介導SGC7901細胞系中自我吞噬模式,自我吞噬模式會抑制過表達HULC細胞的凋亡的增長,也發現了HULC沉默可逆轉EMT表型。Wang等[25]發現MALAT1在多種胃癌細胞系中異常上調,拯救性實驗顯示MALAT1部分通過調節SF2/ASF來促進胃癌細胞增殖。Park等[26]采用RNA-seq實驗發現lncRNA BM742401在胃癌中下調,異常表達則抑制轉移相關的表型并減少細胞外MMP9的濃度,同時發現下調與胃癌患者較差生存期有關。Yang等[27]發現在胃癌組織中CCAT1表達水平明顯上調,使用熒光素酶報告試驗等技術發現c-Myc直接結合于CCAT1啟動子區域E-box元素,使用體外細胞增殖惡化試驗發現異常表達的CCAT1提升細胞增殖和惡化。表明了CCAT1與c-Myc之間的關聯,說明了CCAT1在胃癌的發生發展中具有重要作用。
Liu等[28]通過qRT-PCR發現在91.80%的胃癌組織中FER1L4的表達水平明顯降低,FER1L4的低表達水平與腫瘤大小、病理分級、綜合分類、侵襲深度、淋巴轉移、遠端轉移、TNM分期、血管或神經侵襲和血漿CA72-4有關。血漿檢測顯示健康人與術前胃癌患者FER1L4水平無區別,但是術后兩周后63.9% (53/83)的患者會有急劇的減少。Xu等[29]發現胃癌組織中的lncRNA AC130710水平比癌旁正常組織更高。在MGC-803中lncRNA AC130710表達水平高于正常的胃黏膜細胞GES-1。其表達與腫瘤大小,TNM分期和遠端轉移有關。Sun等[30]使用qRT-PCR發現胃癌組織中GAS5的表達水平顯著下調,并且與腫瘤大小和晚期病理學分級有關。通過hochest染色發現體內外的GAS5異常表達具有減少細胞增殖和促進細胞凋亡的功能,而異常表達的GAS5的下調則提升了細胞的增殖。還發現GAS5可以部分通過調節E2F1和P21的表達影響胃癌細胞的增殖。多變量Cox回歸分析發現低GAS5表達的患者的無病生存期與總生存期均小于高表達患者,減少的GAS5是一個獨立的胃癌預后標志物。
以上結果顯示,在胃癌的發生發展和預后中,不同的lncRNAs表現各異,發揮作用的機制也各不相同。同一種lncRNAs也可能有多重機制共同參與胃癌的發生發展及預后過程。lncRNAs在胃癌的發生發展和預后中發揮著重要的作用,但對于lncRNAs的發揮作用的復雜機制還所知甚少,亟待進一步的研究。
3 lncRNA與胃癌的耐藥性
3.1胃癌多耐藥性相關lncRNAs的發現
Wang等[31]利用高通量lncRNA芯片比較胃癌耐藥細胞株SGC7901/ADR、SGC7901/VCR與親本細胞SGC7901lncRNA表達譜差異發現,DMTF1v4在兩耐藥細胞中上調倍數最為明顯。通過差異倍數、鄰近編碼基因信息分析,phylop物種進化保守性評分,表達驗證等多步篩選策略提示DMTF1v4可能是胃癌耐藥關鍵lncRNA分子。通過實時定量PCR檢測40例原發胃腺癌組織中DMTF1v4與癌旁正常組織相比的相對表達水平,并分為DMTF1v4高表達組及低表達組。分別檢測兩組胃腺癌組織體外組織培養藥物(阿霉素)抑制率,發現DMTF1v4表達水平與藥物抑制率呈負相關。并且DMTF1v4高表達組及低表達組中,DMTF1v4的表達水平與藥物抑制率呈線性負相關。Wang等[32]還發現在SGC7901/ADR和SGC7901/ VCR這兩種多藥耐藥的胃癌細胞系中,MRUL (MDR-related and up-regulated lncRNA)基因表達顯著上調,在胃癌組織中MRUL的相對表達水平與體外用化療藥物治療的胃癌樣本的生長抑制率呈負相關。
3.2lncRNAs在胃癌多耐藥性中的作用機制
Wang等使用小干擾RNA瞬轉的方法下調DMTF1v4在胃癌耐藥細胞系中的表達,通過MTT檢測、平板克隆實驗、藥物半數致死劑量檢測等發現DMTF1v4的下調增加了胃癌耐藥細胞系SGC7901/ ADR以及SGC7901/VCR對P-糖蛋白相關化療藥物敏感度。通過流式細胞術檢測顯示,下調DMTF1v4表達水平導致SGC7901/ADR細胞與對照組相比72h后凋亡比例顯著增加。利用阿霉素蓄積潴留實驗發現DMTF1v4表達水平下調使胃癌耐藥細胞SGC7901/ ADR中化療藥物阿霉素蓄積比例增加、外排比例減少。Wang等還構建了裸鼠皮下異位胃癌耐藥細胞移植瘤模型。實驗表明,與對照組相比,DMTF1v4下調組腫瘤增殖明顯受抑制。通過蛋白印記試驗等技術發現DMTF1v4表達下調導致SGC7901/ADR細胞P-糖蛋白表達水平隨之顯著下調。利用同源重組原理構建DMTF1v4分子不同片段,將其插入熒光素酶報告基因載體pGL4.24中并轉染入293細胞,結果顯示DMTF1v4對P-糖蛋白的表達有增強子樣作用。以上結果表明,DMTF1v4可能是影響胃癌耐藥性狀的關鍵lncRNA分子。DMTF1v4通過促進細胞膜P-糖蛋白的表達導致胃癌耐藥細胞系中P-糖蛋白相關化療藥物外排增多、攝入減少進而對P-糖蛋白相關化療藥物產生耐藥。
Wang等[32]發現在SGC7901/ADR和SGC7901/ VCR中敲除MRUL可使得細胞凋亡增加和細胞對化療藥物攝取增多。MRUL是位于三磷酸腺苷結合轉運蛋白ABCB1(ATP-binding cassette,sub-family B,member 1)下游400 kb的lncRNA。MRUL表達水平的下調可降低ACBC1 mRNA的水平。熒光素酶報告試驗顯示MRUL可能通過非獨立的方向位點的方式正面影響ACBC1的表達,從而影響到胃癌細胞的多耐藥性。這一研究表明了MRUL在ABCB1表達的調節中有積極作用并且可能成為逆轉胃癌多耐藥細胞系多耐藥表型的新靶點。
以上結果從轉錄水平闡述了lncRNAs對胃癌的多耐藥性的調控機制,說明lncRNAs在胃癌多耐藥性表型中也扮演著重要角色,能夠為逆轉胃癌多耐藥性提供新思路。
4 結語
lncRNAs與胃癌發生發展、診斷、預后及耐藥性關系密切。一些lncRNAs研究顯示了其在胃癌研究中的重要地位,可作為胃癌早期診斷的新生物標記及防治新靶點。目前有關胃癌的lncRNAs的研究仍較為片面,不夠深入,處于初級階段,依然面臨著諸多的問題和挑戰。在血漿、胃液中能否發現特異度更高的可供胃癌篩查使用的lncRNAs?在組織中能否發現靈敏度更高的可供胃癌確診使用的lncRNAs?哪些lncRNAs的變化有助于臨床醫生對胃癌患者病程進行更加精確的判斷?針對特定lncRNAs的分子靶向治療能否有效逆轉胃癌多耐藥性表型?這些都是亟待研究的問題。lncRNAs與胃癌的相關研究應緊密結合臨床,注重科研成果從基礎到臨床的轉化。相信隨著lncRNAs與胃癌相關研究的進一步深入,能夠使得胃癌的診斷治療取得新的進步。
1 Zou XN,Sun XB,Chen WQ,et al.Analysis of incidence and mortality of stomach cancer in China from 2003 to 2007[J].Tumor. 2012,32(2):109-114.[鄒小農,孫喜斌,陳萬青,等.2003-2007年中國胃癌發病與死亡情況分析[J].腫瘤,2012,32(2):109-114.]
2 Song H,Sun W,Ye G,et al.Long non-coding RNA expression profile in human gastric cancer and its clinical significances[J].J Transl Med,2013,11:225.
3 Cao WJ,Wu HL,He BS,et al.Analysis of long non-coding RNA expression profiles in gastric cancer[J].World J Gastroenterol,2013,19(23):3658-3664.
4 Wang Y,Gao S,Liu G,et al.Microarray expression profile analysis of long non-coding RNAs in human gastric cardiac adenocarcinoma[J].Cell Physiol Biochem,2014,33(4):1225-1238.
5 Arita T,Ichikawa D,Konishi H,et al.Circulating long non-coding RNAs in plasma of patients with gastric cancer[J].Anticancer Res,2013,33(8):3185-3193.
6 Shao Y,Ye M,Jiang X,et al.Gastric juice long noncoding RNA used as a tumor marker for screening gastric cancer[J].Cancer,2014,120(21):3320-3328.
7 Pang Q,Ge J,Shao Y,et al.Increased expression of long intergenic non-coding RNA LINC00152 in gastric cancer and its clinical significance[J].Tumour Biol,2014,35(6):5441-5447.
8 Liu L,Yan B,Yang Z,et al.ncRuPAR inhibits gastric cancer progression by down-regulating protease-activated receptor-1[J].Tumour Biol,2014,35(8):7821-7829.
9 Shao Y,Chen H,Jiang X,et al.Low expression of lncRNA-HMlincRNA717 in human gastric cancer and its clinical significances[J]. Tumour Biol,2014,35(10):9591-9595.
10 Lin X,Yang M,Xia T,et al.Increased expression of long noncoding RNA ABHD11-AS1 in gastric cancer and its clinical significance[J].Med Oncol,2014,31(7):42.
11 Sun W,Wu Y,Yu X,et al.Decreased expression of long noncoding RNA AC096655.1-002 in gastric cancer and its clinical significance[J].Tumour Biol,2013,34(5):2697-2701.
12 Mei D,Song H,Wang K,et al.Up-regulation of SUMO1 pseudogene 3(SUMO1P3)in gastric cancer and its clinical association[J]. Med Oncol,2013,30(4):709.
13 Yang F,Bi J,Xue X,et al.Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J].FEBS J,2012,279(17):3159-3165.
14 Zhuang M,Gao W,Xu J,et al.The long non-coding RNA H19-derived miR-675 modulates human gastric cancer cell proliferation by targeting tumor suppressor RUNX1[J].Biochem Biophys Res Commun,2014,448(3):315-322.
15 Li H,Yu B,Li J,et al.Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J].Oncotarget,2014,5(8):2318-2329.
16 Zhang EB,Han L,Yin DD,et al.c-Myc-induced,long,noncoding H19 affects cell proliferation and predicts a poor prognosis in patients with gastric cancer[J].Med Oncol,2014,31(5):914.
17 Hajjari M,Behmanesh M,Sadeghizadeh M,et al.Up-regulation of HOTAIR long non-coding RNA in human gastric adenocarcinoma tissues[J].Med Oncol,2013,30(3):670.
18 Xu ZY,Yu QM,Du YA,et al.Knockdown of long non-coding RNA HOTAIR suppresses tumor invasion and reverses epithelial-mesenchymal transition in gastric cancer[J].Int J Biol Sci,2013,9 (6):587-597.
19 Endo H,Shiroki T,Nakagawa T,et al.Enhanced expression of long non-coding RNA HOTAIR is associated with the development of gastric cancer[J].PLoS One,2013,8(10):e77070.
20 Liu XH,Sun M,Nie FQ,et al.Lnc RNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J].Mol Cancer,2014,13:92 21 Sun M,Xia R,Jin F,et al.Downregulated long noncoding RNA MEG3 is associated with poor prognosis and promotes cell proliferation in gastric cancer[J].Tumour Biol,2014,35(2):1065-1073.
22 Yan J,Guo X,Xia J,et al.MiR-148a regulates MEG3 in gastriccancer by targeting DNA methyltransferase 1[J].Med Oncol,2014,31(3):879.
23 Zhang EB,Kong R,Yin DD,et al.Long noncoding RNA ANRIL indicates a poor prognosis of gastric cancer and promotes tumor growth by epigenetically silencing of miR-99a/miR-449a[J].Oncotarget,2014,5(8):2276-2292.
24 Zhao Y,Guo Q,Chen J,et al.Role of long non-coding RNA HULC in cell proliferation,apoptosis and tumor metastasis of gastric cancer:a clinical and in vitro investigation[J].Oncol Rep,2014,31(1):358-364.
25 Wang J,Su L,Chen X,et al.MALAT1 promotes cell proliferation in gastric cancer by recruiting SF2/ASF[J].Biomed Pharmacother,2014,68(5):557-564.
26 Park SM,Park SJ,Kim HJ,et al.A known expressed sequence tag,BM742401,is a potent lincRNA inhibiting cancer metastasis[J].Exp Mol Med,2013,45:e31.
27 Yang F,Xue X,Bi J,et al.Long noncoding RNA CCAT1,which could be activated by c-Myc,promotes the progression of gastric carcinoma[J].J Cancer Res Clin Oncol,2013,139(3):437-445.
28 Liu Z,Shao Y,Tan L,et al.Clinical significance of the low expression of FER1L4 in gastric cancer patients[J].Tumour Biol,2014,35 (10):9613-9617.
29 Xu C,Shao Y,Xia T,et al.lncRNA-AC130710 targeting by miR-129-5p is upregulated in gastric cancer and associates with poor prognosis[J].Tumour Biol,2014,35(10):9701-9706.
30 Sun M,Jin FY,Xia R,et al.Decreased expression of long noncoding RNA GAS5 indicates a poor prognosis and promotes cell proliferation in gastric cancer[J].BMC Cancer,2014,14:319.
31 Wang Y.Function and mechanisms of lncRNA DMTF1v4(NR_ 024549)in development of multidurug resistance of gastric cancer [D].The Fourth Military Medical University,2012.[王穎.長鏈非編碼RNA DMTF1v4(NR_024549)在胃癌多藥耐藥中的作用及機制研究[D].第四軍醫大學,2012.]
32 Wang Y,Zhang D,Wu K,et al.Long non-coding RNA MRUL promotes ABCB1 expression in multidrug-resistant gastric cancer cell sublines[J].Mol Cell Biol,2014,34(17):3182-3193.
(2014-08-27收稿)
(2014-10-25修回)
(編輯:賈樹明)

徐天蔚專業方向為胃腸道腫瘤分子生物學。E-mail:260668028@qq.com
Research progress in lncRNAs and the diagnosis,prognosis,and drug resistance of gastric cancer
Tianwei XU1,Zhaoxia WANG2
Long non-coding RNAs(lncRNAs)are noncoding RNAs with lengths exceeding 200 bp.These lncRNAs cannot code complete proteins but control gene expression.Recent studies have shown that lncRNAs are closely related to the diagnosis,prognosis, and drug resistance of gastric cancer.This article summarizes the recent progress of studies in China and abroad on lncRNAs relative to the diagnosis,prognosis,and drug resistance of gastric cancer.
long non-coding RNA,gastric cancer,diagnosis,prognosis,drug resistance
10.3969/j.issn.1000-8179.20141326
①南京醫科大學第一臨床醫學院臨床醫學系(南京市210029);②南京醫科大學第二附屬醫院腫瘤科
*本文課題受國家自然科學基金項目(編號:81272601)和江蘇省科技廳臨床醫學科技專項基金項目(編號:BL2014096)和江蘇省醫學重點人才基金項目(編號:RC2011080)資助
王朝霞zhaoxiawang88@hotmail.com

