溴氰菊酯對菲律賓蛤仔體內酶活性和組織損傷的初步探索
許貽斌,鄭惠東,陳宇鋒,鄭盛華,陳小紅,鐘碩良,*
1. 福建省水產研究所,廈門 361013 2. 福建省海洋生物增養殖與高值化利用重點實驗室,廈門 361013
溴氰菊酯對菲律賓蛤仔體內酶活性和組織損傷的初步探索
許貽斌1,2,鄭惠東1,2,陳宇鋒1,2,鄭盛華1,2,陳小紅1,2,鐘碩良1,2,*
1. 福建省水產研究所,廈門 361013 2. 福建省海洋生物增養殖與高值化利用重點實驗室,廈門 361013
采用不同質量濃度的溴氰菊酯(0.0070 mg·L-1、0.014 mg·L-1、0.020 mg·L-1、0.027 mg·L-1)對菲律賓蛤仔進行20 d半靜置染毒,測定不同時間淋巴液中乙酰膽堿酯酶(AChE)和鈉離子-鉀離子-三磷酸腺苷酶(Na+-K+-ATPase)活性、鰓和肝臟中谷胱甘肽轉硫酶(GST)活性的變化,并觀察染毒20 d后鰓絲組織和消化盲囊組織的損傷情況。酶活性分析結果顯示,與對照組相比,低濃度組(0.0070 mg·L-1)試驗期間酶活性均無顯著差異(P > 0.05);中濃度組(0.014 mg·L-1、0.020 mg·L-1)淋巴液中AChE和Na+-K+-ATPase均呈先激活后抑制的變化規律(P < 0.05),鰓和肝臟中GST活性均呈上升趨勢(P < 0.05);高濃度組(0.027 mg·L-1)淋巴液中AChE和Na+-K+-ATPase、肝臟中GST活性在試驗期間持續下降(P < 0.01),而鰓中GST活性呈先抑制后升高的趨勢(P < 0.05)。研究表明,低中濃度的溴氰菊酯對菲律賓蛤仔體內的酶活性表現為先誘導后抑制,具有明顯的時間、劑量效應;高濃度的溴氰菊酯對菲律賓蛤仔體內酶活持續抑制,且染毒濃度越高,組織細胞變異越顯著,表現為鰓絲上皮細胞纖毛層萎縮、纖毛脫落,消化盲囊上皮細胞膨脹,出現包涵體樣結構。
溴氰菊酯;菲律賓蛤仔;酶活性;組織損傷
溴氰菊酯(deltamethrin)又名敵殺死,化學式為C22H19Br2NO3,是Ellion于1974年在研究天然除蟲菊酯化學結構的基礎上合成的一種含有α-氰基的Ⅱ型擬除蟲菊酯類仿生殺蟲劑[1]。溴氰菊酯性質穩定,殺蟲譜廣,殺蟲活性高,屬神經性毒劑,其對高等動物的毒性中等,但對魚類等水生生物為高毒[2]。目前的大多數研究主要集中在其對魚、蝦類的急性和亞急性毒性試驗[3-5],而對在水環境中占有重要地位的貝類的毒性及作用機制研究很少。
菲律賓蛤仔(Ruditapes philippinarum)廣泛分布于中國南部沿海,是中國主要的經濟貝類之一。由于其生長迅速、生殖周期短、容易飼養、基礎研究較為深入等特點,是理想的模式動物,經常被用于環境毒理學的相關研究[6]。研究表明,重金屬[7]、酚類污染物[8]、十溴聯苯醚[6]等對菲律賓蛤仔體內的抗氧化酶活性的影響均表現出一定的規律性。而至今,溴氰菊酯對菲律賓蛤仔的毒性研究主要在急性毒性效應方面[9],致毒機制的研究尚未見報道。本項目通過研究不同時間、不同濃度溴氰菊酯對菲律賓蛤仔淋巴液中乙酰膽堿酯酶(AChE)和鈉離子-鉀離子-三磷酸腺苷酶(Na+-K+-ATPase)活性、鰓和肝臟中谷胱甘肽轉硫酶(GST)活性的變化,觀察染毒后溴氰菊酯對鰓絲組織和消化盲囊組織的影響,探討相互間的濃度-效應關系,尋找敏感指標,以期從免疫酶學及組織病理學角度探討溴氰菊酯對菲律賓蛤仔的毒性作用機制。
1 材料與方法 (Materials and methods)
1.1試驗材料
菲律賓蛤仔:殼長為(3.87 ± 0.24) cm,體重為(11.4 ± 1.75) g,購于東山灣菲律賓蛤仔養殖區,當天陰涼干運至福建省海水魚類科研繁育中試基地。
溴氰菊酯原藥:濃度為25 g·L-1,山東鄒平農藥有限公司生產,用蒸餾水溶解稀釋成50.0 g·L-1母液備用;其余試劑均為國產分析純。
1.2試驗方法
采用GB/T16310.1—1996《船舶散裝運輸液體化學品危害性評價規范 水生生物急性毒性試驗方法》,求出溴氰菊酯對菲律賓蛤仔的96 h半致死質量濃度(96 h-LC50)為0.057 mg·L-1。菲律賓蛤仔在3.7 m×2.0 m×0.5 m水泥池中適應5 d后開始正式試驗,選取96 h-LC50的1/2以下5個濃度梯度(0、0.0070 mg·L-1、0.014 mg·L-1、0.020 mg·L-1、0.027 mg·L-1)對菲律賓蛤仔進行半靜置染毒,每個池子投放密度50~60個·m-2,各組均設2個平行。試驗過程不投餌,每24 h更換1次試驗液,暴露20 d。分別在用藥后的5 d、10 d、15 d、20 d采樣,做好記錄后立即置于-40 ℃保存備用,以進行菲律賓蛤仔體內組織中AChE、Na+-K+-ATPase和GST活性分析和細胞組織切片觀察。試驗期間保證養殖水溫(20.5 ± 0.65) ℃,溶氧(6.27 ± 0.10) mg·L-1,pH值為(7.69 ± 0.04),鹽度(29.1 ± 0.2)。
1.3樣品處理及酶活性的測定方法
取菲律賓蛤仔體液、鰓、肝樣品,其中鰓、肝樣品分別在冰水浴中研磨后加入9倍體積預冷的PBS緩沖液(pH 7.2),4 ℃離心取上清液稀釋10倍后用于酶活性分析。AChE、Na+-K+-ATPase以及GST活性測定參照試劑盒(購自南京建成生物研究所)說明書進行。
1.4光鏡樣品的制備與觀察[10]
取菲律賓蛤仔的鰓、消化盲囊組織,大小在0.5 cm3以內,用Bouin’s液固定,常規梯度乙醇(體積分數為70%、80%、85%、95%、100%)脫水,二甲苯透明,石蠟包埋,德國Leicar RM2145切片機連續切片,厚度為5 μm,經蘇木素-伊紅染色,脫水封片后,在Leica DMR熒光倒置顯微鏡下觀察并拍照記錄樣品。
1.5數據處理
試驗數據用SPSS16.0統計軟件進行單因素方差分析(one-way ANOVA),對均值進行差異顯著性檢驗。
2 結果與分析(Results and analysis)
2.1溴氰菊酯對菲律賓蛤仔淋巴液中AChE和Na+-K+-ATPase活性的影響
圖1顯示,整個試驗期間除低濃度組和高濃度組外,其余2組AChE活性均呈現先激活后抑制的現象。其中0.0070 mg·L-1組由于濃度較低,整個試驗期間AChE活性均無顯著性變化(P > 0.05);0.014 mg·L-1組在暴露第5~15天時AChE活性均顯著高于對照組(P < 0.05),在暴露第15天時AChE活性達到最高值,比對照組上升了45.4%,在暴露第20天時,AChE活性下降到正常水平;0.020 mg·L-1組在暴露第5天時AChE活性最高,比對照組上升了16.5%,之后持續下降;0.027 mg·L-1組在整個試驗期間AChE活性持續下降,均顯著低于對照組(P < 0.05)。在暴露第20天,4組AChE活性受到的抑制率分別為2.3%(P > 0.05)、7.0%(P > 0.05)、20.9%( P < 0.05)、27.9%( P < 0.01)。

圖1 溴氰菊酯對菲律賓蛤仔淋巴液中AChE活性的影響注:a,差異顯著P < 0.05;b,差異極顯著P < 0.01,下圖同。Fig. 1 Effects of deltamethrin on the activities of AChE in the lymph of Ruditapes philippinarumNote:a, significant difference (P < 0.05); b, extremely significant difference (P < 0.01); the same as below.
圖2顯示,整個試驗期間除低濃度組和高濃度組外,其余2組Na+-K+-ATPase活性均呈現先激活后抑制的現象,并且較高濃度組活性升高幅度最大,下降速度也快于較低濃度組。0.0070 mg·L-1組由于濃度較低,整個試驗期間Na+-K+-ATPase活性均無顯著性變化;0.014 mg·L-1、0.020 mg·L-1組在暴露第5天和第10天時Na+-K+-ATPase活性均顯著高于對照組(P < 0.05),在暴露第10天時Na+-K+-ATPase活性最高,分別比對照組上升了16.3%、16.7%,之后2組Na+-K+-ATPase活性均受到不同程度的抑制;0.027 mg·L-1組在試驗期間Na+-K+-ATPase活性持續下降,顯著低于對照組(P < 0.05)。在暴露第20天,4組Na+-K+-ATPase活性受到的抑制率分別為15.0%(P > 0.05)、18.9%(P < 0.05)、28.5%(P < 0.01)、34.5%(P < 0.01)。
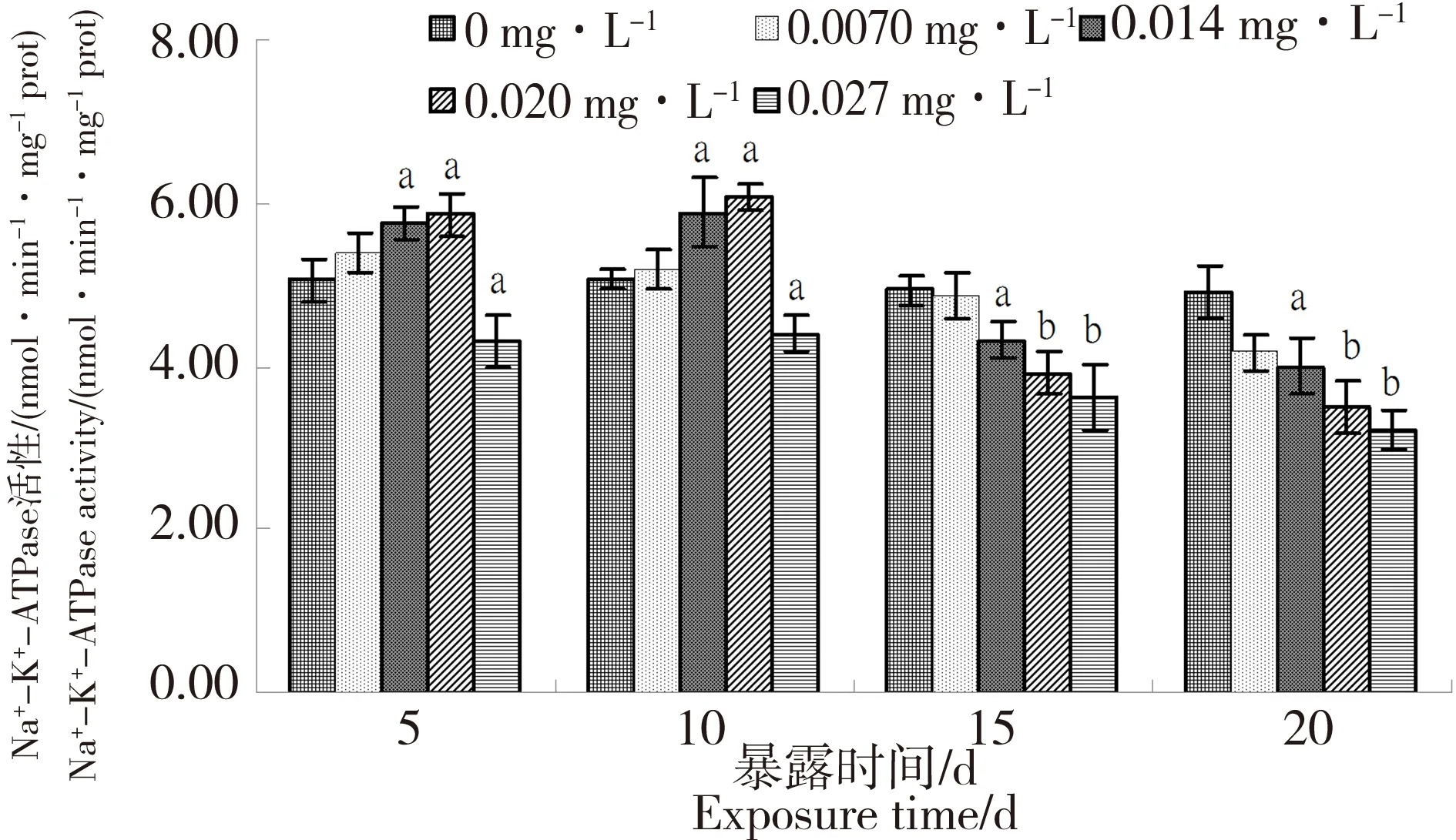
圖2 溴氰菊酯對菲律賓蛤仔淋巴液中Na+-K+-ATPase活性的影響Fig. 2 Effects of deltamethrin on the activities of Na+-K+-ATPase in the lymph of Ruditaes philippinarum
2.2溴氰菊酯對菲律賓蛤仔鰓和肝臟中GST活性的影響
圖3所示的為溴氰菊酯對菲律賓蛤仔鰓中GST活性的影響。0.0070 mg·L-1組由于濃度較低,整個試驗期間鰓GST活性均無顯著性變化;0.014 mg·L-1組和0.020 mg·L-1組試驗期間鰓GST活性總體均呈上升趨勢,0.014 mg·L-1組GST活性上升速度最快,在暴露第20天2組GST活性分別比對照組上升了33.2%(P < 0.01)、20.2%(P < 0.05);0.027 mg·L-1組在試驗期間鰓GST活性呈先抑制后緩慢上升趨勢,在暴露第5天時活性最低,抑制率為21.8%(P < 0.05),暴露第15~20天時,與對照組無顯著差異。
圖4所示的為溴氰菊酯對菲律賓蛤仔肝臟中GST活性的影響。除0.027 mg·L-1組外,隨著暴露時間的延長,肝臟GST活性均有先升高后緩慢降低的趨勢。0.0070 mg·L-1組在暴露第15天時肝臟GST活性比對照組上升了9.60%,顯著高于對照組(P < 0.05);0.014 mg·L-1和0.020 mg·L-1組在整個試驗期間均顯著高于對照組(P < 0.05),其中0.014 mg·L-1組在暴露第15天時最高,比對照組上升29.8%(P < 0.01),0.020 mg·L-1組暴露第10天時最高,比對照組上升25.6%(P < 0.01);0.027 mg·L-1組GST活性在試驗期間持續下降,在暴露第20 天時抑制率為18.4%(P < 0.01)。而其他3組在暴露第20天時,肝臟GST活性分別比對照組升高了10.4%(P > 0.05)、28.4%(P < 0.01)、19.9%(P < 0.01)。
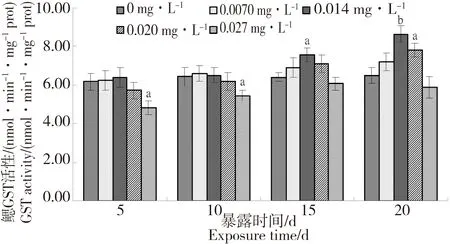
圖3 溴氰菊酯對菲律賓蛤仔鰓中GST活性的影響Fig. 3 Effects of deltamethrin on the activities of GST in the gill of Ruditapes philippinarum

圖4 溴氰菊酯對菲律賓蛤仔肝臟中GST活性的影響Fig. 4 Effects of deltamethrin on the activities of GST in the liver of Ruditapes philippinarum
2.3菲律賓蛤仔鰓絲組織切片結果
本試驗觀察了0 mg·L-1、0.0070 mg·L-1、0.014 mg·L-1、0.027 mg·L-1這4個劑量組的染毒20 d后鰓絲組織切片樣本。圖5a顯示,對照組菲律賓蛤仔鰓上皮細胞規則,上皮細胞形態正常,可見完整的纖毛層;染毒濃度0.0070 mg·L-1組鰓絲上皮細胞較規則,可見較完整的纖毛層(圖5b);染毒濃度0.014 mg·L-1組和0.027 mg·L-1組鰓絲上皮細胞纖毛層萎縮、纖毛脫落,0.027 mg·L-1組變異程度高于0.014 mg·L-1組(圖5c、圖5d)。說明同樣的時間效應下,溴氰菊酯的濃度和菲律賓蛤仔的鰓絲組織細胞損傷程度成正相關。

圖5 溴氰菊酯不同染毒濃度對菲律賓蛤仔鰓組織的影響注:a,鰓絲對照組(標志線:=42.5 μm);b,染毒濃度0.0070 mg·L-1組(標志線:=85 μm);c,染毒濃度0.014 mg·L-1組(標志線:=85 μm);d,染毒濃度0.027 mg·L-1組(標志線:=85 μm)。Fig. 5 Pathological changes of gill of Ruditapes philippinarum exposed to deltamethrinNote: a, The control group (scale bar=42.5 μm); b, 20 d treatment at the dose of 0.0070 mg·L-1 (scale bar =85 μm); c, 20 d treatment at the dose of 0.014 mg·L-1 (scale bar =85 μm); d, 20 d treatment at the dose of 0.027 mg·L-1 (scale bar =85 μm).
2.4菲律賓蛤仔消化盲囊組織切片結果
本試驗觀察了0、0.0070 mg·L-1、0.014 mg·L-1、0.027 mg·L-14個劑量組的染毒20 d后消化盲囊組織切片樣本。對照組菲律賓蛤仔消化盲囊上皮細胞形態正常(圖6a);染毒濃度0.0070 mg·L-1組上皮細胞膨脹,沒有出現細胞變異(圖6b);隨著染毒濃度的增加,上皮細胞膨脹逐漸嚴重,細胞發生變異,0.014 mg·L-1組和0.027 mg·L-1組均出現包涵體樣結構(圖6c、圖6d),這可能是生物應對外界不良環境的一種應激體現。說明同樣的時間效應下,溴氰菊酯的濃度和菲律賓蛤仔的消化盲囊組織細胞損傷成正相關。
3 討論(Discussion)
目前對擬除蟲菊酯的神經毒性作用機制的研究普遍認為乙酰膽堿酯酶(AChE)和腺苷三磷酸酶(ATPase)為此類化合物作用的靶標酶[11-12]。AChE是生物神經傳導中的一種關鍵酶,在神經傳導中執行著重要的功能。該酶降解乙酰膽堿,終止神經遞質對于突觸后膜興奮刺激作用,保證神經信號分子在生物體內正常的傳導[13]。AChE作為生物體的一種生化指標,已被廣泛應用于農藥毒性和環境污染評價[14]。Na+-K+-ATPase是存在于細胞質膜上水解ATP獲得能量、逆電化學梯度轉運Na+,同時反方向轉運K+的一種內膜蛋白,也稱鈉泵,其廣泛存在于各類細胞質膜上,是多種毒物作用的靶位點,對毒物十分敏感[15]。由于國內外溴氰菊酯對貝類的相關文獻較少,比較其他類似的報道有,Naomi等[16]研究暴露于0.5~1.0 mg·L-1毒死蜱后亞洲蛤(Corbicula fluminea)體內AchE活性有顯著的下降,96 h后,抑制率分別為84%(0.5 mg·L-1)和87%(1.0 mg·L-1)。Mchenery等[17]報道敵敵畏對紫貽貝(Mytilus edulis L.)鰓中AchE活性呈現低濃度增加,高濃度降低的情況。譚曉珍等[18]研究發現,暴露與氯氰菊酯和氰戊菊酯后櫛孔扇貝(Chlamys farreri)鰓中Na+-K+-ATPase活性隨農藥濃度的增加而升高。本試驗結果表明:溴氰菊酯的低濃度組對菲律賓蛤仔淋巴液中AChE和Na+-K+-ATPase活性均無顯著性改變,中濃度組則均呈先激活后抑制的變化規律,而高濃度組試驗期間AChE和Na+-K+-ATPase活性均持續受到抑制。同時,在試驗初期呈現出一定的濃度-劑量效應,隨著溴氰菊酯濃度的增加和染毒時間的延長,對AChE和Na+-K+-ATPase的抑制均增強。筆者認為,出現這種現象可能是生物體抵抗外界不良環境的一種應激反應,此時機體將調動各方面的能力包括淋巴液中酶的超常活動,以抵抗外來危害。而隨著試驗時間的延長和溴氰菊酯的累積,超出機體的調節能力,導致機體正常功能受到了嚴重干擾,最終表現為抑制作用。
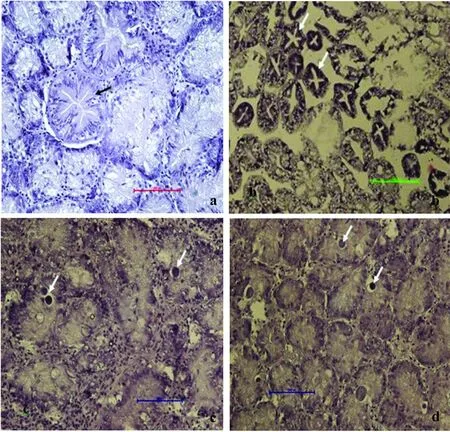
圖6 溴氰菊酯不同染毒濃度對菲律賓蛤仔消化盲囊的影響注:a,消化盲囊對照組(標志線:=85 μm);b,染毒濃度0.0070 mg·L-1組(標志線:=85 μm);c,染毒濃度0.014 mg·L-1組(標志線:=85 μm);d,染毒濃度0.027 mg·L-1組(標志線:=85 μm)。Fig. 6 Pathological changes of digestive diverticula of Ruditapes philippinarum exposed to deltamethrinNote: a, The control group (scale bar=85 μm); b, 20 d treatment at the dose of 0.0070 mg·L-1 (scale bar =85 μm); c, 20 d treatment at the dose of 0.014 mg·L-1 (scale bar =85 μm); d, 20 d treatment at the dose of 0.027 mg·L-1 (scale bar =85 μm).
谷胱甘肽轉硫酶(GST)屬于Ⅱ相酶類,可以催化從Ⅰ相代謝產生的親電子性的物質,形成疏水性化合物,容易隨膽汁排出體外,起到解毒的功能[19]。GST不但是解毒系統第二階段的解毒酶,而且還是重要抗氧化系統酶,其活性的高低間接反映了機體清除自由基的能力,同時GST可作為水環境中農藥污染物的生化標記[20-21]。任加云和李樹峰[22]的研究表明櫛孔扇貝在低質量濃度(0.5 μg·L-1、1.0 μg·L-1)多氯聯苯處理下,消化盲囊和鰓絲的GST活力均呈上升的趨勢,而在高質量濃度(10 μg·L-1、50 μg·L-1)下,GST活力均呈先上升后下降的趨勢。陳穎[23]研究四溴雙酚A(TBBPA)對翡翠貽貝(Perna viridis)肝胰腺GST活性的影響表明,低濃度(或暴露初期)可誘導GST活性,而250 μg·L-1(或暴露后期)表現為抑制作用。張先勇等[24]研究苯并[a]芘對馬氏珠母貝(Pinctada martensi)肝組織的毒性作用時發現,在暴露3 d時,GST活性被激活,在7 d和10 d受到抑制。本試驗中溴氰菊酯對菲律賓蛤仔鰓和肝臟中GST活性的影響結果表明:低、中濃度組的菲律賓蛤仔隨著暴露時間的延長,其鰓和肝中GST活性總體呈上升趨勢,且肝中GST活性上升速度較快;高濃度組鰓和肝中GST活性均受到抑制。原因可能是與鰓長期和外界直接接觸,對外界環境刺激反應弱化,而肝臟是菲律賓蛤仔重要的解毒器官有關。同時隨著染毒時間的延長,溴氰菊酯對肝臟GST活性的抑制作用加強,這可能是由于隨著時間的延長,肝臟等組織細胞受損程度加重,甚至壞死,致使GST合成逐漸減少。
鰓是雙殼貝類的呼吸濾食器官,直接與水環境接觸,具有氣體交換和調節離子平衡的重要作用。鰓的損壞往往破壞其呼吸作用,打破體內離子平衡,甚至導致生物體的死亡[25]。消化盲囊是貝類消化和解毒代謝的主要器官,其中消化細胞負責營養物質消化、吸收及儲存能量。關于擬除蟲菊酯殺蟲劑對魚類的組織病理學研究較多[26-27],對貝類研究未見報道。本研究結果表明,隨著染毒濃度的升高,細胞損傷變異顯著。鰓絲上皮細胞表現為纖毛層萎縮、纖毛脫落;消化盲囊上皮細胞膨脹,出現包涵體樣結構。總體上,溴氰菊酯濃度和菲律賓蛤仔的組織細胞損傷程度呈正相關,說明在亞急性實驗中,溴氰菊酯對通過損傷菲律賓蛤仔的鰓組織和消化盲囊細胞來影響著菲律賓蛤仔的新陳代謝,包括細胞免疫酶的反應,進而導致菲律賓蛤仔的死亡,且該影響是緩慢的,漸進的。本研究結果對于菲律賓蛤仔生產中溴氰菊酯的安全使用和水產品質量安全有著一定的指導和參考意義。
通訊作者簡介:鐘碩良(1953-),男,教授級高工,從事海洋與漁業生態環境研究。
[1]朱良天. 農藥[M]. 北京: 化學工業出版社, 2004: 120- 150
[2]陳家長, 吳偉, 瞿建宏. 溴氰菊酯脅迫下羅非魚組織中過氧化氫酶和單胺氧化酶的變化[J]. 農業環境科學學報, 2006, 25(6): 1441-1445
Chen J Z, Wu W, Qu J H, et al. Activities of catalase and monoamine oxidase in different tissues of tilapia under stress of deltamethrin [J]. Journal of Agro-Environment Science, 2006, 25(6): 1441-1445 (in Chinese)
[3]夏偉. 溴氰菊酯對鯽魚的分子毒理效應研究[D]. 武漢: 華中師范大學, 2008: 1-44
Xia W. Molecular toxicology of deltamethrin to Carassius auratus [D]. Wuhan: Central China Normal University, 2008: 1-44 (in Chinese)
[4]周志剛, 王明學, 呂敢堂. 溴氰菊酯對草魚魚種腦AChE及ATP酶活性的影響[J]. 華中農業大學學報, 1999(2): 176-179
Zhou Z G, Wang M X, Lu G T. The effects of decamethrin on brain AChE and ATPase activities of grass carp (Ctenopharygodon idellus) fingerlings [J]. Journal of Huazhong Agricultural University, 1999(2): 176-179 (in Chinese)
[5]魏華, 吳楠, 沈竑, 等. 溴氰菊酯對克氏原螯蝦的氧化脅迫效應[J]. 水產學報, 2010, 34(5): 733-739
Wei H, Wu N,Shen H, et al. Oxidative stress of deltamethrin to the liver of crayfish (Procambarus clarkii) [J]. Journal of Fisheries of China, 2010, 34(5): 733-739 (in Chinese)
[6]張喆, 馬勝偉, 王賀威, 等. 十溴聯苯醚(BDE-209)對菲律賓蛤仔外套膜抗氧化酶活性的影響[J]. 生態學雜志, 2013, 32(1): 122-128
Zhang Z, Ma S W, Wang H W, et al. Effects of decabromodiphenyl ether (BDE-209) on the antioxidant enzyme activities of Lutjanus argentimaculatus mantle membrane [J]. Chinese Journal of Ecology, 2013, 32(1): 122-128 (in Chinese)
[7]張林寶, 吳惠豐, 孫偉, 等. 菲律賓蛤仔對鎘、銅暴露的蓄積作用及其抗氧化酶系統的響應研究[J]. 南方水產科學, 2013, 9(5): 64-70
Zhang L B, Wu H F, Sun W, et al.Bioaccumulation and antioxidant responses in Manila clam (Ruditapes philippinarum) under cadmium and copper exposure [J]. South China Fisheries Science, 2013, 9(5): 64-70 (in Chinese)
[8]張海麗, 邊海燕, 楊躍志, 等. 酚類污染物對菲律賓蛤仔抗氧化和解毒系統相關酶活性的影響[J]. 中國海洋大學學報, 2012, 42(3): 21-26
Zhang H L, Bian H Y, Yang Y Z, et al. Effects of phenolic compounds on enzyme activities of antioxidant and detoxification systems in Ruditapes philippinarum [J]. Periodical of Ocean University of China, 2012, 42(3): 21-26 (in Chinese)
[9]姜雙城. 溴氰菊酯對菲律賓蛤仔急性毒性研究[J]. 福建水產, 2010(1): 41-45
Jiang S C. The acute toxicity study of deltamethrin to Philippinarum ruditapes [J]. Journal of Fujian Fisheries, 2010(1): 41-45 (in Chinese)
[10]閆海燕, 曾令兵, 羅宇良, 等. 氰戊菊酯對鯉SOD活性和MDA含量以及肝腎細胞形態的影響[J]. 華中農業大學學報, 2012, 31(4): 499-505
Yan H Y, Zeng L B, Luo Y L, et al. Effect of fenvalerate on activity of SOD, content of MDA and histomorphology of liver and kidney of carp [J]. Journal of Huazhong Agricultural University, 2012, 31(4): 499-505 (in Chinese)
[11]謝文平, 朱新平, 陳昆慈, 等. 氯氰菊酯對草魚組織Na+/K+-ATP酶活性及肝、鰓超顯微結構的影響[J].中國水產科學, 2009, 16: 120-125
Xie W P, Zhu X P, Chen K C, et al. Toxic effects of cypermethrin on Na+/K+-ATP activity and ultramicrostructure of gill and liver tissue in grass carp [J]. Journal of Fishery Sciences of China, 2009, 16: 120-125 (in Chinese)
[12]Kakko L, Toimela T, Tahit H. The synaptosomal membrane bound ATPase as a target for the neurotoxic effects of pyrethroids, permethrin and cypermethrin [J]. Chemosphere, 2003, 51: 475-480
[13]徐恩斌, 張忠兵, 謝渭芬. 乙酰膽堿酯酶的研究進展[J]. 國外醫學, 2003, 23(1): 73-75
[14]張明, 李盾, 陳儀本, 等. 乙酰膽堿酯酶分子生物學研究進展[J]. 農藥, 2006, 45(1): 8-11
Zhang M, Li D, Chen Y B, et al. Research progress in acetylcholinesterase molecular biology [J]. Chinese Journal of Pesticides, 2006, 45(1): 8-11 (in Chinese)
[15]溫茹淑, 鄭清梅, 徐鴻飛, 等. Hg2+對草魚魚種腎、鰓Na+/K+-ATPase及其組織結構的影響[J]. 江西農業大學學報, 2012, 34(5): 1014-1020
Wen R S, Zheng Q M, Xu H F, et al. Effects of Hg2+on the Na+/K+-ATPase and histology of the kidney and gill in grass carp [J]. Acta Agriculturae Universitatis Jiangxiensis, 2012, 34(5): 1014-1020 (in Chinese)
[16]Naomi L C, Joseph R B. Cholinesterase inhibition and impacts on behavior of the Asian clam, Corbicula fluminea, after exposure to an organophosphate insecticide [J]. Aquatic Toxicology, 2006, 76(3-4): 258-267
[17]Mchenery J G, Linley-Adams G E, Moore D C, et al. Experimental and field studies of effects of dichlorvos exposure on acetylcholinesterase activity in the gills of the mussel, Mytilus edulis L [J]. Aquatic Toxicology, 1997, 38(1-3): 125-143
[18]譚曉珍, 吳垠, 李韜, 等. 氯氰菊酯和氰戊菊酯對櫛孔扇貝的急性毒性[J]. 大連水產學院學報, 2005, 20(3): 207-302
Tan X Z, Wu Y, Li T, et al. Acute toxicity of cypermethrin and fenvalerate to scallop (Chlamys farreri) [J]. Journal of Dalian Fisheries University, 2005, 20(3): 207-302 (in Chinese)
[19]陳榮, 劉輝, 李東曉, 等. 水生動物谷胱甘肽硫轉移酶研究進展[J]. 廈門大學學報: 自然科學版, 2006, 45: 176-184
Chen R, Liu H,Li D X, et al. A review of gluthione S-transferase in aquatic animal [J]. Journal of Xiamen University: Natural Science, 2006, 45: 176-184 (in Chinese)
[20]Vander Oost R, Beyer J, Vermeulen N P E, et al. Fish bioaccumulation and biomarkers in environmental risk assessment [J]. Environmental Toxicology and Pharmacology, 2003, 13: 57-149
[21]陳家長, 孟順龍, 瞿建宏, 等. 低濃度阿特拉津對鯽魚谷胱甘肽-S轉移酶(GSTs)活性的影響[J]. 生態與農村環境學報, 2007, 23(1): 68-72
Chen J Z, Meng S L, Qu J H, et al. Effects of atrazine on activity of glutathione S-transferases in Carassius auratus [J]. Journal of Ecology and Rural Environment, 2007, 23(1): 68-72 (in Chinese)
[22]任加云, 李樹峰. 多氯聯苯(PCB1254)對櫛孔扇貝消化盲囊和鰓絲EROD、GST酶活力的影響[J]. 中國水產科學, 2008, 15(2): 342-345
Ren J Y, Li S F. Effects of polychlorinated biphenyls 1254(PCB1254) on two enzyme activity of biotransformation in digestive gland and gills of scallop Chlamys ferrari [J]. Journal of Fishery Sciences of China, 2008, 15(2): 342-345 (in Chinese)
[23]陳穎. 四溴雙酚A(TBBPA)對翡翠貽貝(Perna viridis)的亞慢性毒性效應[D]. 廈門: 廈門大學, 2007: 1-70
Chen Y. The subchronic toxic effects on mussel (Perna viridis) with its exposure to bromobisphenol [D]. Xiamen: Xiamen University, 2007: 1-70 (in Chinese)
[24]張先勇, 刁曉平, 王軼, 等. 苯并[a]芘對馬氏珠母貝肝組織抗氧化酶活性的影響[J]. 生態毒理學報, 2011, 6(2): 171-175
Zhang X Y, Diao X P, Wang Y, et al. Effects of B[a]P on activity of antioxidant enzyme in liver of Pinctada martensi [J]. Asian Journal of Ecotoxicology, 2011, 6(2): 171-175 (in Chinese)
[25]陳彩芳, 沈偉良, 霍禮輝, 等. 重金屬離子Cd2+對泥蚶鰓及肝臟細胞顯微和超微結構的影響[J]. 水產學報, 2012, 36(4): 522-525
Chen C F, Shen W L, Huo L H, et al. Effects of cadmium on the microstructure and ultrastructure of gill and hepatopancreas in Tegillarca granosa [J]. Journal of Fisheries of China, 2012, 36(4): 522-525 (in Chinese)
[26]陳秀榮. 氰戊菊酯對草魚CYP3A活性的影響及組織毒理學研究[D]. 武漢: 華中農業大學, 2010: 1-59
Chen X R. The study of the effect of fenvalerate on the CYP3A activity and histological toxicology on grass carp [D]. Wuhan: Huazhong Agricultural University, 2010: 1-59 (in Chinese)
[27]Velmurugan B, Selvanayagama M, Cengiz E, et al. Histopathology of lambda-cyhalothrin on tissues (gill, kidney, liver and intestine) of Cirrhinus mrigala [J]. Environmental Toxicology and Pharmacology, 2007, 24: 286-291
◆
Preliminary Exploration on the Effects of Deltamethrin on Enzyme Activity and Organs Injury inRuditapesphilippinarum
Xu Yibin1,2, Zheng Huidong1,2, Chen Yufeng1,2, Zheng Shenghua1,2, Chen Xiaohong1,2, Zhong Shuoliang1,2,*
1. Fujian Fishery Research Institute, Xiamen 361013, China;2. Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian Province, Xiamen 361013, China
5 February 2015accepted 30 April 2015
The effects of deltamethrin on the activities of acetyl cholinesterase (AChE) and Na+-K+-adenosine triphosphatase (Na+-K+-ATPase) in lymph, the activities of glutathione S-transferase (GST) in gill and liver, and the histology of gill and digestive diverticula of Ruditapes philippinarum were studied at the present study. The results showed that, at low concentration, (0.0070 mg·L-1) deltamethrin treatment had no significant effect on the enzymes activities (P > 0.05). In the medium concentration treatment group (0.014 mg·L-1, 0.020 mg·L-1), the activities of AChE and Na+-K+-ATPase in the lymph increased first and then decreased significantly (P < 0.05), the activities of GST in the gill and liver increased gradually, becoming significantly (P < 0.05) at the end of the exposure experiment. In the high concentration treatment group (0.027 mg·L-1), the activities of AChE and Na+-K+-ATPase in the lymph and the activities of GST in the liver decreased continuously with time (P < 0.01), while the activities of GST in the gill decreased first and then increased significantly (P < 0.05). These results indicated that, under low and medium concentration conditions, the enzymes activitiesexhibited a time- and dose-dependent pattern, which increased and then decreased. Under high concentration condition, the enzymes activities decreased continuously. The histological results showed that deltamethrin had a clear dose-dependent cytotoxic effect. After exposure to deltamethrin, epithelial cells of the gill filament exhibited cilia loss and disorientation, and epithelial cells of digestive diverticula exhibited expansion and inclusion body formation.
deltamethrin; Ruditapes philippinarum; enzyme activity; organ injury
國家海洋局海洋公益性行業科研專項(201005012);福建省屬公益類科研院所基本科研專項(閩海漁科2013R001-3)
許貽斌(1979-),男,碩士,助研,研究方向為海洋與漁業生態環境,E-mail:3208871@qq.com;
Corresponding author), E-mail: zsl-5388@163.com
10.7524/AJE.1673-5897.20150205001
2015-02-05 錄用日期:2015-04-30
1673-5897(2015)6-206-07
S 917
A
許貽斌, 鄭惠東, 陳宇鋒, 等. 溴氰菊酯對菲律賓蛤仔體內酶活性和組織損傷的初步探索[J]. 生態毒理學報,2015, 10(6): 206-212
Xu Y B, Zheng H D, Chen Y F, et al. Preliminary exploration on the effects of deltamethrin on enzyme activity and organs injury in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 206-212 (in Chinese)

