微生物合成γ-聚谷氨酸的相關(guān)基因、合成機(jī)理及發(fā)酵的研究進(jìn)展
嚴(yán)濤 郗洪生
(江蘇恒豐強(qiáng)生物技術(shù)有限公司,海門(mén) 226100)
微生物合成γ-聚谷氨酸的相關(guān)基因、合成機(jī)理及發(fā)酵的研究進(jìn)展
嚴(yán)濤 郗洪生
(江蘇恒豐強(qiáng)生物技術(shù)有限公司,海門(mén) 226100)
γ-聚谷氨酸(γ-PGA)是一種天然的氨基酸聚合物,由于其水溶性好、可生物降解、食用,以及對(duì)人類、動(dòng)物和環(huán)境無(wú)毒等特點(diǎn),因此,在環(huán)境、醫(yī)藥、食品和化妝品、飼料添加劑等領(lǐng)域有廣泛的應(yīng)用前景。主要是對(duì)微生物合成γ-PGA所采用的菌株、相關(guān)基因、合成機(jī)理及發(fā)酵方面進(jìn)行綜述。
γ-PGA;基因;機(jī)理;發(fā)酵
隨著人們綠色環(huán)保意識(shí)的加強(qiáng),尋找綠色、無(wú)污染的新型材料越來(lái)越受到關(guān)注,而γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)由于水溶性好,可生物降解與食用,以及對(duì)人類、動(dòng)物和環(huán)境無(wú)毒的特點(diǎn),目前已成為生物多聚物中的研究熱點(diǎn)之一。γ-PGA是一種水溶性可生物降解的新型綠色生物材料,由D-或L-谷氨酸通過(guò)α-氨基和γ-羧基通過(guò)γ-酰胺鍵結(jié)合而成的陰離子聚合物。γ-PGA的結(jié)構(gòu)式如圖1所示。

圖1 γ-PGA的結(jié)構(gòu)式
γ-PGA具有可食用性、無(wú)毒性、成膜性、黏結(jié)性、保濕性等特點(diǎn),其應(yīng)用非常廣泛,既可應(yīng)用于醫(yī)藥、食品和化妝品中,又可以作為保水劑及水果、蔬菜的防凍劑、保鮮劑,還可以作為污水處理的絮凝劑、重金屬螯合劑。更重要的是,還可應(yīng)用于飼料添加劑方面,提高動(dòng)物對(duì)鈣、鐵、磷等微量元素的吸收,減少動(dòng)物排泄物對(duì)環(huán)境造成的污染。γ-PGA的合成方法有化學(xué)合成法、提取法和微生物發(fā)酵法。其中化學(xué)合成法包括傳統(tǒng)的肽合成法和二聚體縮合法,由于產(chǎn)物純度難以控制、副產(chǎn)物比較多,同時(shí)產(chǎn)物的相對(duì)分子質(zhì)量比較小,所以限制了該方法的應(yīng)用;提取法是從日本傳統(tǒng)食品納豆(類似中國(guó)的豆豉)中分離得到γ-PGA,由于納豆中成分復(fù)雜,γ-PGA的含量不穩(wěn)定,使該方法不能廣泛運(yùn)用。目前合成γ-PGA的主要方法是微生物發(fā)酵法[1,2],該法工藝相對(duì)簡(jiǎn)單,產(chǎn)物分離純化容易,微生物發(fā)酵法在近幾年得到了廣泛的采用與快速發(fā)展。本文主要是對(duì)微生物合成γ-PGA所采用的菌株、相關(guān)基因、合成機(jī)理及發(fā)酵方面進(jìn)行綜述。
1 合成γ-PGA的菌株
γ-PGA是最早于1933年在炭疽芽孢桿菌(Bacillus anthracis)的莢膜上發(fā)現(xiàn)的,主要功能是保護(hù)細(xì)菌免受外界不利環(huán)境的影響。據(jù)報(bào)道[3],表皮葡萄球菌(Saphylococcus epidermidis)也能合成γ-PGA,合成的γ-PGA結(jié)合在細(xì)胞壁上。另外,3種古生菌,如嗜鹽球菌(Planococcus halophilus),鹽藻芽孢八疊球菌(Sporosarcina halophila)和亞洲嗜鹽堿桿菌(Natrialba asiatica)也能合成γ-PGA,用來(lái)降低細(xì)菌周圍的鹽濃度。目前發(fā)現(xiàn)的唯一一種真核γ-PGA合成生物為腔腸動(dòng)物(Cnidaria)。
通過(guò)微生物來(lái)發(fā)酵合成γ-PGA,其研究主要集中在芽孢桿菌屬細(xì)菌的炭疽芽孢桿菌、地衣芽孢桿菌(Bacillus licheniformis)、枯草芽孢桿菌(Bacillus subtilis)等[4]菌株上。根據(jù)細(xì)胞生長(zhǎng)的營(yíng)養(yǎng)要求,按是否需要L-谷氨酸,可以把γ-PGA合成菌分為兩大類[5]:一類是谷氨酸依賴型,即培養(yǎng)時(shí)需要L-谷氨酸才能積累γ-PGA,這類菌種主要有Bacillus anthracis、Bacillus subtilis MR-141、Bacillus licheniformis ATCC-9945、Bacillus subtilis IFO3335和Bacillus subtilis F-2-01等;另一類是谷氨酸非依賴型,即培養(yǎng)時(shí)不需要L-谷氨酸也能積累γ-PGA的,如Bacillus subtilis 5E、Bacillus licheniformis A35、Bacillus subtilis TAM-4等[6]。21世紀(jì)以來(lái),篩選可以高效合成γ-PGA的微生物,受到越來(lái)越多的學(xué)者的關(guān)注,曹明飛等[7]成功從土壤中分離到一株γ-PGA合成菌Bacillus licheniformis NK-03,其合成的γ-PGA中L-谷氨酸單體達(dá)到98%,在已報(bào)道的同種菌株L-谷氨酸單體含量中尚屬最高。而發(fā)現(xiàn)的能夠大量合成γ-PGA的多種芽孢桿菌都具有潛在的工業(yè)應(yīng)用價(jià)值,本研究組合成γ-PGA所用到的菌株為枯草芽孢桿菌。
2 微生物合成γ-PGA的相關(guān)基因研究
合成γ-PGA的相關(guān)基因,根據(jù)其命名可分為cap(Capsule)和pgs(Polyglutamate synthase)。前者是將γ-PGA做為莢膜的結(jié)構(gòu)組成部分,為結(jié)構(gòu)型,其代表菌株為Bacillus anthracis;后者是將產(chǎn)生的γ-PGA分泌到胞外,為分泌型,其代表菌株類型為Bacillus subtilis。在Bacillus anthracis的菌體中包含兩個(gè)質(zhì)粒,即pXO1(108 kb)和pXO2(951 kb),最初將有關(guān)PGA編碼的相關(guān)基因定位在Bacillus anthracis的pXO2質(zhì)粒上,稱之為cap BCA,這也是Makino等[8]在1989年首次報(bào)道編碼γ-PGA生物合成過(guò)程的相關(guān)基因研究,他們通過(guò)基因互補(bǔ)技術(shù),在質(zhì)粒pXO2上鑒定出呈簇狀分布的3個(gè)順?lè)醋樱⒋_定其排列順序?yàn)椋篶ap B、cap C和cap A,如圖2-A所示。通過(guò)對(duì)cap BCA這3個(gè)蛋白的氨基酸序列進(jìn)行分析、定位及對(duì)理化處理的敏感性,推測(cè)這些屬于膜交聯(lián)酶。后來(lái)Urushibata等[9]將cap BCA基因克隆轉(zhuǎn)到大腸桿菌(Escherichia coli)中進(jìn)行表達(dá)發(fā)現(xiàn),cap B是一個(gè)重疊基因,能編碼2個(gè)蛋白cap B和cap B',cap BCA酶以膜結(jié)合蛋白形式存在。另外,在cap BCA基因簇下游發(fā)現(xiàn)了編碼γ-聚D-谷氨酸解聚酶的基因dep,該基因主要是菌體在饑餓條件下,啟動(dòng)該基因的表達(dá)來(lái)降解PGA為菌體提供氮源。
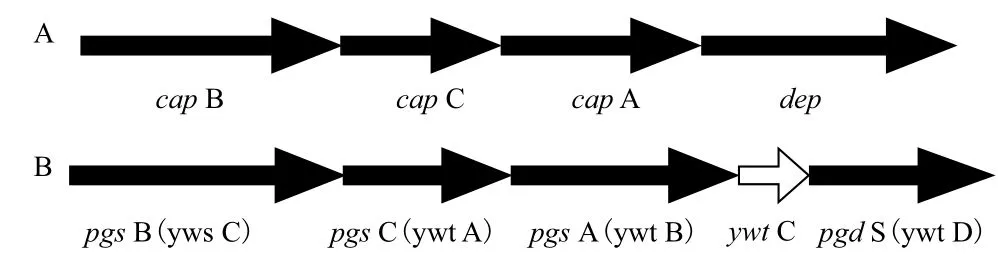
圖2 炭疽芽孢桿菌莢膜基因cap BCA(A)與枯草芽孢桿菌合成酶基因pgs BCA(B)
Ashiuchi等[10]從Bacillus subtilis IFO3336基因組文庫(kù)中,篩選到編碼γ-PGA合成酶復(fù)合體的克隆,其能在胞外合成更高分子量的γ-PGA。此合成基因包含:pgs B、pgs C和pgs A(也有學(xué)者稱為yws C、ywt A和ywt B)3個(gè)基因,排列成簇,如圖2-B所示。下游ywt C基因功能未知,可能是編碼γ-PGA解聚酶pgd S(也有學(xué)者稱為ywt D)基因的先導(dǎo)小蛋白,Bacillus subtilis IFO3336中pgs BCA基因與Bacillus anthracis的cap BCA基因同源性分別為66%、77%和50%。Cao等[11]篩選到一株谷氨酸非依賴型γ-PGA合成菌,即解淀粉芽孢桿菌LL3,并從菌體中克隆到pgs BCA的PGA合成基因,通過(guò)與谷氨酸依賴型Bacillus subtilis IFO3336序列比對(duì)發(fā)現(xiàn),pgs B、pgs C和pgs A 這3個(gè)基因的相似性分別為81.39%、83.33%和73.8%。Uruchibata等[12]從Bacillus subtilis IFO16449中獲得包含4個(gè)開(kāi)放閱讀框的4.2 kb片段,Northern雜交顯示其組成一個(gè)操縱子,其中yws C(pgs B)、ywt A(pgs C)和ywt B(pgs A)為γ-PGA合成必要的基因;Western雜交發(fā)現(xiàn)yws C蛋白由44 kD的 yws C和33 kD的yws C'兩部分組成,且由同向重疊的yws C基因編碼,然而兩蛋白具體功能尚不清楚。pgs BCA系統(tǒng)是分泌型芽孢桿菌菌體內(nèi)唯一的γ-PGA合成體系[13],石峰等[14]從Bacillus subtilis ZJU-7的基因組中擴(kuò)增得到合成γ-PGA的pgs BCA,通過(guò)把pTrc99A作為載體轉(zhuǎn)化到大腸桿菌JM109中,構(gòu)建出來(lái)的工程菌大腸桿菌JM109能合成γ-PGA;有些枯草芽孢桿菌,如Bacillus subtilis 168,雖然含有pgs BCA這3個(gè)基因,但是由于γ-PGA合成酶操縱子受不同啟動(dòng)子控制,在Bacillus subtilis 168菌體中轉(zhuǎn)錄水平太低,使其不能合成γ-PGA,而馬婕等[15]從Bacillus subtilis 168基因組中獲得合成γ-PGA的3個(gè)基因,即yws C、ywt A和ywt B,這3個(gè)基因被連接酶連接后,導(dǎo)入到pTrcHisA中,電轉(zhuǎn)化至轉(zhuǎn)錄水平比較高的大腸桿菌TOP10及大腸桿菌BL21(DE3)中進(jìn)行表達(dá),結(jié)果顯示宿主菌都具備了γ-PGA的合成能力。
Xu等[16]從Bacillus subtilis IFO 16449 菌中克隆出了一個(gè)新基因,命名為ywt D,其功能是編碼可降解γ-PGA的一種酶。經(jīng)DNA序列分析將其定位于ywt ABC和yws C基因的相連的下游,并與yws C和ywt ABC構(gòu)成控制γ-PGA生物合成的一個(gè)操縱子,如圖2-B所示。同時(shí)還證明,ywt D基因與編碼DL-內(nèi)肽酶的基因序列部分相同。純化的這種酶,具有降解γ-PGA的功能,降解后可產(chǎn)生兩種酶解產(chǎn)物,一種高分子質(zhì)量產(chǎn)物(490 kD,100%由L-谷氨酸組成);另一種低分子質(zhì)量產(chǎn)物(11 kD,其中D-谷氨酸與L-谷氨酸的比為80∶20)。再用羧肽酶G分析證明這兩種產(chǎn)物,這種ywt D酶為一種只降解γ-PGA的D-與L-谷氨酸所形成的γ-谷氨酰鍵,為γ-DL-谷氨酰基水解酶。王計(jì)偉等[17]通過(guò)在pET-28b(+)大腸桿菌表達(dá)系統(tǒng)中克隆表達(dá)Bacillus licheniformis ATCC9945A的ywt D基因,采用SDSPAGE和Western Blot方法檢測(cè)目的蛋白的表達(dá),并進(jìn)行體外酶解試驗(yàn)驗(yàn)證其活性,體外酶解試驗(yàn)表明該表達(dá)產(chǎn)物具有降解γ-PGA的活性。筆者在用Bacillus subtilis發(fā)酵合成γ-PGA時(shí),在發(fā)酵后期,發(fā)酵液變得十分黏稠,但當(dāng)超濾后,高黏度的發(fā)酵液若不及時(shí)提取γ-PGA,放置幾日后,則黏度逐漸消失,這是由于γ-DL-谷氨酰基水解酶對(duì)γ-PGA降解的原因。目前,雖然已經(jīng)得知γ-PGA合成的必需基因(即cap BCA和pgs BCA),但是其合成的各個(gè)蛋白的具體功能,仍然不清楚,需要后期進(jìn)一步的研究。
3 γ-PGA合成機(jī)理的研究
3.1 γ-PGA中碳骨架的來(lái)源
組成γ-PGA碳骨架是來(lái)源于葡萄糖中的碳,還是來(lái)自谷氨酸中的碳,不同菌體其來(lái)源不盡相同。有學(xué)者[18]通過(guò)13C標(biāo)記葡萄糖,對(duì)Bacillus subtilis NX-2中γ-PGA分子鏈中的碳骨架進(jìn)行了跟蹤分析,結(jié)果發(fā)現(xiàn)葡萄糖作為碳源大部分用于能量代謝和菌體合成,只有少部分參與了γ-PGA合成,而谷氨酸則為γ-PGA單體的主要來(lái)源;Cromwick和Gross[19]用13C標(biāo)記檸檬酸和谷氨酸作為培養(yǎng)基碳源,通過(guò)核磁共振技術(shù)對(duì)該菌合成γ-PGA的代謝途徑進(jìn)行了研究,結(jié)果發(fā)現(xiàn)檸檬酸和谷氨酸均作為前體參與了γ-PGA碳骨架的合成;另外,在Bacillus subtilis MR-141[20]中,除了35%的外源14C-谷氨酸整合入γ-PGA,還有6%的14C-葡萄糖也整合入γ-PGA。由此可知,不同微生物,其γ-PGA碳骨架來(lái)源有種屬特異性,根據(jù)這一現(xiàn)象有助于為培養(yǎng)基成分的設(shè)計(jì)及γ-PGA的合成提供理論依據(jù)。
3.2 γ-PGA的聚合機(jī)制研究
最早推測(cè)出γ-PGA合成機(jī)制的是Troy等[21]首先在Bacillus licheniformis 中發(fā)現(xiàn)的,其合成機(jī)制為:首先,ATP激活L-谷氨酸,然后由ATP脫去ppi形成的AMP,與谷氨酸在γ位結(jié)合,形成谷氨酰-γ-AMP;然后該物質(zhì)與一種帶-SH的酶或者受體(如一些硫脂,暫以X代稱)結(jié)合,并隨后異構(gòu)化為谷氨酰-X;然后谷氨酰連接到γ-PGA片段上,并脫去X,完成γ-PGA片段的延伸。
后來(lái),Ashiuchi等[13]在一株Bacillus subtilis 中分離到了細(xì)胞膜成分,在ATP和D-谷氨酸存在下體外合成了γ-PGA。但他們發(fā)現(xiàn)該菌在合成γ-PGA時(shí),ATP水解形成的是ADP,而非AMP,而由于cap B的表達(dá)蛋白cap B屬氨基連接酶,他們提出了另一條合成機(jī)制。即ATP被ATP水解酶水解為ADP與Pi,然后磷酸基團(tuán)結(jié)合到小分子γ-PGA的C末端,之后D-或者L-谷氨酸的氨基端與C端磷酸化了的小分子γ-PGA發(fā)生親核攻擊,生成Pi,在γ-PGA合成酶的作用下,延伸γ-PGA鏈。但是,D-谷氨酸依賴型的ATP酶活性要比L-谷氨酸依賴型的ATP酶活性高,這似乎解釋了合成酶系對(duì)底物的偏好性,使得γ-PGA中的D-谷氨酸單體比例偏高。但此機(jī)制仍有待進(jìn)一步證明,如小分子γ-PGA究竟多大,發(fā)生親核攻擊的具體位置等。筆者認(rèn)為,雖然不同的學(xué)者得到的合成γ-PGA的機(jī)制不盡相同,但是不同的微生物,由于其生物特性及代謝調(diào)控的不同,其合成γ-PGA的機(jī)制也應(yīng)該不完全相同。

圖3 γ-PGA的合成途徑及調(diào)控示意圖
3.3 γ-PGA合成的調(diào)控研究
由于cap BCA和pgs BCA的基因序列相似度很高,而且微生物合成γ-PGA屬于結(jié)合型還是游離型,主要是取決于另外的基因cap D和pgs S,所以推測(cè)cap BCA和pgs BCA基因控制的γ-PGA合成調(diào)控機(jī)理相同[22],而且cap BCA基因合成的γ-PGA主要是炭疽芽孢桿菌莢膜的主要成分,一般不用其大量生產(chǎn)γ-PGA,對(duì)其調(diào)控的研究很少有報(bào)道。因此,這里簡(jiǎn)述一下pgs BCA基因合成γ-PGA的調(diào)控研究。
Mader等[23]在Bacillus subtilis中發(fā)現(xiàn)高濃度的磷酸化的DegU能夠活化pgs B,C,A的轉(zhuǎn)錄。2005年,Stanley等[24]報(bào)道稱在Bacillus subtilis中,調(diào)控蛋白ComP-ComA、DegS-DegU、GegQ和SwrA對(duì)γ-PGA的合成是必需的。他們將DegQ和SwrA分別敲除發(fā)現(xiàn),這兩個(gè)基因任一的敲除都將導(dǎo)致γ-PGA不能合成。而后對(duì)DegQ進(jìn)行了反轉(zhuǎn)錄PCR發(fā)現(xiàn),高濃度的DegQ對(duì)yws C(與pgs B相同)的轉(zhuǎn)錄起調(diào)節(jié)作用,而SwrA對(duì)其轉(zhuǎn)錄有細(xì)微的影響,所以研究者猜測(cè)SwrA主要在轉(zhuǎn)錄后起調(diào)節(jié)作用。而之前的研究已經(jīng)表明,ComP-ComA和DegS-DegU都能影響DegQ的轉(zhuǎn)錄,所以他們提出了一種可能的調(diào)節(jié)途徑,如圖3所示。Kimura等[25]于2009年發(fā)現(xiàn)pgs B基因上游的一段非編碼區(qū)對(duì)其表達(dá)起重要作用。他們將lac Z與pgs B融合,組成融合基因,并通過(guò)檢測(cè)Lac Z的表達(dá)來(lái)定量表征pgs B的表達(dá)情況,然后用一種外切酶從pgs B上游-811開(kāi)始切除,進(jìn)而研究上游非編碼區(qū)域?qū)gs B的表達(dá)影響。結(jié)果表明,-721(+1為轉(zhuǎn)錄起始位點(diǎn))之后的非編碼區(qū)對(duì)融合基因的表達(dá)起重要作用,猜測(cè)可能是ComA或者DegU需要與該段區(qū)域結(jié)合,進(jìn)而對(duì)γ-PGA合成基因進(jìn)行調(diào)控。另外,Bacillus subtilis 168被廣泛用于γ-PGA調(diào)控研究,因?yàn)樵摼菫閿?shù)不多的、擁有全套的γ-PGA合成基因卻不生產(chǎn)γ-PGA的菌株。
綜 上 所 述,ComP-ComA、DegS-DegU、DegQ和SwrA對(duì)γ-PGA的合成都是必需的。其中ComPComA,DegS-DegU蛋白對(duì)基因degQ進(jìn)行調(diào)控,進(jìn)而調(diào)節(jié)DegQ的轉(zhuǎn)錄,影響γ-PGA合成酶的合成,間接影響pgs B,C,A的轉(zhuǎn)錄,SwrA則主要作用于pgs B,C,A的轉(zhuǎn)錄后調(diào)控,即主要調(diào)控γ-PGA合成酶的活性。而pgs B上游的非編碼區(qū)對(duì)pgs B的表達(dá)也有重要影響。

表1 γ-聚谷氨酸部分合成菌及發(fā)酵條件
4 微生物合成γ-PGA發(fā)酵的研究
通過(guò)微生物來(lái)發(fā)酵生產(chǎn)γ-聚谷氨酸,其發(fā)酵影響因素,如碳氮源、通氧量、攪拌速度、金屬離子、微量元素、前體物質(zhì)、生物素等,對(duì)不同菌株生產(chǎn)γ-聚谷氨酸的影響是不同的。表1[26-34]列出了幾株谷氨酸依賴型和非依賴型菌株的培養(yǎng)基配方、發(fā)酵周期和γ-聚谷氨酸產(chǎn)量、單體D/L-谷氨酸比例及分子量大小。以發(fā)酵菌株、發(fā)酵培養(yǎng)基成分及培養(yǎng)條件、發(fā)酵方式3個(gè)方面來(lái)簡(jiǎn)述微生物發(fā)酵合成γ-聚谷氨酸的研究進(jìn)展。
4.1 發(fā)酵合成γ-PGA的菌株研究
由于不同菌株,其本身的特性,決定了其生長(zhǎng)代謝的不同,因此發(fā)酵合成γ-PGA的能力也不同,因此,很多研究者在基因分子層面對(duì)菌株進(jìn)行改造,采用基因工程的手段(基因克隆、敲除,轉(zhuǎn)錄和表達(dá)等)來(lái)構(gòu)建基因工程菌,以提高其菌株的性能,進(jìn)而提高γ-PGA的產(chǎn)量。Su等[35]首次將細(xì)菌血紅蛋白基因(vgb)采用同源重組方式整合入枯草芽孢桿菌染色體中,突變株枯草芽孢桿菌S18-3-vgb+能正常表達(dá)血紅蛋白基因,增強(qiáng)了攝氧能力,成功克服了發(fā)酵時(shí)黏度增加引起的溶氧不足,使菌體濃度提高1.26倍,γ-PGA產(chǎn)量增至60.5 g/L;Yeh等[36]研究組將一種高效合成表達(dá)控制序列(synthetic expression control sequence,SECS)單拷貝形式整合入非γ-PGA合成菌枯草芽孢桿菌DB430 yws C 基因上游,獲得重組菌枯草芽孢桿菌PGA 6-2,其在不添加額外谷氨酸和氯化銨的培養(yǎng)基中,能產(chǎn)生28 g/L的γ-PGA,在遺傳研究方面,是優(yōu)良的選擇性菌株。綜上所述,通過(guò)將外源基因或調(diào)控元件導(dǎo)入到γ-PGA菌株的基因組中,可使菌體濃度、攝氧能力或內(nèi)源合成酶表達(dá)水平得到提高,以增加γ-PGA的產(chǎn)量。
4.2 發(fā)酵合成γ-PGA的培養(yǎng)基成分及培養(yǎng)條件研究
4.2.1 碳源 對(duì)于用Bacillus 屬的幾種菌發(fā)酵合成γ-PGA最適碳源多為檸檬酸、甘油、果糖、淀粉、葡萄糖和麥芽糖等。其中不同菌株適用不同的碳源。Bacillus licheniform WBL-3[37]最適碳源為檸檬酸、甘油;Bacillus subtilis NX-2的最適碳源為淀粉和麥芽糖,但它不能利用檸檬酸作為碳源[38];Bacillus licheniformis ATCC 9945a以最佳碳源為葡萄糖和甘油的組合[39]時(shí),其γ-PGA的產(chǎn)量可達(dá)到 20.5 g/L,它也是合成γ-PGA的主要菌株之一。Yao等[40]運(yùn)用13C核磁共振的方法跟蹤檢測(cè)13C標(biāo)記的葡萄糖的結(jié)果表明,葡萄糖作為一種速效碳源,主要是作為菌體生長(zhǎng)的營(yíng)養(yǎng)物質(zhì),而添加的 L-谷氨酸則被用來(lái)合成γ-PGA,對(duì)于谷氨酸依賴型的菌株來(lái)說(shuō)是來(lái)自外加的谷氨酸,對(duì)于非谷氨酸依賴型的菌株來(lái)說(shuō),其碳源通過(guò)內(nèi)循環(huán)能提供合成所需的谷氨酸。大多數(shù)枯草芽孢桿菌以檸檬酸和葡萄糖作為最適宜的碳源,以供合成γ-PGA所需要的能量。就降低合成成本[41]考慮,宜用檸檬酸或葡萄糖作碳源。
4.2.2 氮源 對(duì)于Bacillus sp.而言,最適氮源包括有機(jī)氮源和無(wú)機(jī)氮源。無(wú)機(jī)氮源如氯化銨、硫酸銨、硝酸銨和尿素等,有機(jī)氮源包含豆?jié){、蛋白胨、酵母抽提物、玉米漿、玉米漿干粉、黃豆餅粉和花生餅粉等。無(wú)機(jī)氮源的組成比較清楚,但是營(yíng)養(yǎng)成分比較單一;而無(wú)機(jī)氮源營(yíng)養(yǎng)比較豐富,含有許多未知的促生長(zhǎng)因子,能顯著促進(jìn)菌體的生長(zhǎng),但是其組成成分不明確。不同的菌青睞不同的氮源。如以豆?jié){作為Bacillus licheniformis ATCC 9945a的氮源,γ-PGA的最高產(chǎn)量可以達(dá)到35 g/L[42];以(NH4)2SO4等作為Bacillus subtilis IFO3335、Bacillus subtilis PGS-1的氮源,在發(fā)酵培養(yǎng)基中額外添加L-谷氨酸能促進(jìn)γ-PGA的合成,且沒(méi)有副產(chǎn)物的產(chǎn)生[43];用酵母抽提物代替硝酸銨,Bacillus licheniformis CGMCC3336的γ-PGA的產(chǎn)量比之前增加17%[44]。不同氮源對(duì)微生物的生長(zhǎng)和目標(biāo)產(chǎn)物的產(chǎn)量具有重要的影響,表現(xiàn)為氮源不僅可以通過(guò)同化作用轉(zhuǎn)變成微生物自身的組成成分,如重要功能性分子酶類和蛋白質(zhì)等,而且也是某些目標(biāo)產(chǎn)物合成的原料來(lái)源,如氨基酸類產(chǎn)物中的氮元素的主要來(lái)源。谷氨酸非依賴型菌株雖然γ-PGA產(chǎn)率較低,但由于可用廉價(jià)原料代替價(jià)格偏高的谷氨酸,因此在工業(yè)合成中有其實(shí)際應(yīng)用意義。所以需要根據(jù)不同菌株合理選擇相適應(yīng)的氮源。
4.2.3 金屬離子 某些金屬離子對(duì)Bacillus sbutilis 的γ-PGA合成非常重要,K+、Mn2+、Fe3+、Mg2+和Ca2+等金屬離子對(duì)枯草芽孢桿菌合成γ-PGA是必須的營(yíng)養(yǎng)成分之一[45]。低濃度的Mn2+有利于枯草芽孢桿菌自身的生長(zhǎng),進(jìn)一步提高培養(yǎng)基中Mn2+的濃度,枯草芽孢桿菌的生長(zhǎng)反而被抑制,盡管如此,發(fā)酵液中γ-PGA的積累量仍然增加。同時(shí)Cromwick等[46]發(fā)現(xiàn)可以通過(guò)改變培養(yǎng)基中的Mn2+離子濃度來(lái)調(diào)節(jié)某些芽孢桿菌產(chǎn)物γ-PGA的多聚體鏈中D-型或L-型谷氨酸的比例。同樣,培養(yǎng)基中添加Ca2+有利于菌體內(nèi)多肽的合成,其濃度對(duì)于菌體活性具有重要的影響作用。在發(fā)酵合成γ-PGA的過(guò)程中,Mg2+可能具有控制菌體內(nèi)專一性很強(qiáng)的D-和L-多肽合成酶系統(tǒng)的作用。隨著枯草芽孢桿菌原生質(zhì)體的獲得,金屬離子對(duì)γ-PGA發(fā)酵合成的影響作用將會(huì)得到進(jìn)一步深入研究。因此,培養(yǎng)基中金屬離子種類和濃度對(duì)γ-PGA的合成具有重要的影響作用。在發(fā)酵合成γ-PGA的過(guò)程中有許多酶類參加反應(yīng),金屬離子對(duì)維持這些酶的活性中心構(gòu)象和保持酶活性方面具有重要的作用。
4.2.4 其他培養(yǎng)條件 除了碳源、氮源、金屬離子對(duì)γ-PGA合成造成影響外,還有一些鹽類,如NaCl的加入,對(duì)其合成有一定的影響。有研究發(fā)現(xiàn)[32],加入一定濃度的NaCl,可以減小發(fā)酵后期發(fā)酵液的黏度,起到消泡的作用。其原因是加入的NaCl破壞了γ-PGA形成的凝膠網(wǎng)絡(luò)結(jié)構(gòu),甚至使γ-PGA的黏彈性完全喪失,從而降低其黏度,但加入的NaCl量太高,會(huì)使發(fā)酵液中的滲透壓過(guò)高,會(huì)導(dǎo)致細(xì)胞脫水死亡,影響γ-PGA的產(chǎn)量;另外,培養(yǎng)條件對(duì)其γ-PGA合成也有影響,如轉(zhuǎn)速太低,傳質(zhì)不均勻,溶氧不足;轉(zhuǎn)速太高,對(duì)菌體產(chǎn)生的剪力越大,會(huì)破壞菌體的細(xì)胞壁、細(xì)胞膜,不利于菌體的生長(zhǎng),進(jìn)而影響產(chǎn)物的生成[44],因此需要選擇合適的轉(zhuǎn)速;好氧微生物在生長(zhǎng)過(guò)程中需要給菌體生長(zhǎng)提供足夠的溶氧量,供氧量不足時(shí),好氧微生物會(huì)在厭氧條件下,其正常的生理代謝會(huì)受到影響[47];另外,有研究發(fā)現(xiàn)[46],Bacillus licheniformis ATCC 9945a在pH維持在6.5時(shí)γ-PGA生成量最大,而pH小于5.5或大于7.4則γ-PGA生成量顯著下降。培養(yǎng)條件的研究對(duì)提高γ-PGA的產(chǎn)量具有重要作用,必須創(chuàng)造適合于菌體產(chǎn)γ-PGA的最佳環(huán)境,才能讓微生物發(fā)酵出更多的γ-PGA。
4.3 合成γ-PGA的發(fā)酵方式研究
發(fā)酵方式有多種,如液體發(fā)酵、固體發(fā)酵、固定化細(xì)胞發(fā)酵等。通過(guò)微生物的方式發(fā)酵合成γ-PGA,常用的發(fā)酵方式為液體發(fā)酵,Cromwick等[46]以Bacillus licheniformis ATCC 9945a菌株在適宜的條件下液體發(fā)酵γ-PGA,其產(chǎn)量可達(dá)到25 g/L。液體發(fā)酵的優(yōu)點(diǎn)是發(fā)酵過(guò)程中的參數(shù)容易控制,發(fā)酵周期短,有利于后期分離提取,成本低廉,適合工業(yè)化大生產(chǎn)。Chen等[48]采用固態(tài)發(fā)酵,其培養(yǎng)成分雞糞、豆餅粉、麥麩用量為1∶1∶0.2,0.5%谷氨酸,0.5%檸檬酸,含水量65%,通過(guò)Bacillus subtilis CCTCC202048固體發(fā)酵,可得到42 g/L的γ-PGA。另外,Xu等[49]采用一種新型的有氧植物纖維床生物反應(yīng)器(APFB),對(duì)細(xì)胞進(jìn)行固定化發(fā)酵,通過(guò)發(fā)酵動(dòng)力學(xué)進(jìn)行分析,固定化細(xì)胞發(fā)酵表現(xiàn)出更高效的γ-PGA產(chǎn)量,用這個(gè)APFB反應(yīng)器進(jìn)行分批補(bǔ)料發(fā)酵,γ-PGA的產(chǎn)量達(dá)到了71.21 g/L。固態(tài)發(fā)酵與液態(tài)發(fā)酵相比,其優(yōu)點(diǎn)是設(shè)備和技術(shù)較簡(jiǎn)易,成本、能源消耗低,培養(yǎng)基原料價(jià)格低廉、廣泛易得。不足之處是工藝參數(shù)難以控制,發(fā)酵速度慢,周期長(zhǎng),后期分離純化困難,離工業(yè)化生產(chǎn)還有一定的距離;固定化細(xì)胞發(fā)酵,雖然其發(fā)酵γ-PGA的產(chǎn)量比較高,但由于其發(fā)酵設(shè)備及相關(guān)技術(shù)有較高的要求,生產(chǎn)成本高,目前還處于實(shí)驗(yàn)室階段,不適合工業(yè)化大生產(chǎn)。
綜上所述,影響微生物產(chǎn)γ-PGA的原因,主要包括內(nèi)因(菌株本身的特性)和外因(培養(yǎng)基成分及發(fā)酵方式)兩方面。針對(duì)內(nèi)因,可以通過(guò)構(gòu)建工程菌,從分子水平上來(lái)將菌種改造成合成所需要的高產(chǎn)γ-PGA的菌株;針對(duì)外因,可以通過(guò)統(tǒng)計(jì)學(xué)的方法(如PB設(shè)計(jì),CCD設(shè)計(jì)、正交實(shí)驗(yàn)、響應(yīng)面分析等)來(lái)進(jìn)行培養(yǎng)基成分及培養(yǎng)條件的優(yōu)化,為微生物提供一個(gè)有利于產(chǎn)γ-PGA的環(huán)境,最大限度的使菌株產(chǎn)γ-PGA。另外,改變傳統(tǒng)液態(tài)發(fā)酵方式,改變發(fā)酵設(shè)備等,也能提高γ-PGA的產(chǎn)量。另外,為了能迎合工業(yè)化大生產(chǎn)的需要,不僅是要提高 γ-PGA的產(chǎn)量,而且還要能降低合成成本,合成可采用廉價(jià)的原料,如甘蔗、糖蜜[50]、玉米漿干粉、牛糞堆肥、合成味精的殘?jiān)?1,52]等合成γ-PGA。本研究正在從廉價(jià)的培養(yǎng)基原料(如玉米漿干粉、糖蜜、黃豆餅粉、麥麩等)著手,其成分為天然的營(yíng)養(yǎng)成分,營(yíng)養(yǎng)豐富,價(jià)格低廉,適合作為工業(yè)化大生產(chǎn)的原料,通過(guò)統(tǒng)計(jì)學(xué)的方法,已篩選出最佳培養(yǎng)基配方,γ-PGA的產(chǎn)量可達(dá)到50 g/L。
5 展望
γ-PGA最吸引人的特性在于它是水溶性的、無(wú)毒、可生物降解、可食用等,這些特性使其有大量潛在的商業(yè)應(yīng)用前景[53],目前研究得比較熱門(mén)的菌株主要是地衣芽孢桿菌(Bacillus licheniforms)和枯草芽孢桿菌(Bacillus subtilis)。而急需解決的是如何降低合成成本、提高PGA的產(chǎn)量、控制產(chǎn)物分子量等。根據(jù)國(guó)內(nèi)外研究現(xiàn)狀,γ-PGA的未來(lái)研究方向可向這些方面來(lái)發(fā)展:尋求廉價(jià)的適合工業(yè)化大合成的原料,如玉米漿、黃豆餅粉等;篩選高效高產(chǎn)的優(yōu)良菌株,特別是谷氨酸非依賴型合成菌,并對(duì)發(fā)酵條件進(jìn)行優(yōu)化;通過(guò)基因工程的手段,構(gòu)建工程菌,提高菌株本身的合成性能,進(jìn)而增加γ-PGA的產(chǎn)量。目前,在國(guó)外,如日本味之素株式會(huì)社利用納豆菌對(duì)谷氨酸進(jìn)行聚合,成功的生成了PGA,已經(jīng)投入到商業(yè)化生產(chǎn)當(dāng)中;Cell Therapeutics公司開(kāi)發(fā)出了以PGA作為藥物載體,用于治療腫瘤的藥物——PGA-紫杉醇藥物,其產(chǎn)品已經(jīng)在日本、中國(guó)臺(tái)灣、韓國(guó)及亞洲其他國(guó)家和地區(qū)上市銷售。而國(guó)內(nèi)的研究工作大部分僅限于實(shí)驗(yàn)室,或者只有中小規(guī)模的生產(chǎn),且偏重于菌種和發(fā)酵工藝,對(duì)菌株合成γ-PGA的基因?qū)用妗⑻崛」に囇芯肯鄬?duì)較少。隨著研究的深入和基因改造手段的成熟,傳統(tǒng)方法對(duì)γ-PGA產(chǎn)量的提高越來(lái)越有限,而通過(guò)對(duì)基因和代謝流的改造,如提高關(guān)鍵酶的活性、增加正向調(diào)控蛋白的濃度、敲除γ-PGA的降解基因等,將會(huì)扮演越來(lái)越重要的角色。本研究組在分子層面,正在進(jìn)行通過(guò)基因同源重組[54,55]的方法,通過(guò)氨芐青霉素作為篩選標(biāo)記,敲除枯草芽孢桿菌中的降解酶基因[56],減少γ-PGA產(chǎn)物的降解,進(jìn)而提高γ-PGA的得率。
[1] 任尚美, 馬霞, 王海波. γ-聚谷氨酸的發(fā)酵條件優(yōu)化及其初步表征[J]. 中國(guó)釀造, 2008, 27(19):43-46.
[2] 趙紫華, 馬霞, 劉蕊. 高產(chǎn)γ-聚谷氨酸菌株的選育與鑒定[J].中國(guó)釀造, 2007, 26(7):32-34.
[3] 鄭重, 吳劍光, 邱樂(lè)泉. 微生物聚谷氨酸(γ-PGA)合成酶及合成機(jī)理的研究進(jìn)展[J]. 生物技術(shù)通報(bào), 2010(6):52-56.
[4] Negus D, Burton J, Sweed A, et al. Poly-γ-d-glutamic acid capsule interferes with lytic infection of Bacillus anthracis by B. anthracisspecific bacteriophages[J]. Applied and Environmental Microbiology, 2013, 79(2):714-717.
[5] 王浩, 楊麗萍, 喬君. γ-聚谷氨酸的研究進(jìn)展[J]. 山東食品發(fā)酵, 2011, 4:015.
[6] Hidetoshi K, Toshio M, Kazumichi U, et al. Production of poly(γ-glutamic acid)by Bacillus subtilis F-2-01. Bioscience,Biotechnology, and Biochemistry, 1993, 57(7):1212-1213.
[7] Cao M, Song C, Jin Y, et al. Synthesis of poly(γ-glutamic acid)and heterologous expression of pgs BCA genes[J]. Journal of Molecular Catalysis B:Enzymatic, 2010, 67(1):111-116.
[8] Makino S, Uchida I, Terakado N. Molecular characterization and protein analysis of the cap region, which is essential for encapsulation in Bacillus anthracis[J]. Journal of Bacteriology,1989, 171(2):722-730.
[9] Urushibata Y, Tokuyama S, Tahara Y. Difference in transcription levels of cap genes for γ-poly glutamic acid production between Bacillus subtilis IFO16449 and Marburg 168[J]. Journal of Bioscience and Bioengineering, 2002, 93(2):252-254.
[10] Ashiuchi M, Soda K, Misono H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells[J]. Biochemical Biophysical Research Communications,1999, 263(1):6-12.
[11] Cao M, Geng W, Liu L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgs BCA genes[J]. Bioresource Technology, 2011,102(5):4251-4257.
[12] Urushibata Y, Tokuyama S, Tahara Y. Characterization of the Bacillus subtilis ywsC gene, involved in γ-polyglutamic acid production[J]. Journal of bacteriology, 2002, 184(2):337-343.
[13] Ashiuchi M, Nawa C, Kamei T, et al. Physiological and biochemical characteristics of poly-γ-glutamate synthetase complex of Bacillus subtilis[J]. European Journal of Biochemistry, 2001, 268(20):5321-5328.
[14] 石峰, 徐志南, 岑沛霖. 利用枯草芽抱桿菌制備 γ-聚谷氨酸[C]. 中國(guó)資源生物技術(shù)與糖工程學(xué)術(shù)研討會(huì)論文集,2005.
[15] 馬婕, 王丹, 李強(qiáng). 基因工程大腸桿菌合成 γ-聚谷氨酸[J].過(guò)程工程學(xué)報(bào), 2009, 9(4):792-795.
[16] Xu Q, Sudek S, McMullan D, et al. Structural basis of murein peptide specificity of a γ-D-glutamyl-L-diamino acid endopeptidase[J]. Structure, 2009, 17(2):303-313.
[17] 王計(jì)偉, 施慶珊, 歐陽(yáng)友生. 地衣芽胞桿菌ATCC9945A中γ-聚谷氨酸降解酶基因的克隆、表達(dá)及降解性能鑒定[J]. 生物技術(shù), 2012, 22(1):13-17.
[18]Wu Q, Xu H, Xu L, et al. Biosynthesis of poly(γ-glutamic acid)in Bacillus subtilis NX-2:regulation of stereochemical composition of poly(γ-glutamic acid)[J]. Process Biochemistry, 2006, 41(7):1650-1655.
[19]Cromwick AM, Gross RA. Investigation by NMR of metabolic routes to bacterial γ-poly(glutamic acid)using13C-labeled citrate and glutamate as media carbon sources[J]. Canadian Journal of Microbiology, 1995, 41(10):902-909.
[20]Ogawa Y, Yamaguchi TF, Yuasa K, et al. Efficient production of γ-polyglutamic acid by Bacillus subtilis(natto)in Jar fermenters[J]. Biosci Biotech Bioch, 1997, 61:1684-1687.
[21]Troy F. Chemistry and biosynthesis of poly(gamma-d-glutamyl)capsule in Bacillus licheniformis. 1. properties of membranemediated biosynthetic reaction[J]. Journal of Biological Chemistry, 1973, 248(1):305-315.
[22]Candela T, Fout A. Poly-gamma-glutamate in bacteria[J]. Molecular Microbiology, 2006, 60(5):1091-1098.
[23]Mader U, Antelmann H, Buder T. Bacillus subtilis functional genomics:genome-wide analysis of the DegS-DegU regulon by transcriptomics and protiomics[J]. Molecular Genetics and Genomics, 2002, 268(4):455-467.
[24]Stanley N, Lazazzera B. Defining the genetic differences between wild and domestic strains of Bacillus subtilis that affect polygamma-DL-glutamic acid production and biofilm formation[J]. Molecular Microbiology, 2005, 57(4):1143-1158.
[25]Kimura K, Tran L. Expression of the pgs B encoding the polygamma-DL-glutamate synthetase of Bacillus subtilis(natto)[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(5):1149-1155.
[26]Cao Mf, Geng W, Li L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgs BCA genes[J]. Bioresource Technology, 2011,102(5):4251-4257.
[27]Cheng C, Yoshihiro A, Tokujiro A. Production of γ-polyglutamic acid by Bacillus licheniformis A35 under denitrifying conditions[J]. Agricultural and Biological Chemistry, 1989, 53(9):2369-2375.
[28]Ishwar B, Rekha S. Poly(glutamic acid)-an emerging biopolymer of commercial interest[J]. Bioresource Technology, 2011, 102(10):5551-5561.
[29]Jae-Hoon J, Jin-Nam K, Young-Jung W, et al. The statistically optimized production of poly(γ-glutamic acid)by batch fermentation of a newly isolated Bacillus subtilis RKY3[J]. Bioresource Technology, 2010, 101(12):4533-4539.
[30]Lung SI, Wu PJ, Jen SC. Microbial production of a poly(γ-glutamic acid)derivative by Bacillus subtilis[J]. Process Biochemistry,2005, 40(8):2827-2832.
[31]Masao K, Atsuo G. Biosynthesis of poly(γ-glutamic acid)from L-glutamic acid, citric acid, and ammonium sulfate in Bacillus subtilis IFO3335[J]. Applied Microbiology and Biotechnology,1994, 40(6):867-872.
[32]Yoshihito I, Takeshi T, Tetsuo O, et al. Glutamic acid independent production of poly(γ-glutamic acid)by Bacillus subtilis TAM-4[J]. Bioscience, Biotechnology, and Biochemistry, 1996, 60(8):1239-1242.
[33]金映紅, 劉靜, 劉莉. 利用 Bacillus licheniformis NK-03 合成聚谷氨酸及其合成酶基因 pgs BCA 的克隆[J]. 南開(kāi)大學(xué)學(xué)報(bào):自然科學(xué)版, 2008, 41(3):57-63.
[34]疏秀林, 施慶珊, 馮靜. 一株非谷氨酸依賴型聚 γ-谷氨酸高產(chǎn)菌株的鑒定與誘變育種[J]. 微生物學(xué)通報(bào), 2009, 36(5):705-710.
[35] Su Y, Li X, Liu Q, et al. Improved poly-γ-glutamic acid production by chromosomal integration of the Vitreoscilla hemoglobin gene(vgb)in Bacillus subtilis[J]. Bioresource Technology, 2010,101(12):4733-4736.
[36]Yeh CM, Wang JP, Lo S. Chromosomal integration of a synthetic expression control sequence achieves poly-γ-glutamate production in a Bacillus subtilis strain[J]. Biotechnology Progress, 2010, 26(4):1001-1007.
[37]楊革, 陳堅(jiān), 曲音波. 金屬離子對(duì)地衣芽孢桿菌合成多聚谷氨酸的影響[J]. 生物工程學(xué)報(bào), 2001, 17(6):706-709.
[38] Hong X, Min J, Hui L, et al. Efficient production of poly(γ-glutamic acid)by newly isolated Bacillus subtilis NX-2[J]. Process Biochemistry, 2005, 40(2):519-523.
[39] Young HK, Richard AG. Effects of glucose and glycerol on γ-poly(glutamic acid)formation by Bacillus licheniformis ATCC 9945a[J]. Biotechnology and Bioengineering, 1998, 57(4):430-437.
[40] Yao J, Xu H, Shi N, et al. Analysis of carbon metabolism andimprovement of γ-polygiutamic acid production from Bacillus subtilis NX-2[J]. Applied Biochemistry and Biotechnology,2010, 160(8):2332-2341.
[41]Hwan DJ, Nam CH, Yup LS. Efficient recovery of γ-poly(glutamic acid)from highly viscous culture broth[J]. Biotechnology and Bioengineering, 2001, 76(3):219-224.
[42]馮志彬, 程仕偉, 繆靜. γ-聚谷氨酸生產(chǎn)菌的選育及培養(yǎng)條件研究[J]. 生物加工過(guò)程, 2010(1):40-44.
[43]阮文輝, 楊家志, 姚俊. γ-聚谷氨酸合成菌株的篩選與優(yōu)化培養(yǎng)[J]. 中國(guó)釀造, 2011(5):66-69.
[44] Qiao C, Zhang S, Li Z, et al. improving poly-(γ-glutamic acid)production and reducing impurities in fermentation broth by medium optimization using Bacillus licheniformis CGMCC3336[J]. Journal of Biobased Materials and Bioenergy, 2013, 7(3):390-394.
[45] Andrew R, Argyrios M. Optimization of cell growth and poly(glutamic acid)production in batch fermentation by Bacillus subtilis[J]. Biotechnology Letters, 2003, 25(6):465-468.
[46]Anne MC, Richard AG. Effects of manganese on Bacillus licheniformis ATCC 9945A physiology and γ-poly(glutamic acid)formation[J]. International Journal of Biological Macromolecules, 1995, 17(5):259-267.
[47]Gooding EA, Sharma S, Petty SA, et al. pH-dependent helix folding dynamics of poly-glutamic acid[J]. Chemical Physics, 2013,422:115-123.
[48]Chen X, Li QY, Dai J, et al. Solid state fermentation for chicken manure regenerative feed containing poly-γ-glutamic acid[J]. Advanced Materials Research, 2013, 807:1176-1180.
[49]Zongqi X, Xiaohai F, Dan Z, et al. Enhanced poly(γ-glutamic acid)fermentation by Bacillus subtilis NX-2 immobilized in an aerobic plant fibrous-bed bioreactor[J]. Bioresource Technology,2014, 155:8-14.
[50]Zhang D, Feng X, Zhou Z, et al. Economical production of poly(γ-glutamic acid)using untreated cane molasses and monosodium glutamate waste liquor by Bacillus subtilis NX-2[J]. Bioresource Technology, 2012, 114:583-588.
[51]Yong X, Raza W, Yu G, et al. Optimization of the production of poly-γ-glutamic acid by Bacillus amyloliquefaciens C1 in solidstate fermentation using dairy manure compost and monosodium glutamate production residues as basic substrates[J]. Bioresource Technology, 2011, 102(16):7548-7554.
[52]Zeng W, Li W, Shu L, et al. Non-sterilized fermentative coproduction of poly(γ-glutamic acid)and fibrinolytic enzyme by a thermophilic Bacillus subtilis GXA-28[J]. Bioresource Technology, 2013, 142:697-700.
[53]Bajaj I, Singhal R. Poly(glutamic acid)-an emerging biopolymer of commercial interest[J]. Bioresource Technology, 2011, 102(10):5551-5561.
[54]彭其安, 張西峰, 吳思方. 同源重組法構(gòu)建枯草芽孢桿菌轉(zhuǎn)酮酶缺失突變菌株[J]. 生物技術(shù), 2006, 16(6):23-26.
[55] 嚴(yán)濤, 趙錦芳, 高文慧. 大腸桿菌工程菌pts G基因敲除及其缺陷株混合糖同型乙醇發(fā)酵[J]. 生物工程學(xué)報(bào), 2013, 29(7):937-945.
[56]金晶, 姚俊, 徐虹. 枯草桿菌NX-2聚谷氨酸解聚酶的克隆表達(dá)及其降解性質(zhì)研究[J]. 中國(guó)生物工程雜志, 2007, 27(5):34-38.
(責(zé)任編輯 狄艷紅)
Progresses of Microbial Synthesis of Poly-γ-Glutamic Acid of Related Genes,Synthesis Mechanism and Fermentation
Yan Tao Xi Hongsheng
(Jingsu Hengfengqiang Bio-technology Co.,Ltd,Haimen 226100)
γ-polyglutamic acid(γ-PGA)is naturally occurring poly amino acids with characteristics of water solubility, biodegradability,edible and non-toxicity towards human, animals and the environment. Therefore, γ-Poly(glutamic acid)and its derivatives have been of interest in a broad range of industrial fields such as environment, medicine, food, cosmetics and feed additives. This paper focuses on the microbial synthesis of γ-PGA of related genes, synthesis mechanism and fermentation.
γ-polyglutamic acid;gene;mechanism;fermentation
10.13560/j.cnki.biotech.bull.1985.2015.04.004
2014-08-09
嚴(yán)濤,男,碩士,研究方向:微生物發(fā)酵;E-mail:yantao2112@126.com

