17β-雌二醇對斑馬魚性別分化的影響
李國超 余凱敏 馮為民 劉麗麗 張家禹 閆艷春
(中國農業科學院研究生院,北京 100081)
17β-雌二醇對斑馬魚性別分化的影響
李國超 余凱敏 馮為民 劉麗麗 張家禹 閆艷春
(中國農業科學院研究生院,北京 100081)
有報道表明,經17β-雌二醇(17β-estradiol,E2)處理后,斑馬魚種群中雌性比例上升。為了研究E2雌性化作用的機制,選取一系列斑馬魚體內與性別分化有關的基因(brca2,sox9a,sox9b,dmrt1和 cyp19a1a),采用qRT-PCR分析它們在不同的處理條件下表達水平的變化。結果表明,E2能上調雌性相關基因(brca2、sox9b)的表達,下調部分雄性相關基因(sox9a)的表達,對不同發育階段的斑馬魚體內的性激素轉化通路(cyp19a1a)的影響不同。
環境內分泌干擾物;17β-雌二醇;斑馬魚;性別分化
環境中的多種化合物(包括農藥[1]、工業化學物[2]和植物激素[3]等)在進入生物體內后,能干擾正常激素的代謝過程,從而干擾內分泌系統的正常功能,對生物的健康造成危害,這類化學物質統稱為內分泌干擾物(Endocrine disrupting chemicals,EDCs),其效應以雌激素效應為主。在眾多EDCs中,17β-雌二醇(17β-Estrodiol,E2)占主要地位[4,5],其環境濃度范圍為0-141 ng/L[6-8]。已有研究從表型上證明E2能促進斑馬魚發育成雌性[9]。
斑馬魚屬硬骨魚類,鯉科(Cyprinidae)鮐屬(Danio),是一種小型熱帶淡水魚。成魚體長4-5 cm,3個月可達性成熟。斑馬魚基因與人類基因的相似度達到 87%。作為模式動物,斑馬魚具有繁殖率高、體外受精、遺傳背景清晰等優點,已經被廣泛用于藥物研發[10]、人類疾病研究[11]和環境毒理學[12,13]等領域。其轉基因品系也被逐一建立[14]。
與人、小鼠和鳥類不同,斑馬魚的性別不是由XY/XX或ZZ/ZW機制決定的[15-17]。目前,人們只知道斑馬魚的性別分化發生在受精后21 d到42 d(21-42 dpf)[9],此時性別分化相關基因的表達水平也分別達到高峰[18]。這些基因包括:乳腺癌易感基因2(brca2)、SRY相關基因a(sox9a)、SRY相關基因b(sox9b)、存在于雙性且mab-3相關的轉錄因子1(dmrt1)和細胞色素P450,家族19,亞家族a,多肽1a(cyp19a1a)。其中與斑馬魚發育為雌性相關的基因是brca2[19,20]、sox9b[21,22],與發育為雄性相關的基因是sox9a[21-23]、dmrt1[18,24-27],而cyp-19a1a編碼的蛋白可將雄激素轉化為雌激素,平衡魚體內性激素的比例[21,28,29]。上述基因中,除純合缺失brca2的斑馬魚會全部發育為雄性以外[19,20],其他基因都不能單獨決定斑馬魚的性別。因此推測斑馬魚的性別分化是由一個復雜的信號網絡負責調控的,以上基因都屬于這個網絡[16]。
本研究以脊椎動物斑馬魚為材料,采用實時定量PCR(Quantitative real-time polymerase chain reaction,qRT-PCR)的方法,從轉錄水平對E2促進斑馬魚發育成雌性的機制進行探究,填補EDCs影響性別分化機制的數據短缺。為進一步探究斑馬魚的性別決定機制以及EDCs在其中的影響提供數據和線索,也為完善EDCs的評估標準提供理論依據。
1 材料與方法
1.1 材料
AB 品系斑馬魚由北京大學張博實驗室惠贈。
1.1.1 試劑 17β-雌二醇(17β-Estrodiol,E2)購自Sigma-Aldrich公司(CAS 50-28-2)。
E2暴露實驗A處理液:6 mg E2溶于1 mL無水乙醇中,再將其溶于1 L培養液(已除氯,pH7.0-7.5,含0.6 g/L NaCl,電導率500 μs/cm),制成6 mg/L E2儲液。用培養液依次將其稀釋成1、2、2.5、3、4、5和6 mg/L的梯度濃度E2溶液。用培養液稀釋無水乙醇至乙醇終濃度為0.1%,作為對照組的培養液,即0 mg/L E2溶液。
E2暴露實驗B處理液:1 mg E2溶于1 mL無水乙醇中,再將其溶于1 L培養液中,制成1 mg/L E2儲液。用培養液和1 L容量瓶將100 mL儲液稀釋10倍,重復4次得10 ng/L E2溶液。最后用培養液稀釋無水乙醇至乙醇終濃度為0.000 001%,作為對照組的培養液,即0 ng/L E2溶液。
總RNA提取:使用TRIzol試劑盒(TaKaRa)。
cDNA的獲得:使用反轉錄試劑盒 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa)。
qRT-PCR:使用SYBR Premix Ex Taq II試劑盒(TaKaRa)及其PCR體系。
1.1.2 儀器 斑馬魚獨立養殖系統(北京愛生)、生化培養箱、液氮罐、-80℃冰箱、顯微鏡(Olympus BX63)、鏈式聚合酶擴增(PCR)儀(Bio-Rad)、凝膠成像系統(Gene Company Limited)、iQ5 多彩RTPCR檢測系統(Bio-Rad)。
1.2 方法
1.2.1 斑馬魚養殖 使用獨立養殖設備(北京愛生),對斑馬魚進行規范化的飼養。培養液的電導率為 500-550 μs/cm,pH為 7.0-7.5。魚房的溫度恒定(27±2℃),光周期恒定(14 h光/10 h暗)。受精后5 d(5 dpf)可喂食草履蟲。13 dpf 后,逐漸喂食新鮮豐年蝦,每天喂食2次。根據斑馬魚的發育大小及濃度進行適量喂養。
1.2.2 斑馬魚繁殖 將40條性成熟的斑馬魚成對放入孵化盒中(1條雄魚和1條雌魚/盒),用隔板分開。次日上午抽掉隔板,10 min 后斑馬魚開始產卵,30 min 后進行胚胎的收集,放于 28℃的培養箱中。受精后10 h(10 hpf),選擇健康、發育一致的胚胎,飼養至合適的發育階段后,可用于E2的暴露實驗。
1.2.3 雌二醇暴露實驗A 對于0、1、2、2.5、3、4、5和6 mg/L這個梯度中的每一個E2濃度,設置3個培養皿作為平行,每個培養皿中放 50 個10 hpf胚胎,接受相同濃度的E2處理。每24 h 更換溶液,并及時去除死卵,處理96 h,分別隨機收集25條幼魚,各自作為一個樣本。用液氮冷凍,-80℃下保存。重復本實驗3次,每個E2濃度都得到9個樣本,每個樣本含25條幼魚。
1.2.4 雌二醇暴露實驗B 用0 ng/L和10 ng/L E2分別處理3組平行的10 hpf斑馬魚胚胎(每組100個胚胎)。期間,在暴露時長為40、50、60、96、9、10和11 d時,統計斑馬魚的孵化率、存活率、畸形率。該實驗重復3次。
用0 ng/L和10 ng/L E2分別處理:3組10 hpf斑馬魚胚胎(每組50個胚胎),3組21 dpf的斑馬魚(每組50條),3組健康成年雄魚(大于6月齡,每組1條),3組健康成年雌魚(大于6月齡,每組1條),處理時長為9 d。處理完成后,用液氮冷凍并拍攝各組魚的照片。之后,分別收集各組平行中幼年、青年魚的全身,并解剖成魚,獲得卵巢和精巢。將其各自作為一個樣本,用液氮冷凍,保存在-80℃下。重復本實驗3次,這樣對于兩個濃度的E2溶液處理下的每個發育階段,都得到9個樣本。
1.2.5 qRT-PCR 設計每個性別分化相關基因和內參基因β-actin的引物,送交上海生工公司合成(表1)。經PCR預實驗知:在退火溫度為57℃時,能夠獲得清晰的特異性目的條帶。用在E2暴露實驗A和暴露實驗B中獲得的斑馬魚和性腺,分別提取總RNA,反轉錄得到cDNA。采用qRT-PCR試劑盒說明書中的PCR體系。qRT-PCR程序為:95℃預變性30 s,40個循環(95℃下5 s,57℃下30 s),10℃下20 min。用各基因的引物分別做qRT-PCR。用2-△△CT法分析這些結果[30]。

表1 qRT-PCR引物
1.2.6 統計分析 用Bartlett檢驗和Levene檢驗,對原始數據進行標準化,并檢測標準化后數據的方差齊性。用單因素方差分析和Duncan法多重比較檢驗組間差異。所有的統計分析由SPSS 19.0(美國SPSS公司)和R[31]兩個軟件進行。除圖3以外,所有圖均用Origin 7.0繪制(美國Origin實驗室)。
2 結果
2.1 E2暴露實驗A
以10 hpf為處理起點,設置一系列E2溶液濃度梯度,分析E2處理96 h后斑馬魚體內性別分化相關基因的表達水平。結果發現,經4 、5和6 mg/L E2處理96 h后,斑馬魚胚胎全部死亡并腐爛,無法收集樣本,因而沒有繪出其結果(圖1)。其他濃度的實驗結果表明,經E2處理96 h后,brca2的表達水平隨E2的濃度上升而呈上升趨勢,最終在3 mg/L E2處理后,其表達水平呈顯著上調(P<0.05)(圖1-A)。sox9b表達水平的變化趨勢與brca2一致,且對E2更敏感——在2 mg/L E2處理后,其表達水平已經極顯著地上調(P<0.01)(圖1-B)。這兩個雌性相關基因的表達水平均對E2呈現一定的劑量依賴性。sox9a和cyp19a1a的表達水平沒有發生顯著變化,也不受E2溶液濃度變化的影響(圖1-C,D)。在對照組和處理組中均未檢測到dmrt1的表達。
2.2 E2暴露實驗B
在10 ng/L E2處理后,于不同時間點,對斑馬魚胚胎的孵化率、存活率、畸形率進行了統計。結果(圖2)表明,10 ng/L E2不能引起任何肉眼可見的斑馬魚胚胎的畸形(如體軸彎曲、心包水腫等),不會對斑馬魚的孵化時間產生影響(圖2-A)。但如果暴露時間過長的話,也會引起幼魚的死亡(圖2-B)。因此又深入研究了E2處理9 d后,各個發育階段的斑馬魚體內性別分化相關基因的表達水平的變化。
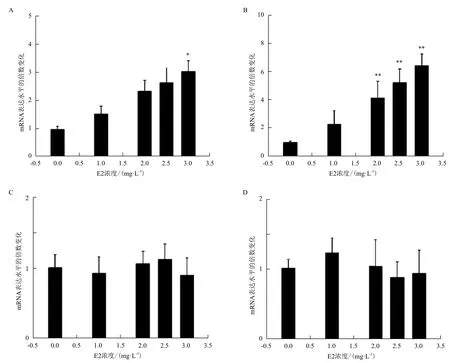
圖1 經不同濃度的雌二醇(E2)溶液處理96 h后,各個性別分化相關基因表達水平的變化
用10 ng/L E2處理不同發育階段的斑馬魚,時長為9 d。處理后發現,所有發育階段的對照組和處理組斑馬魚的表型沒有明顯差異(圖3)。在所有發育階段的魚體內,本實驗選擇的全部性別分化相關基因(即brca2,sox9a,sox9b,dmrt1和 cyp19a1a)的表達都能被qRT-PCR檢測到(圖4)。qRT-PCR的結果表明,經10 ng/L E2處理9 d后,幼魚體內所有性別分化相關基因的表達水平沒有發生顯著變化(圖4-A、E、I、M、Q)。在21 dpf魚體內,brca2,dmrt1和cyp19a1a的表達水平顯著上調。特別是dmrt1,其表達水平上調了12倍(P<0.001)。而sox9b和sox9a的表達水平無顯著變化(圖4- B、F、 I、N、R)。在成年雌魚體內,brca2的表達水平上調了4倍,而sox9a和cyp19a1a均顯著下調,sox9b和dmrt1的表達水平則無顯著變化(圖4- C、G、K、O、S)。在成年雄魚體內,所有基因的表達水平均顯著下調(圖4- D、H、L、P、T)。
3 討論
研究表明,許多環境內分泌干擾物(如炔雌醇、雙酚A)能促進斑馬魚發育為雌性,而另一些化合物(如法曲唑)能促進斑馬魚發育為雄性[32-34]。有報道用17β-雌二醇(17β-estradiol,E2)處理幼魚和21 dpf魚一段時間后,將其放回正常的培養液中飼養至成年,會發現斑馬魚種群的雌性比例上升,雄魚的第二性征減弱,部分雄魚發育出了卵巢樣的性腺,即E2在表型上促進了斑馬魚發育為雌性[9]。此外,有研究證明E2同樣能促進青鳉發育為雌性[33-35]。有趣的是,E2對青鳉體內基因表達水平的影響會隨溫度和光周期的變化而變化[36]。此外,環境條件也會影響斑馬魚的性別分化。如高水溫和低氧條件能促進F1代的雄性比例上升,雌魚發育速度變快且進行異系繁殖[37-39]。因此推測,斑馬魚體內可能存在一個復雜的調控網絡來控制其性別的發育方向,該網絡會同時受到遺傳和環境因素的影響。而在形態學和組織學水平上已經證實,E2會促進該網絡推動斑馬魚發育為雌性[9]。
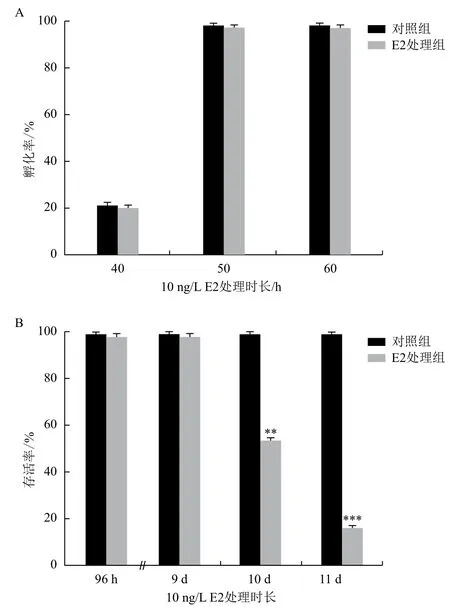
圖2 經10 ng/L E2處理不同時長后斑馬魚的孵化率和存活率

圖3 經10 ng/L E2處理9 d后各發育階段斑馬魚的表型
本實驗用qRT-PCR的方法,從轉錄水平上研究了E2促進斑馬魚發育為雌性的機制。我們前期的工作表明,斑馬魚胚胎的96 h半數致死濃度在2-3 mg/L這一范圍中(數據未給出)。而E2的環境濃度范圍為0-141 ng/L[6-8]。根據以上兩點,分別設計E2暴露實驗A和B,分別探究高濃度E2和低濃度E2對斑馬魚性別分化相關基因的表達水平的影響。
前人研究已證實brca2的純合缺失突變斑馬魚會全部發育成雄性[19,20]。這表明brca2在斑馬魚發育為雌性的過程中起關鍵性作用。而sox9b可以被視為斑馬魚的一個卵巢標志基因[21,22]。E2暴露實驗A的結果表明,雌二醇能上調斑馬魚胚胎中這兩個雌性相關基因的表達,上調程度呈現一定的劑量依賴性。sox9a可以被視為一個睪丸標志基因[21-23],其表達水平不受雌二醇影響,dmrt1則沒有表達。這表明雌二醇不能影響斑馬魚胚胎雄性相關基因的表達,且雄性相關基因各自的表達水平達到高峰的時間點并不一致。cyp19a1a的表達水平不受雌二醇影響,而其編碼的蛋白負責將斑馬魚胚胎體內內源雄激素轉化為內源雌激素,從而平衡性激素比例[21,28,29]。說明雌二醇不能影響斑馬魚胚胎體內的該通路。
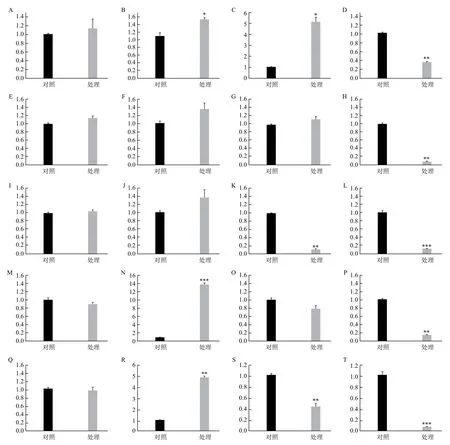
圖4 經10 ng/L E2處理9 d后,各發育階段的斑馬魚體內性別分化相關基因的表達水平
E2暴露實驗B的結果表明,在斑馬魚胚胎中,10 ng/L E2浸泡9 d的處理不能影響任何一個性別分化相關基因的表達水平(圖4-A、E、I、M、Q)。在21 dpf斑馬魚(性腺發育剛剛開始)中,該處理上調了雌性相關基因的表達,并促進了內源雄激素轉化為內源雌激素(圖4- B、F、I、N、R)。該結果與前人在形態學和組織學水平上研究得出的結論一致[9,39]。另外,前人觀察到dmrt1在蛙、龜和鼠的體內,都是雄性的表達水平遠高于雌性[25-27]。人們據此提出假說:dmrt1的高表達水平可能對于雄性的發育是必需的,而低表達水平可能對于雌性的發育是必需的[18]。而在本實驗中,在表型上促進斑馬魚發育為雌性的E2[9,39],卻能大幅上調21 dpf魚體內dmrt1的表達水平(圖4-N)。這說明上述假說在斑馬魚體內可能是不成立的。即使該假說是部分正確的,即dmrt1的上調表達確實能促進魚發育為雄性,本實驗的結果也證明了dmrt1的效應要遠遠弱于brca2(圖4-B、N,dmrt1的上調倍數遠高于brca2,但斑馬魚依然發育成雌性)。在成年雌魚中,E2下調了部分雄性相關基因(即sox9a)的表達水平。同時,E2還下調了cyp19a1a的表達水平,減弱了內源雄激素轉化為內源雌激素的過程(圖4-K、S)。推測原因可能是由于魚吸收了大量外源雌激素E2,導致體內的雌激素濃度過高,以負反饋機制抑制了內源雌激素的生成。該假設需要進一步的實驗驗證。根據E2對成年雌魚的影響結果,我們提出了“E2能否引發成年雄魚的性逆轉”的疑問。實驗結果表明,在成年雄魚中,E2下調了所有性別分化相關基因的表達水平(圖4-D、H、L、P、T)。對于上述疑問:首先,從形態學上觀察不到任何性逆轉特征(圖3-H);其次,從轉錄水平看不出明顯的性逆轉趨勢(圖4-D、H、L、P、T);最后,如果需要確切地驗證該假說,就必須制作性腺切片,從組織學上加以鑒定。
總之,E2暴露實驗A和暴露實驗B的結果共同證明,在轉錄水平E2能上調雌性相關基因(brca2、sox9b)的表達,下調部分雄性相關基因(sox9a)的表達,該結果與前人在形態學和組織學水平上研究得出的關于E2對魚類性別分化的影響的結論一致[9,39],即E2與其他EDCs的效果相同,與法曲唑的效果相反[32-34]。因此,也許可以將“能否促進斑馬魚發育為雌性”作為評估某一化合物是否具有雌激素效應的一項生理指標。
4 結論
本實驗采用qRT-PCR的方法,從轉錄水平研究了雌二醇促進斑馬魚發育為雌性的機制。發現E2能上調雌性相關基因(brca2、sox9b)的表達,下調部分雄性相關基因(sox9a)的表達,對不同發育階段的斑馬魚體內性激素轉化通路(cyp19a1a)的影響不同。
[1] Klotz DM, Ladlie BL, Vonier PM, et al. o. p’-DDT and its metabolites inhibit progesterone-dependent responses in yeast ang human cells[J]. Molecular and Cellular Endocrinology, 1997, 129:63-71.
[2] Ethier SP. Primary culture and serial passage of normal and carcinogen-treated rat mammary epithelial cells in vitro[J]. J NatlCancer Inst, 1985, 74:1307-1318.
[3] Rudel R. Predicting health effects of exposures to compounds with estrogenic activity:Methodological issues[J]. Environmental Health Perspectives, 1997, 105(Suppl. 3):665-663.
[4] Nakada N, Nyunoya H, Nakamura M, et al. Identi fication of estrogenic compounds in wastewater effluent[J]. Envir onmental Toxicology and Chemistry, 2004, 23(12):2807-2815.
[5] Snyder SA, Villeneuve DL, Snyder EM, et al. Identification and quantification of estrogen receptor agonists in wastewater Effluents[J]. Environmental Science & Technology, 2001, 35(18):3620-3625.
[6] Shore LS, Gurevitz M, Shemesh M. Estrogen as an environmental pollutant[J]. Bulletin of Environmental Contamination and Toxicology, 1993, 51(3):361.
[7] Snyder SA, Keith TL, Verbrugge DA, et al. Analytical methods for detection of selected estrogenic compounds in aqueous mixtures[J]. Environmental Science & Technology, 1999, 33(16):2814-2820.
[8] Lei B, Huang S, Zhou Y, et al. Levels of six estrogens in water and sediment from three rivers in Tianjin area, China[J]. Chemosphere, 2009, 76(1):36-42.
[9] Brion F, Tyler CR, Palazzi X, et al. Impacts of 17β-estradiol,including environmentally relevant concentrations, on reproduction after exposure during embryo-larval-, juvenile- and adult-life stages in zebrafish(Danio rerio)[J]. Aquatic Toxicology, 2004, 68(3):193-217.
[10]Terriente J, Pujades C. Use of zebrafish embryos for small molecule screening related to cancer[J]. Dev Dyn, 2013, 242(2):97-107.
[11]Meguro S, Hasumura T, Hase T. Coffee polyphenols exert hypochole sterolemic effects in zebrafish fed a high -cholesterol diet[J]. Nutrition & Metabolism, 2013, 10(1):61.
[12]Liu L, Xu Y, Xu L, et al. Analysis of differentially expressed proteins in zebrafish(Danio rerio)embryos exposed to chlorpyrifos[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2015, 167:183-189.
[13]王健, 劉麗麗, 余凱敏, 等. 高效氯氰菊酯對斑馬魚胚胎毒性的研究[J]. 生物技術通報, 2014(10):223-229.
[14]劉麗麗, 王健, 王海勝, 等. 斑馬魚轉基因平臺的建立[J].生物技術通報, 2013(10):120 -126.
[15] Trant JM, Gavasso S, Ackers J, et al. Developmental expression of cytochrome P450 aromatase genes(cyp19a and cyp19b)in zebrafish fry(Danio rerio)[J]. J Exp Zool, 2001, 290(5):475-483.
[16]Von Hofsten J, Olsson PE. Zebrafish sex determination and differentiation:involvement of Ftz-F1 genes[J]. Reproductive Biology and Endocrinology, 2005, 3:63-73.
[17] Wang XG, Bartfai R, Sleptsova-Freidrich I, et al. The timing and extent of ‘juvenile ovary’ phase are highly variable during zebrafish testis differentiation[J]. Journal of Fish Biology, 2007,70(sa):33-44.
[18]J?rgensen A, Morthorst JE, Andersen O, et al. Expression profiles for six zebrafish genes during gonadal sex differentiation[J]. Reproductive Biology and Endocrinology, 2008, 6(1):25.
[19] Shive HR, West RR, Embree LJ, et al. brca2 in zebrafish ovarian development, spermatogenesis, and tumorigenesis[J]. PNAS,2010, 107(45):19350-19355.
[20] Rodríguez-Marí A, Wilson C, Titus TA, et al. Roles of brca2(fancd1)in oocyte nuclear architecture, gametogenesis, gonad tumors,and genome stability in zebrafish[J]. PLoS Genetics, 2011, 7(3):e1001357.
[21] Rodríguez-Marí A, Yan Y, BreMiller RA, et al. Characterization and expression pattern of zebrafish anti-Müllerian hormone(amh)relative to sox9a, sox9b, and cyp19a1a, during gonad development[J]. Gene Expression Patterns, 2005, 5(5):655-667.
[22]Tong S, Hsu H, Chung B. Zebrafish monosex population reveals female dominance in sex determination and earliest events of gonad differentiation[J]. Developmental Biology, 2010, 344(2):849-856.
[23] Orlando E, Guillette JL. Sexual dimorphic responses in wildlife exposed to endocrine disrupting chemicals[J]. Environmental Research, 2007, 104(1):163-173.
[24]Guo Y, Cheng H, Huang X, et al. Gene structure, multiple alternative splicing, and expression in gonads of zebrafish Dmrt1[J]. Biochemical and Biophysical Research Communications, 2005, 330(3):950-957.
[25] Raymond CS, Murphy MW, O’sullivan MG, et al. Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation[J]. Genes & Development, 2000, 14:2587-2595.
[26]Shibata K, Takase M, Nakamura M. The dmrt1 expression in sexreversed gonads of amphibians[J]. General and Comparative Endocrinology, 2002, 127:232-241.
[27] Torres ML, Landa PA, Moreno MN, et al. Expression profiles of Dax1, Dmrt1, and Sox9 during temperature sex determination in gonads of the sea turtle Lepidochelys olivacea[J]. Gen Comp Endocrinol, 2002, 129(1):20-26.
[28] Suzawa M, Ingraham HA. The herbicide atrazine activates endocrine gene networks via non-steroidal NR5A nuclear receptors in fish and mammalian cells[J]. PLoS One, 2008, 3(5):e2117.
[29] Trant JM, Gavasso S, Ackers J, et al. Developmental expression of cytochrome P450 aromatase genes(cyp19a and cyp19b)in zebrafish fry(Danio rerio)[J]. J Exp Zool, 2001, 290(5):475-483.
[30] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4):402-408.
[31] R Core Team. R:A language and environment for statistical computing[CP]. R Foundation for Statistical Computing, Vienna,Austria, 2014. URL http://www. R-project. org/.
[32]Andersen L, Holbech H, Gessbo A, et al. Effects of exposure to 17a-ethinylestradiol during early development on sexual differentiation and induction of vitellogenin in zebrafish(Danio rerio)[J]. Comparative Biochemistry and Physiology Part C,2003, 134:365-374.
[33]Drastichová J, Svobodová Z, Groenland M, et al. Effect of exposure to bisphenol A and 17β-estradiol on the sex differentiation inzebrafish(Danio rerio)[J]. Acta Veterinaria Brno, 2005, 74:287-291.
[34]Fenske M, Maack G, Schfers C, et al. An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio[J]. Environmental Toxicology and Chemistry, 2005, 24(5):1088.
[35]Hirai N, Nanba A, Koshio M, et al. Feminization of Japanese medaka(Oryzias latipes)exposed to 17β-estradiol:Effect of exposure period on spawning performance in sex-transformed females[J]. Aquatic Toxicology, 2006, 79(3):288-295.
[36]Jin Y, Shu L, Huang F, et al. Environmental cues influence EDC-mediated endocrine disruption effects in different developmental stages of Japanese medaka(Oryzias latipes)[J]. Aquatic Toxicology, 2011, 101(1):254-260.
[37] Lawrence C, Ebersole JP, Kesseli RV. Rapid growth and outcrossing promote female development in zebrafish(Danio rerio)[J]. Environmental Biology of Fishes, 2007, 81(2):239-246.
[38] Uchida D, Yamashita M, Kitano T, et al. An aromatase inhibitor or high water temperature induce oocyte apoptosis and depletion of P450 aromatase activity in the gonads of genetic female zebrafish during sex-reversal[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2004, 137(1):11-20.
[39] Shang EHH, Yu RMK, Wu RSS. Hypoxia affects sex differentiation and development, leading to a male-dominated population in zebrafish(Danio rerio)[J]. Environmental Science & Technology,2006, 40(9):3118-3122.
(責任編輯 李楠)
Effects of 17β-estradiol on the Sex Differentiation of Zebrafish(Danio rerio)
Li Guochao Yu Kaimin Feng Weimin Liu Lili Zhang Jiayu Yan Yanchun
(Graduate School,Chinese Academy of Agricultural Sciences,Beijing 100081)
Previous studies have demonstrated that 17β-estradiol(E2)could increase the female proportion in zebrafish population. In order to study mechanisms of feminization caused by E2, quantitative real-time PCR(qRT-PCR)was used to analyze expression levels of genes involved in sexual differentiation(brca2, sox9a, sox9b, dmrt1 and cyp19a1a)under different conditions. The results indicate that E2 can up-regulate the expression levels of the female-predominant genes(brac2 and sox9b), partially down-regulate the expression levels of malepredominant gene(sox9a)and has different effects on sex hormone conversion pathway(cyp19a1a)in different developmental stages of zebrafish.
endocrine disrupting chemicals;17β-estradiol;zebrafish;sexual differentiation
10.13560/j.cnki.biotech.bull.1985.2015.06.032
2014-11-24
國家高技術研究發展計劃項目(2008AA10Z402),國家自然科學基金項目(31170119),中國農業科學院基礎研究基金項目(0042014006,0042012003,0042011006)
李國超,男,碩士研究生,研究方向:微生物分子生物學與基因工程;E -mail:stevelee0201@163.com
閆艷春,女,教授,研究方向:微生物分子生物學與基因工程;E-mail:yanyanchun@caas.cn

