體細胞直接重編程為神經元和神經干細胞
周楨寧
(中國科學院神經科學研究所,上海 200031)
體細胞直接重編程為神經元和神經干細胞
周楨寧
(中國科學院神經科學研究所,上海 200031)
體細胞直接重編程是由已分化細胞類型不經過誘導型多能干細胞(Induced pluripotent stem cells,iPSCs)中間階段,直接轉換為另一種細胞類型的重編程過程。體細胞直接重編程避免了iPSC技術存在的重編程效率低下、引入致癌基因等多種缺陷,并為細胞替換治療和個性化醫藥研發設想貢獻了新的實現途徑。現代醫學對于諸如神經退行性疾病、神經遺傳疾病和外傷導致的神經細胞受損等一些神經系統疾病一直沒有有效的治療手段。而體細胞直接重編程為治療這些疾病提供了另一種治療途徑,因此體細胞直接重編程為神經細胞相關領域迅速成為研究熱點。回顧了體細胞重編程為誘導型神經元(Induced neurons,iNs)和誘導型神經干細胞(Induced neural stem cells,iNSCs)的最新研究進展,并探討iNs和iNSCs在臨床應用上的各自優勢、局限性及應用前景。
誘導型神經元;誘導型神經干細胞;成纖維細胞;直接重編程;誘導轉分化
由于神經元具有不可再生性,因此由神經退行性疾病、神經遺傳疾病和外傷導致的神經細胞受損一直難以得到有效的治療。隨著胚胎干細胞(Embryonic stem cells,ESCs)體外分化和神經誘導方法的建立,細胞替換治療受損神經元的設想成為可能。目前,ESCs神經誘導方法多采用小分子化合物誘導法、細胞因子誘導法及選擇培養基誘導法[1-4]。然而,利用ESCs誘導分化產生的神經元進行細胞替換治療存在異體排斥效應及倫理方面的問題[5]。為此,人們一直努力探索體外產生神經元的新途徑。
2006年,Takahashi和Yamanaka[6]發現在小鼠胚胎或成體成纖維細胞中過表達Oct3/4、Sox2、Klf4和c-Myc四種轉錄因子(下文簡稱為iPSCs重編程因子組)能使成纖維細胞重編程為誘導型多能干細胞(Induced pluripotent stem cells,iPSCs)。時隔一年,Takahashi等[7]將相同的4種轉錄因子轉入人成體成纖維細胞中,成功實現了人成纖維細胞向iPSCs的轉變。伴隨著iPSC技術的誕生,體細胞命運重編程已發展成為無論對于基礎研究還是臨床工作都具有較大發展潛力的一個新領域。
在基礎研究和細胞替換治療研究方面,iPSC技術與傳統的ESC技術相比存在諸多優勢。首先,由于iPSC相關研究無需破壞早期胚胎,因此iPSCs的應用避免了倫理問題。其次,iPSCs具有個體唯一的遺傳信息。該特點使人們能通過制備病人自身的iPSCs來研究導致疾病的遺傳變異,而不必通過建立動物模型來研究疾病[8-10]。此外,利用病人自身的iPSCs進行細胞替代治療不存在異體排斥問題。
雖然iPSC技術在再生醫學領域仍頗具發展潛力,但在深入研究過程中該技術逐步顯現出諸如iPSCs轉換效率低下、存在致瘤性風險等諸多應用局限。基于Takahashi和Yamanaka的iPSC技術,科學家們尋找到一種比現有iPSC技術更高效、更安全、更快速的細胞重編程策略——體細胞直接重編程。
體細胞直接重編程也稱為誘導轉分化,即一種已分化細胞類型直接轉換為另一種已分化細胞類型而不經過iPSCs階段(圖1)。近年來,體細胞直接重編程技術已被證明能快速,且高效地誘導產生誘導型神經元(Induced neurons,iNs)和誘導型神經干細胞(Induced neural stem cells,iNSCs)。Caiazzo證明患有帕金森癥病人的成纖維細胞能直接重編程為iNs[11],而無需先將病人的成纖維細胞重編程為iPSCs,再將iPSCs分化為神經元[12]。在此,我們將回顧體細胞直接重編程為iNs,以及iNSCs的最新進展并探討iNs和iNSCs在臨床應用上的各自優勢、局限性及應用前景。
1 體細胞直接重編程為神經元
體細胞直接重編程為神經元是通過在體細胞中強制表達特定重編程因子,介導細胞命運直接轉換的過程。整個重編程過程避開iPSCs階段,細胞類型之間的轉換不涉及細胞分裂,并且在細胞類型轉換過程中不產生中間相[13](圖1)。目前,人們聯合使用諸如Brn2等神經源性轉錄因子、microRNA(miRNA)以及包括HDAC抑制劑在內的化合物,已經成功實現了誘導轉分化,而且其效率遠遠高于體細胞重編程為iPSC的效率。
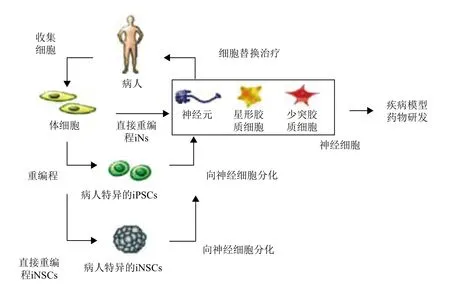
圖1 用于細胞替換治療以及疾病模型研發的三種體細胞重編程為神經細胞策略[14]
2010年初,Vierbuchen等[13]發現使用攜帶多種神經特異性轉錄因子的病毒載體感染小鼠皮膚成纖維細胞,并在細胞中過表達這些因子就能實現小鼠皮膚成纖維細胞向iNs的誘導轉分化。Vierbuchen實驗了多種轉錄調控因子組合并最終確定了能將小鼠皮膚成纖維細胞直接重編程為iNs的3種轉錄調控因子——Brn2、Ascl1和Mytl1(下文簡稱為BAM因子)。這些iNs具有啟動重復、連串動作電位的能力并能在體外與大腦皮層神經細胞形成有功能的突觸聯接。當iNs與星形膠質細胞共培養時,iNs顯示出興奮性突觸后電流,且大多數細胞是谷氨酸能神經元(興奮性神經元)。Vierbuchen的研究意義在于:(1)證明了不同類型的終末分化細胞之間能夠實現直接轉換。(2)證明了像皮膚成纖維細胞等易于取材的細胞能夠被直接重編程為功能性神經元。這對于體細胞直接重編程為各種神經元亞型,優化體細胞向神經元的誘導轉分化方法等后續研究具有重要的參考價值。
時隔一年,Marro[15]研究發現BAM因子不僅能使小鼠皮膚成纖維細胞直接重編程為iNs,還可以使終末分化的肝實質細胞直接重編程為iNs。然而,在肝實質細胞中過表達BAM因子誘導轉分化產生的iNs仍殘留著少量源自供體細胞的表觀遺傳記憶[15]。
在Vierbuchen成功實現小鼠皮膚成纖維細胞誘導轉分化為iNs之后,多個研究團隊就接連紛紛發表各自的人iNs直接重編程方法[11,16-20](表1)。這其中除了Pfisterer[17]在胚胎和新生人成纖維細胞中過表達BAM因子即可重編程產生成熟人iNs之外,其他各研究團隊均需在完整或部分的BAM因子基礎上添加諸如neuroD1/2的神經特異性轉錄因子[18]或miRNAs[16,19]才能實現人體細胞向iNs的誘導轉分化。此外,如果組合使用原有的人iNs重編程因子和神經元亞型特異性轉錄因子,并在體細胞中過表達這些轉錄因子,體細胞就能被直接重編程為多巴胺能神經元[11,17]和運動神經元[20]等神經元亞型。
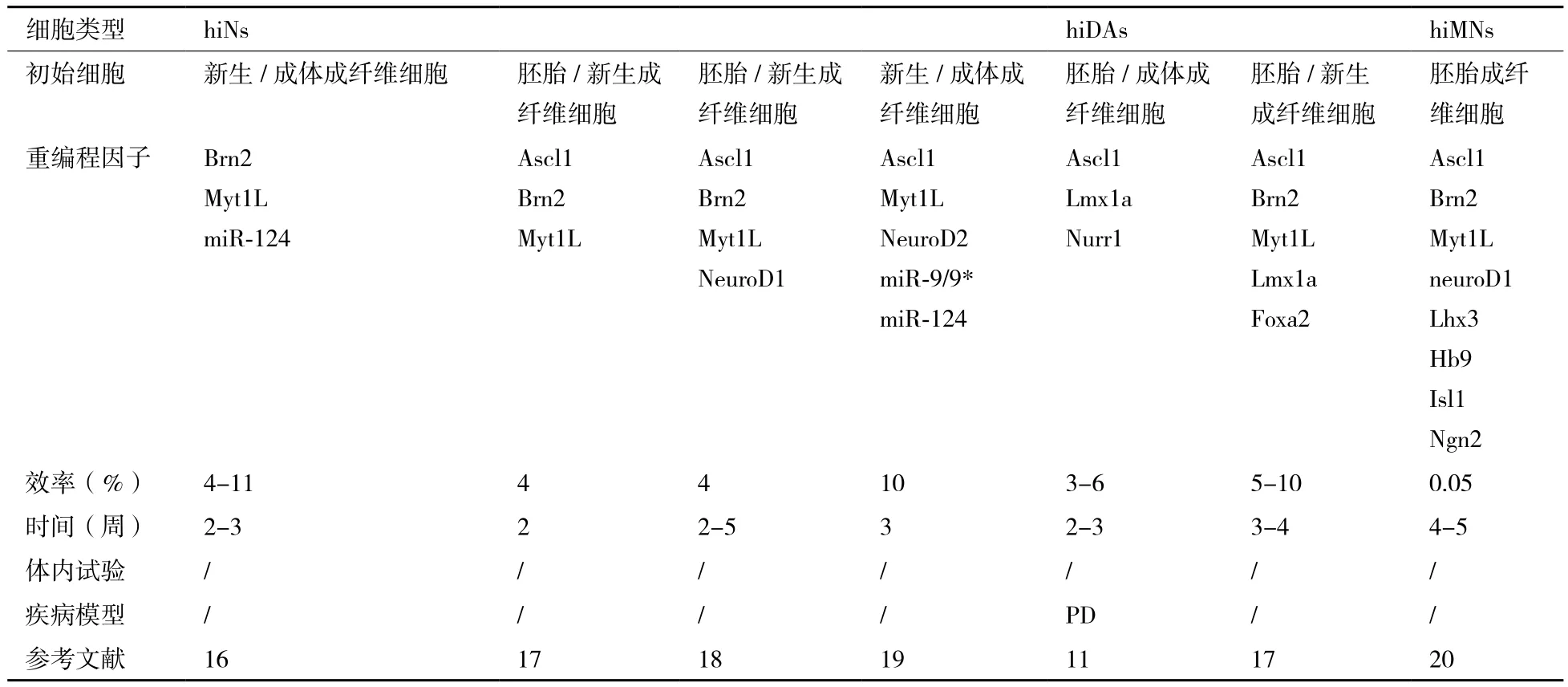
表1 人成纖維細胞直接重編程為誘導型神經元以及誘導型神經元亞型匯總
從表1中我們發現iNs重編程因子不僅局限于轉錄因子,miRNAs也能夠參與體細胞向iNs的誘導轉分化。2010年,Maisel等[21]在比對人骨髓間充質干細胞(bone-marrow-derived human mesenchymal stem cells,hMSCs)和由hMSCs轉換產生的類神經干細胞(hMSCs-derived NSC-like cells,hmNSCs)的轉錄物組后發現miRNA-124a在神經外胚層分化過程中起著重要的調控作用,這說明miRNAs可調控目的基因的轉錄活性,從而影響細胞重編程和細胞命運決定。在體細胞誘導轉分化為神經元的過程中,重編程轉錄因子通常起著轉錄激活的作用,而目前已知的一些特定的miRNAs主要通過抑制多種基因表達來促進誘導轉分化過程。例如,2011年,Yoo等[19]發現miR-124和miR-9/9*協同促進體細胞誘導轉分化為神經元,這兩種miRNAs在成熟神經元中高表達。如果在新生和成體人成纖維細胞中過表達miR-9/9*、miR-124并轉入Ascl1、Myt1l和NeuroD2轉錄因子,就能實現高效地將人成纖維細胞重編程為iNs。同年,Ambasudhan發現在體細胞轉變為iNs的重編程過程中并非必須要轉錄因子Ascl1的參與,只需在新生和成體人成纖維細胞中過表達miR-124、Brn2和Myt1l三種因子就可使其誘導轉分化為iNs[16]。2013年,Xue等[22]在成纖維細胞中過表達miRNA-124a,成功實現成纖維細胞向iNs的誘導轉化二無需使用攜帶外源基因的病毒載體感染細胞。
從上述研究成果中(表1),我們可以歸納出一些關于人體細胞直接重編程為神經元的共同特點:(1)從轉錄因子轉入體細胞開始計算,在一個較短的時間內就能實現體細胞向神經元的誘導轉分化(表達各種神經元標志物),但是需要花費較長時間(通常需要幾周時間)才能獲得功能性成熟神經元。(2)在直接重編程過程中不涉及細胞分裂。(3)當使用胚胎或新生人體細胞直接重編程為神經元時,其成功重編程為人iNs的效率基本與小鼠體細胞直接重編程為神經元的效率一致(4%-10%),但是成體人體細胞直接重編程為神經元的效率要比使用胚胎或新生人體細胞直接重編程的效率低很多。(3)同樣,使用胚胎和新生人體細胞重編程產生的人iNs,其生長、成熟為功能性神經元的速度比成體體細胞重編程產生的人iNs快很多。
體細胞直接重編程為iNs的主要優勢在于能夠快速、簡便地重編程出神經元而無需通過iPSC途徑再分化為神經元。但是,由于iNs不能再增殖,該特性使得一次直接重編程所獲得的細胞量無法滿足基礎研究和臨床應用。此外,相比具有分化潛能的神經細胞,iNs更難以在體外進行純化和培養或向體內移植。為了克服這些障礙,研究者們將目光投向了體細胞直接重編程為iNSCs。
2 體細胞直接重編程為神經干細胞
研究者們發現在體細胞中過表達Oct3/4、Sox2、Klf4和c-Myc四種轉錄因子到最終獲得iPSCs是一個包含有多個細胞分化階段的連續過程,在重編程的最初階段,體細胞被外源轉錄因子激活,進入不穩定的、具有細胞命運可塑性的特殊狀態。如果此時給予這些命運未知的細胞適當的維持多能干細胞生存及生長的環境條件,這些細胞就會被誘導成iPSCs[23-26]。Kim等[27]利用上述研究成果,在小鼠成纖維細胞中短時過表達iPSCs重編程因子組(3-6 d)并在細胞進入不穩定狀態的時候將其置于適合神經干細胞(NSCs)生長的培養基中培養(8-9 d),最終成功獲得iNSCs而無需經過iPSCs階段。這些iNSCs表達NSCs特異標志物Sox1和Pax6而且能在體外自發分化為成熟神經元和星形膠質細胞。然而使用該方法誘導產生的iNSCs在體外傳代3-5次后就喪失了自我更新能力,而且無法分化成少突膠質細胞,這表明該方法誘導產生的iNSCs只具備部分神經干細胞分化潛能。此外,iNSCs在集落形成實驗中表現出巨大的不均一性。例如,一些細胞共表達成神經細胞標志物DCX和多巴胺能神經元標志物TH,甚至有一小部分iNSCs呈多能性相關的干細胞標志物SSEA-1陽性。此現象表明,雖然在整個重編程過程中并沒有檢測到多能性干細胞的存在,但是在體細胞中短時過表達iPSCs重編程因子仍有可能使細胞經歷一種不易察覺的多能性狀態。再者,適合NSCs生長的培養條件無法完全抑制非神經前體細胞的形成,因為培養基中的生長因子能支持包括神經干細胞在內的多種具有分化潛能細胞的生長和增殖。
由于使用Kim重編程策略誘導產生的iNSCs存在諸多局限,Their[28]和Han[29]分別對Kim的重編程方法進行了改進。Thier基于野生型NSCs內源表達iPSCs重編程因子組中的3種因子(c-Myc,Klf4和Sox2)的發現,假設在成纖維細胞中過表達上述三種轉錄因子,并控制Oct4短時表達有可能在避免激活內源Oct4的前提下,將成纖維細胞直接重編程為iNSCs。為了研究該假設的可行性,Thier利用四環素依賴的慢病毒載體將編碼Oct4的基因轉入小鼠胚胎成纖維細胞(Mouse embryonic fibroblasts,MEFs)中,并控制Oct4僅在重編程的最初5 d表達。與此同時,攜帶有c-Myc、Klf4,以及Sox2基因的逆轉錄病毒感染細胞。誘導19 d后,成纖維細胞誘導轉分化為iNSCs。該方法獲得的iNSCs可在體外擴增傳代50代以上仍保持著和野生型NSCs相似的細胞形態和生長速率。此外,iNSCs在體外和體內環境中均能分化產生星形膠質細胞(GFAP+)、少突膠質細胞(O4+)以及神經元(Tuj1+、NeuN+、MAP2+),該結果表明iNSCs具有多向分化潛能。Thier在對iNSCs的基因表達情況進行分析后發現iNSCs的基因表達特征同野生型NSCs非常相似,并且外源基因都已被沉默。然而,iNSCs表達的某些基因與MEFs相似,而且這些基因在野生型NSCs中并不表達。上述現象說明,雖然MEFs已完全被誘導轉分化為iNSCs,但是iNSCs仍然保留著某些供體細胞的表觀遺傳記憶。Han則組合使用多能干細胞和神經干細胞的轉錄因子,即Brn4/Pou3f4、Sox2、Klf4、c-Myc和E47/Tcf3轉錄因子組成功地將小鼠成纖維細胞誘導轉分化為iNSCs。該方法誘導產生的iNSCs具有與野生型NSCs相似的細胞形態、自我更新能力及基因表達特征。值得一提的是,iNSCs可在體外擴增傳代130代以上而且移植到免疫抑制小鼠體內不會形成畸胎瘤,這充分說明了使用該重編程方法獲得的iNSCs不含有多能干細胞。通過Thier以及Han的重編程方法獲得的iNSCs均能在適當的體外培養條件下分化產生多種具備自發啟動動作電位并能形成功能性突觸聯接的神經元亞型(GABA能神經元、谷氨酸能神經元、膽堿能神經元和多巴胺能神經元)。
上述3種體細胞直接重編程為iNSCs的方法均涉及在體細胞中過表達致癌基因——c-Myc,這使得iNSCs存在激活內源致癌基因繼而誘發腫瘤的風險。為了最大程度降低iNSCs的致瘤風險,Lujan等[30]實驗了多種轉錄因子組合并最終確定了Sox2、FoxG1和Brn2轉錄因子組。在小鼠成纖維細胞中過表達上述轉錄因子組能誘導轉分化產生iNSCs。iNSCs具有分化成神經元、少突膠質細胞和星形膠質細胞的分化潛能,并且在經過多次傳代后仍能分化產生成熟神經元(Tuj-1+/MAP2+)。這項研究表明,在體細胞中過表達合適的神經特異性轉錄因子組是能實現體細胞向iNSCs誘導轉分化而無需iPSCs重編程因子的參與。從臨床應用的角度來看,相比通過體細胞過表達含有c-Myc的轉錄因子組誘導獲得的iNSCs,該方法獲得的iNSCs,其致瘤風險被大大降低了,不過Lujan的研究報告中并沒有提及iNSCs能否在體內環境中分化產生神經元和星形膠質細胞。
Ring等[31]進一步證明只需過表達Sox2一種轉錄因子即可將小鼠或人成纖維細胞直接重編程為iNSCs。使用該重編程方法獲得的人和鼠iNSCs均表達Sox2、Nestin、Sox1等神經干細胞標志物,不表達Oct4、Nanog等多能干細胞相關基因。鼠iNSCs在體內具有存活能力并能分化成NeuN+神經元、GFAP+星形膠質細胞和O4+少突膠質細胞。人iNSCs具備和野生型NSCs相似的細胞形態和自我更新能力,且能在合適的體外誘導環境下分化成神經元、星形膠質細胞和少突膠質細胞。但由于Ring的重編程策略依賴于逆轉錄病毒感染系統,因而該方法無法解決外源基因整合到細胞基因組的問題。
3 展望
繼iPSCs被發現之后,體細胞直接重編程為iNs為重編程研究翻開了新的篇章。與體細胞重編程為iPSCs形成鮮明對比,體細胞直接重編程為iNs是兩個已分化細胞系之間的直接轉換,無需經過多能細胞階段,也不涉及細胞增殖。體細胞直接重編程iNs為細胞命運決定相關研究、藥物研發和細胞替換治療提供了新的研究途徑和應用方法。緊隨iNs的研究步伐,體細胞直接重編程成為iNSCs成為推動重編程研究的又一動力。由于iNSCs能在體外擴增并能進一步分化為多種神經系統細胞,因此iNSCs在細胞替代治療方面有多種優勢。
然而,目前體細胞直接重編程為iNs和iNSCs多采用病毒轉染方法,而病毒載體的使用存在病毒基因整合到初始細胞的基因組并導致細胞基因發生變異的可能性,故而探索合適的非整合轉染方法對于iNs和iNSCs能否應用于臨床起關鍵作用。近年來,陸續報道了一些基于非整合轉染系統的重編程研究,這些轉染系統包括非整合腺病毒[32]、基于oriP/EBNA1游離型載體[33]、piggyBac轉座系統[34]、瞬時轉染重編程質粒[35]、Cre重組酶切除病毒[36]以及重組蛋白[37,38]等,但是上述非整合轉染系統在實際應用中或多或少存在各種局限,DNA轉染方法存在不可預知的基因突變風險,而重組蛋白則存在重編程不完全或啟動重編程進程不夠靈敏的問題。此外,相比病毒感染的重編程方法,某些技術顯示出非常低的重編程效率。
2010年,Warren等[39]證明在多種體細胞(如胚胎和成體成纖維細胞)中導入合成的編碼iPSCs重編程因子的mRNA能夠實現體細胞向iPSCs的高效誘導轉分化。通過mRNA誘導轉分化產生的iPSCs在分子生物學水平上的表型和hESCs非常相似,并且具備三胚層分化能力[39]。由于mRNA在細胞內具有快速降解的特性,因此基于mRNA轉染系統的重編程方法比基于病毒感染系統的經典重編程方法更為安全。我們據此推測該技術將來可以應用于體細胞誘導轉分化為iNSCs和iNs。
在多個研究團隊熱衷于研發各種非整合重編程方法的同時,另外一些研究團隊正致力于研究使用小分子化合物替代重編程因子中的部分轉錄因子,來減少對使用病毒載體的依賴并提高重編程效率,最終實現小分子化合物直接替代重編程因子并完全擺脫對病毒載體的依賴。例如,已證明在重編程轉錄調控因子組中加入HDAC抑制劑丙戊酸能提高重編程效率[40,41]。Anokye-Danso等[42]證明在成纖維細胞中表達miR302/367簇的同時合并使用丙戊酸,能介導HDAC2的抑制,最終大幅提高成纖維細胞去分化的效率。
無論是使用合成mRNAs、轉錄因子、小分子化合物進行體細胞重編程還是運用非整合轉基因系統重編程細胞,所有這些細胞命運重編程的新方法都是為了排除外源基因整合進入基因組的風險,以促進基礎研究向臨床應用轉化。
綜上所述,作為新興技術,未來體細胞直接重編程的研究重點可能轉向提高重編程效率,開發適合臨床應用的重編程方法以及研發更安全的重編程因子導入系統方面。為此,未來體細胞直接重編程技術仍將是研究熱點。
[1]Bain G, Kitchens D, Yao M, et al. Embryonic stem cells express neuronal properties in vitro[J]. Dev Biol, 1995, 168:342-357.
[2]Kawasaki H, Mizuseki K, Nishikawa S, et al. Induction of midbrain dopaminergic neurons from ES cells by stromal cell-derived inducing activity[J]. Neuron, 2000, 28(1):31-40.
[3]Lee SH, Lumelsky N, Studer L, et al. Efficient generation of midbrain and hindbrain neurons from mouse embryonic stem cells[J]. Nat Biotechnol, 2000, 18(6):675-679.
[4]Okabe S, Forsberq-Nilsson K, Spiro AC, et al. Development of neuronal precursor cells and functional postmitotic neurons from embryonic stem cells in vitro[J]. Mech Dev, 1996, 59:89-102.
[5]Cohen CB. Ethical and policy issues surrounding the donation of cryopreserved and fresh embryos for human embryonic stem cell research[J]. Stem Cell Rev, 2009, 5(2):116-122.
[6]Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[7]Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J]. Cell, 2007, 131(5):861-872.
[8]Park IH, Arora N, Huo H, et al. Disease-specific induced pluripotent stem cells[J]. Cell, 2008, 134(5):877-886.
[9]Urbach A, Bar-Nur O, Daley GQ, et al. Differential modeling of fragile X syndrome by human embryonic stem cells and induced pluripotent stem cells[J]. Cell Stem Cell, 2010, 6(5):407-411.
[10]Marchetto MC, Carromeu C, Acab A, et al. A model for neural development and treatment of Rett syndrome using human induced pluripotent stem cells[J]. Cell, 2010, 143(4):527-539.
[11]Caiazzo M, Dell’Anno MT, Dvoretskova E, et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts[J]. Nature, 2011, 476:224-227.
[12]Dimos JT, Rodolfa KT, Niakan KK, et al. Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons[J]. Science, 2008, 321(5893):1218-1221.
[13]Vierbuchen T, Ostermeier A, Pang ZP, et al. Direct conversion of fibroblasts to functional neurons by defined factors[J]. Nature,2010, 463:1035-1041.
[14]Hermann A, Storch A. Induced neural stem cells(iNSCs)in neurodegenerative diseases[J]. J Neural Transm, 2013, 120(Suppl 1):S19-S25.
[15]Marro S, Pang ZP, Yang N, et al. Direct lineage conversion of terminally differentiated hepatocytes to functional neurons[J]. Cell Stem Cell, 2011, 9:374-382.
[16]Ambasudhan R, Talantova M, Coleman R, et al. Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions[J]. Cell Stem Cell, 2011, 9:113-118.
[17]Pfisterer U, Kirkeby A, Torper O, et al. Direct conversion of human fibroblasts to dopaminergic neurons[J]. Proc Natl Acad Sci USA, 2011, 108:10343-10348.
[18]Pang ZP, Yang N, Vierbuchen T, et al. Induction of human neuronalcells by defined transcription factors[J]. Nature, 2011, 476:220-223.
[19]Yoo AS, Sun AX, Li L, et al. MicroRNA-mediated conversion of human fibroblasts to neurons[J]. Nature, 2011, 476:228-231.
[20]Son EY, Ichida JK, Wainger BJ, et al. Conversion of mouse and human fibroblasts into functional spinal motor neurons[J]. Cell Stem Cell, 2011, 9:205-218.
[21]Maisel M, Habisch HJ, Royer L, et al. Genome-wide expression profiling and functional network analysis upon neuroectodermal conversion of human mesenchymal stem cells suggest HIF-1 and miR-124a as important regulators[J]. Exp Cell Res, 2010, 316(17):2760-2778.
[22] Xue Y, Ouyang K, Huang J, et al. Direct conversion of fibroblasts to neurons by reprogramming PTB-regulated microRNA circuits[J]. Cell, 2013, 152(1-2):82-96.
[23]Brambrink T, Foreman R, Welstead GG, et al. Sequential expression of pluripotency markers during direct reprogramming of mouse somatic cells[J]. Cell Stem Cell, 2008, 27(2)151-159.
[24]Hanna J, Saha K, Pando B, et al. Direct cell reprogramming is a stochastic process amenable to acceleration[J]. Nature, 2009,462(7273)595-601.
[25]Stadtfeld M, Maherali N, Breault D. T, et al. Defining molecular cornerstones during fibroblast to iPS cell reprogramming in mouse[J]. Cell Stem Cell, 2008, 2(3)230-240.
[26]Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration[J]. Science, 2008b, 322(5903)945-949.
[27]Kim J, Efe JA, Zhu S, et al. Direct reprogramming of mouse fibroblasts to neural progenitors[J]. Proc Natl Acad Sci USA,2011, 108(19)7838-7843.
[28]Thier M, W?rsd?rfer P, Lakes YB, et al. Direct conversion of fibroblasts into stably expandable neural stem cells[J]. Cell Stem Cell, 2012, 10(4)473-479.
[29]Han DW, Tapia N, Hermann A, et al. Direct reprogramming of fibroblasts into neural stem cells by defined factors[J]. Cell Stem Cell, 2012, 10(4)465-472.
[30]Lujan E, Chanda S, Ahlenius H, et al. Direct conversion of mouse fibroblasts to self-renewing, tripotent neural precursor cells[J]. Proc Natl Acad Sci USA, 2012, 109(7)2527-2532.
[31]Ring KL, Tong LM, Balestra ME, et al. Direct reprogramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor[J]. Cell Stem Cell, 2012, 11(1)100-109.
[32]Stadtfeld M, Nagaya M, Utikal J, et al. Induced pluripotent stem cells generated without viral integration[J]. Science, 2008, 322(5903):945-949.
[33]Yu J, Hu K, Smuga-Otto K, et al. Human induced pluripotent stem cells free of vector and transgene sequences[J]. Science, 2009,324(5928):797-801.
[34]Kaji K, Norrby K, Paca A, et al. Virus-free induction of pluripotency and subsequent excision of reprogramming factors[J]. Nature,2009, 458(7239):771-775.
[35]Okita K, Nakagawa M, Hyenjong H, et al. Generation of mouse induced pluripotent stem cells without viral vectors[J]. Science,2008, 322(5903):949-953.
[36]Soldner F, Hockemeyer D, Beard C, et al. Parkinson’s disease patient-derived induced pluripotent stem cells free of viral reprogramming factors[J]. Cell, 2009, 136(5):964-977.
[37]Zhou H, Wu S, Joo JY, et al. Generation of induced pluripotent stem cells using recombinant proteins[J]. Cell Stem Cell, 2009, 4(5):381-384.
[38]Kim D, Kim CH, Moon JI, et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J]. Cell Stem Cell, 2009, 4(6):472-476.
[39]Warren L, Manos PD, Ahfeldt T, et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J]. Cell Stem Cell,2010, 7(5):618-630.
[40]Chen S, Zhang Q, Wu X, et al. Dedifferentiation of lineagecommitted cells by a small molecule[J]. J Am Chem Soc, 2004,126(2):410-411.
[41]Huangfu D, Maehr R, Guo W, et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J]. Nat Biotechnol, 2008, 26(7):795-797.
[42]Anokye-Danso F, Trivedi CM, Juhr D, et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency[J]. Cell Stem Cell, 2011, 8(4):376-388.
(責任編輯 狄艷紅)
Direct Reprogramming of Somatic Cells into Neurons and Neural Stem Cells
Zhou Zhenning
(Institute for Neuroscience,Chinese Academy of Sciences,Shanghai 200031)
The direct reprogramming of somatic cells is a process that one differentiated cell type can be directly converted into another kind of differentiated cell type,which bypasses the phase of induced pluripotent stem cells(iPSCs). Compared with the iPSC technology,the direct reprogramming of somatic cells has higher efficiency of reprogramming,and avoids introducing oncogenes.Modern medicine has no effective treatment for nerve cell damage which due to neurodegenerative diseases,neurological genetic diseases and traumatism. Somatic cells directly reprogramming into neural cells may provide another way to treat these diseases. Recently,several studies have shown that the ectopic expression of specific neural and pluripotent stem cell transcription factors can directly convert differentiated cells into induced neurons(iNs)and induced neural stem cells(iNSCs). Here,we will review the most recent progress in the somatic cells directly reprogramming into iNs and iNSCs and also discuss the application of iNs and iNSCs in future.
induced neurons;induced neural stem cells;fibroblasts;direct reprogramming; induced transdifferentiation
10.13560/j.cnki.biotech.bull.1985.2015.07.037
2015-01-23
周楨寧,女,碩士研究生,研究方向:多能干細胞誘導分化;E-mail:zhouatp@163.com

