TWEAK蛋白在出血后大鼠腦組織中的表達及在腦水腫中的作用研究
劉忠偉
(吉林市人民醫院神經內科二療區,吉林 吉林 132001)
TWEAK蛋白在出血后大鼠腦組織中的表達及在腦水腫中的作用研究
劉忠偉
(吉林市人民醫院神經內科二療區,吉林 吉林 132001)
目的 TWEAK(TNF-like weak inducer of apoptosis)腫瘤壞死因子樣凋亡微弱誘導劑是腫瘤壞死因子家族成員之一,最近研究表明TWEAK在腦缺血后的腦水腫形成中起重要作用,但在腦出血中的作用卻缺乏研究證據。本研究觀察TWEAK在大鼠腦出血后腦組織中的表達及抗TWEAK單克隆抗體對出血后腦水腫形成的影響。方法 免疫印記定量檢測對照組及出血后3 h、4.5 h、6 h 及1 d、2 d、7 d大鼠腦組織TWEAK蛋白。顱內注射抗TWEAK單克隆抗體觀察TWEAK在大鼠出血后24 h對腦水腫形成的影響。結果 免疫印記表明TWEAK在對照組有基本表達,從出血后3~6 h表達明顯增加,在6 h達到高峰。接著在第1、2和7天開始向正常水平回落。此外,與PBS對照組相比,抗TWEAK單克隆抗體能明顯降低大鼠腦出血后24 h腦水腫的形成[從(81.8±0.5)%到(78.3±0.3)%,P<0.01]。然而在對側基底節,TWEAK對腦水含量沒有影響。結論 TWEAK在腦出血后的3 h、4.5 h、6 h、24 h表達上調,并在6 h達到高峰,1 d開始表達向正常回落。此外,TWEAK抑制劑在大鼠腦出血后第二天能明顯降低腦水腫的形成。
腫瘤壞死因子樣凋亡微弱誘導劑;免疫印記;腦出血;腦水腫
1 材料與方法
1.1主要試劑和儀器:兔抗鼠anti-TWEAK單克隆抗體和多克隆抗體購于美國Abcam公司,立體定位儀及圖像分析系統由中心實驗室學提供。
1.2動物模型及分組:選用注入自體動脈血建立大鼠腦出血模型[1],大鼠用水合氯醛麻醉(350 mg/kg,i.p.)后放置于立體定位儀上,在左側顱骨(前囟前0.2 mm,中線左側3 mm)轉約1 mm大小的孔(圖1A、圖2),自體股動脈血(至少50 μL)被收集到無菌不加任何抗凝劑的無針胰島素注射器內。26號針頭立即連接到注射器,用立體定向儀將50 μL股動脈血引入到左側頭骨轉孔表面下5.5 mm下的尾狀核位置。50 μL股動脈血共10 min注完,留針15 min以防反流。用骨蠟封顱孔,頭皮縫合后放入籠內,自由進食水。對照組僅不注血。動物分別在出血損傷后3 h、4.5 h 、6 h、1 d、2 d和7 d被處死用于實驗分析。將動物隨機分成A、B、C三組。A組用于觀察TWEAK在對照組腦組織及出血腦組織TWEAK蛋白表達。分對照組(僅不注血,余同出血組),每組3只;出血模型組,模型組在分成出血后3 h、4.5 h、6 h、24 h、48 h、7 d 6個亞組,每個亞組3只。C組用于觀察顱內注射anti-TWEAKmAb(10 μg,20 μL)或同體積PBS后腦水含量變化。分PBS組,anti-TWEAKmAb組,每組6只。
1.3TWEAK蛋白的免疫印跡(Western Blot)檢測:免疫印跡用于TWEAK定量分析并確認TWEAK抗體的特異性。將大鼠注入50 μL生理鹽水(對照組)或50 μL自體動脈血。對照組在出血后24 h將其處死,出血組分別在出血后3 h、4.5 h、6 h、1 d、2 d、10 d將其處死(每個時間點3只),大鼠經水合氯醛過量麻醉后立即取腦,將其切成3 mm厚的冠狀組織塊(距額極4 mm處開始),組織勻漿后加入包含有62.5 mmol/L的This-HCl,2%十二烷基硫酸鈉(SDS),10%甘油以及50 mmol/L脫氧膽酸的3倍于組織體積的裂解液,裂解20 min后離心(4 ℃,14000 g,15 min),取上清后放于-70 ℃冰箱中備用。采用牛血清蛋白(BSA)檢測蛋白濃度。每個凝膠泳道加入15 μg蛋白,用15%分離膠分離蛋白,然后在轉膜液中將蛋白轉到醋酸纖維膜上,將膜放入含5%脫脂奶粉的TBST液(100 mmol/L Tris,pH 7.6,150 mmol/L NaCl,0.1% Tween 20)中封閉1 h,接著用兔抗鼠TWEAK多克隆抗體(1∶800;Abcam,USA貨號ab37170)室溫孵育1 h,TBST清洗3次,再用辣根過氧化物酶標記的羊抗兔IgG-HRP(1∶6000;Santa Cruz Biotechnology)孵育1 h,用ECL化學發光系統觀察與IgG-HRP結合的TWEAK抗體,用圖像分析系統分析TWEAK蛋白免疫印跡條帶的光密度。
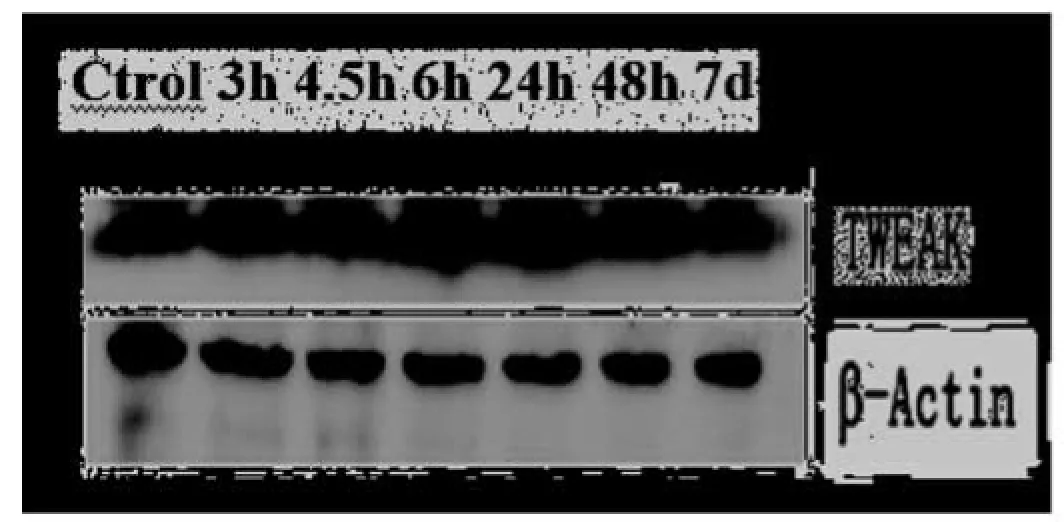
圖1 A Western blot,出血后各時間點TWEAK的蛋白表達
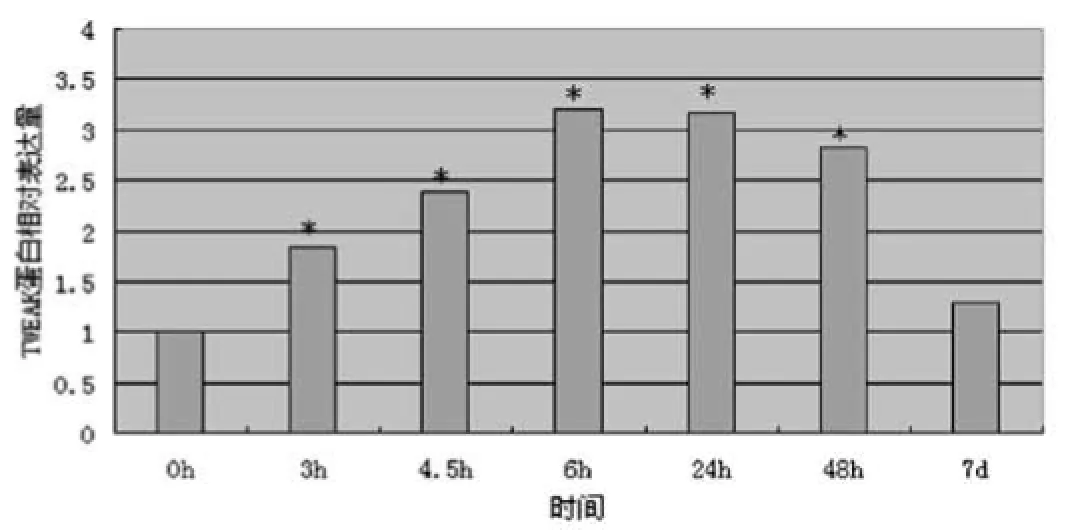
圖1 B TWEAK蛋白的免疫印記分析。將各時間點TWEAK的平均蛋白表達水平與相應內參表達的比值比作為標準化比值,得出的各值在相對0 h值得出比值。*P<0.05(與0 h值比較)
1.4腦水含量的測定:將研究動物分成兩組,PBS對照組和抗TWEAK單克隆抗體組,每組6只。50 μL自體動脈血注入左側基底節后2 h將抗TWEAK單克隆抗體(0.5 mg/mL,Abcam,USA)20 μL注入大鼠第三腦室(前囟,-1;中線,0;背腹,5),對照組注入同體積的PBS(圖1B、圖2)。24 h后取出腦組織用于測量腦水腫。先將腦組織從距額極4 mm處切成3 mm厚的冠狀組織塊,在沿中線切開成兩個半球。每個半球包含有基底節。這樣,從每個腦組織中可得2個樣本,即:同側及對側基底節。用電子分析天枰稱重獲得濕重(WW),而后將組織放入100 ℃恒溫箱中烘烤24 h后獲得干重(DW)。如下公式計算腦水含量(%):(WW-DW)/WW×100。
1.5統計分析:不同組間差異采用t檢驗及方差分析進行檢測,所有數據采用均數±標準差表示,P<0.05認為有統計意義。
2 結果
2.1免疫印記分析:從Western Blot中可以看出,TWEAK蛋白在對照組腦組織中有基礎表達,但從出血后3~6 h表達明顯增加并在6 h達到高峰(圖1A-1B)。在第1、2和7天開始向正常回落,第7天明顯下降(圖1A-1B),但密度值仍高于對照組,然而二者沒有顯著差異。
2.2TWEAK抑制劑對出血后腦水腫形成的影響:出血后2 h顱內注射抗TWEAK單克隆抗體可明顯減少出血后24 h血腫周圍的水腫形成。在抗TWEAK抗體組,同側基底節,腦水含量是(78.3±0.3)%;PBS對照組,同側基底節,腦水含量是(81.8±0.5)%,P<0.01。在對側基底節抗TWEAK單克隆隆對腦水含量沒有影響,與對照組相比沒有明顯差異(圖2和表1)。
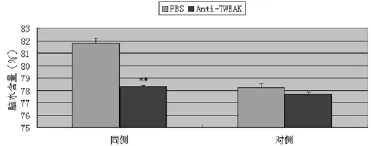
圖2 出血24 h后在Anti-TWEAK組和PBS對照組中同側及對側基底節的腦水含量(每組6只)。數據用均數±標準差表示。在同側基底節,Anti-TWEAK組與PBS組相比能明顯降低腦水腫,二者有顯著差異,P<0.01,在對側基底節二者沒有明顯差異,P>0.05,**P<0.01(與對照組比較)

表1 各組腦組織腦水含量變化比較(x-±s,n=6)
3 討論
TWEAK是表達廣泛的細胞因子。已有大量研究表明,TWEAK可在多種細胞和多發性硬化、缺血性卒中等模型的組織中表達。但TWEAK是否參與腦出血還不清楚。本研究表明,TWEAK也同樣在腦出血中發揮作用。首先,本研究表明與對照組相比TWEAK在出血組表達上調。通過免疫印跡定量檢測TWEAK蛋白發現,與對照組相比TWEAK在出血后3、4.5、6 h表達明顯上調,并在6 h達到高峰。在出血后的24 h和48 h表達仍維持在較高水平并開始趨于向正常水平緩慢回落,出血后7 d表達明顯下降,但仍高于對照組。以上研究表明,TWEAK同樣參與了出血后的腦組織損傷。此外,本研究通過注射TWEAK抑制劑發現,與PBS對照組相比,Anti-TWEAK單克隆抗體能明顯降低大鼠出血同側基底節的腦水腫,而對出血對側沒有影響。這也表明TWEAK可能作為毒性因子在出血后的腦水腫形成中發揮作用.與缺血性卒中相比,腦出血后可通過多條途徑造成腦損傷,如炎癥相關機制,毒素釋放及蛋白分解酶等[2]。往往比缺血性卒中預后更差。Potrovita等發現,在小鼠缺血卒中模型,缺血腦組織中TWEAK表達能提高2倍[3]。本研究通過免疫印跡分析發現,TWEAK表達在出血后6 h達到高峰,表達約提高3倍。這也為腦出血后往往比缺血性卒中有更為嚴重的損傷和預后提供了部分線索。此外,本研究免疫印跡還表明TWEAK表達在出血后6 h達到高峰后,在24 h和48 h仍維持在較高水平。這表明TWEAK可能在出血后的持續腦水腫中發揮作用,TWEAK參與了出血性腦損傷的延遲相。以往研究表明,腦出血后腦水腫要經歷兩個嚴重階段:出血急性期(<6 h)和出血后48 h的高峰期[4]。二者可能有不同的作用機制。本研究表明TWEAK在出血急性期(<6 h)表達迅速上調,提示TWEAK可能在出血急性期發揮重要作用。因此,在出血急性期治療腦水腫更為有效;TWEAK抑制劑在治療出血后腦水腫方面,特別是在出血急性期,可能更好發揮治療效用。 綜上所述,應用TWEAK抑制劑治療腦水腫可能更為有效,特別是在腦出血急性期(<6 h)。而且,TWEAK抑制劑也可能會在出血后的腦損傷中發揮神經保護作用。這與傳統滲透性藥物相比可能更具優勢。應用TWEAK抑制劑治療出血后腦水腫很可能成為較為理想的新型療法。
4 結論
TWEAK蛋白在大鼠腦出血后表達上調,并可能參與了出血后腦水腫的形成。TWEAK抑制劑能明顯降低大鼠出血后腦水腫。
[1] Xue M,Del Bigio MR.Comparison of brain cell death and in flammatory reaction in the three models of intracerebral hemorrhage in adult rats[J].Stroke Cerebrovasc Dis,2003,12(3):152-159.
[2] ronowski J,Hall CE.New horizons for primary intracerebral hemorrhage treatmeat:experience from preclinical studies[J].Neurol Res,2005,27(3):268-279.
[3] Potrovita I.Tumor necrosis factor-like weak inducer of apoptosisinduced neurodegeneration[J].Neurosci,2004,24(38):8237-8244.
[4] Wu H,Zhao R,Qi J,et al.The expression and the role of protease nexin-1 on brain edema after intracerebral hemorrhage[J].Neurol Sci,2008,270(1/2):172-183.
R743.3
B
1671-8194(2015)36-0036-02

