凝集生長毛乳頭細胞膜聯蛋白A2的表達特性研究
夏汝山 孫慧 陶詩沁 曹蕾 楊莉佳
凝集生長毛乳頭細胞膜聯蛋白A2的表達特性研究
夏汝山 孫慧 陶詩沁 曹蕾 楊莉佳
目的 探討膜聯蛋白A2在毛乳頭細胞(DPC)凝集生長中的表達特點。方法 反轉錄PCR和Western印跡方法分別在基因和蛋白水平研究膜聯蛋白A2在DPC凝集和非凝集生長狀態下的表達特點。結果 在DPC凝集性生長狀態下,膜聯蛋白A2 mRNA表達水平顯著高于非凝集生長狀態,差異有統計學意義(0.50±0.15比0.35±0.19,t=8.26,P<0.05)。在蛋白質水平,膜聯蛋白A2表現為相對分子質量為40 000的膜聯蛋白A2異構體和分子質量為36 000的膜聯蛋白A2兩種形式,前者在凝集與非凝集生長的DPC均高表達,后者在凝集生長的DPC表達,在非凝集生長的DPC則不表達。結論 膜聯蛋白A2可能與DPC的凝集生長密切相關。
毛囊;膜聯蛋白A2;細胞生長過程;逆轉錄聚合酶鏈反應;印跡法,蛋白質;毛乳頭細胞
毛囊發育和周期循環主要依賴毛囊上皮與毛乳頭的相互作用[1],毛乳頭發揮重要作用。凝集生長的毛乳頭細胞(dermal papilla cells,DPC)分泌大量蛋白樣因子,共同調節其他毛乳頭細胞、外根鞘細胞、內皮細胞和角質形成細胞的增殖[2]。為了探索調控DPC生長的分子機制,我們運用蛋白質組學技術分析凝集與非凝集生長的DPC的蛋白表達差異,并初步確定膜聯蛋白(annexin)A2在凝集生長的DPC中特異性高表達[3]。膜聯蛋白屬于保守的鈣離子調節磷脂結合蛋白家族,廣泛參與細胞一系列生物學進程,但膜聯蛋白A2在毛囊周期和DPC生長中的作用尚未見報道。為了分析質譜鑒定結果,我們研究膜聯蛋白A2在基因和蛋白水平的表達,探索其在DPC凝集生長中的表達特點。
材料與方法
一、材料
1.主要試劑及儀器:DMEM培養基為美國Hyclone公司產品;胰蛋白酶為美國Sigma公司產品。兔抗人膜聯蛋白A2多克隆抗體為美國Genex Bioscience公司產品;辣根過氧化物酶(HRP)標記山羊抗兔IgG(H+L)和3,3-二氨基聯苯胺(DAB)為北京中山生物技術有限公司產品。
2.標本:所需毛乳頭來自門診頭皮活檢術后殘留的含毛發皮損。本研究經無錫市第二人民醫院倫理委員會批準,患者均簽署知情同意書。
二、方法
1.雙向電泳及圖像分析:毛乳頭的分離和培養均參照本課題組成熟的技術方法[4]。150 μg總蛋白與重水化液{8 mol/L尿素,2%3-[(3-膽酰胺基丙基)二甲基銨基]-1-丙磺酸鹽(CHAPS),60 mmol/L二硫蘇糖醇(DTT)和0.5%固相pH梯度(IPG)緩沖液,pH 3~10}混合,總體積250 μl,吸入IPG膠槽,置于IPGphor等電聚焦儀電極板上,重水化和等電聚焦在20℃自動進行,總電壓時間積40 000 V·h。等電聚焦后于平衡液中平衡2次。十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)在SE600電泳儀中進行。電泳結束后,用質譜兼容的銀染法染色,超純水脫色至背景清楚;用Gel Doc 2000成像系統對凝膠進行掃描,圖像經PDQuest分析軟件進行處理并比較差異蛋白質點。
2.肽質量指紋譜(PMF)鑒定目的蛋白:選取目的蛋白點,從凝膠上準確切割后用水清洗,用含50%乙腈和25 mmol/L NH4HCO3溶液浸泡至藍色褪盡;真空離心干燥至完全脫水,加入0.01 g/L胰酶溶液,待酶液完全吸收后補充25 mmol/L NH4HCO3,37℃保溫15 h;加5%三氟乙酸于40℃保溫1 h,吸出上清;加入2.5%三氟乙酸,50%乙腈于30℃保溫1 h,吸出上清;上清液冷凍干燥。制備好的樣品置于質譜儀上進行分析,獲得的肽質量指紋圖譜(PMF)直接經Mascot軟件和NCBInr數據庫檢索。
3.反轉錄(RT)-PCR檢測膜聯蛋白A2在基因水平的表達:按Trizol試劑說明書,提取DPC總RNA。取2 μg總RNA,按SuperscriptⅡ反轉錄試劑盒說明書反轉錄為cDNA,反應條件為:65℃變性5 min,50℃反轉錄50 min。PCR擴增膜聯蛋白A2基因,上游引物:5′-TGAAGTCAGCCTTATCTGGC-3′,下游引物:5′-ATTGACCAAGATGCTCGG-3′,擴增片段長度為329 bp;β肌動蛋白為內參照,上游引物:5′-CGGG ACCTGACTGACTACCTC-3′,下游引物:5′-CAAGAAAGGGTGTA ACGCAAC-3′,擴增片段長度為618 bp。PCR反應條件為:95℃預變性3 min,95℃變性30 s,56℃退火30 s,72℃延伸45 s,35個循環,PCR產物經15 g/L瓊脂糖凝膠電泳。實驗重復3次,結果經凝膠成像系統結合MultiGauge V3.1進行光密度分析,根據灰度值分析mRNA表達差異。
4.Western印跡檢測膜聯蛋白A2在蛋白水平的表達:①蛋白質樣品制備:毛乳頭細胞團內加入20 mmol/L Tris緩沖液,渦旋器上振蕩約10 min后,冰浴超聲裂解至混懸液清亮透明,12 000×g離心40 min,留取上清,Bradford法測定蛋白質濃度;②常規蛋白電泳:按每孔上樣量50 μg進行SDS-PAGE電泳,穩壓冰浴電轉至硝酸纖維素膜上,5%脫脂牛奶封閉2 h,兔抗人膜聯蛋白A2多克隆抗體(1∶500)孵育4℃過夜,加入HRP標記的山羊抗兔IgG(1∶5 000)室溫孵育1 h,DAB顯色;③雙向電泳:將150 μg總蛋白與重水化液混合,總體積250 μl吸入IPG膠槽,置于IPGphor等電聚焦儀電極板上,重水化和等電聚焦在20℃自動進行,總電壓時間積40 000 V·h。等電聚焦后于平衡液中平衡2次;SDS-PAGE在SE600電泳儀中進行。Western印跡過程同②,不同之處在于顯色采用化學發光法。實驗重復3次。
5.統計學分析:應用SPSS 13.0統計軟件進行統計學處理,所有數據均采用±s表示,兩樣本均數比較采用t檢驗,P<0.05認為差異有統計學意義。
結果
一、雙向電泳和質譜鑒定結果
本研究建立了重復性較好、分辨率較高的雙向凝膠電泳考馬斯亮藍染色圖譜(圖1)。在凝集生長和非凝集生長的DPC胞質總蛋白中分別檢測到(608±39)個和(595±31)個蛋白點,各點清晰獨立。我們選擇凝集生長DPC特異表達的20個蛋白點進行鑒定;通過基質輔助激光解吸/電離飛行時間(MALDI-TOF)質譜儀,15個蛋白點獲得較好的PMF圖譜,經Mascot軟件和NCBInr數據庫檢索,與15種蛋白質相匹配,相對分子質量36 631,序列覆蓋51%。

圖1 毛乳頭細胞(DPC)的雙向電泳模式 1A:凝集生長毛乳頭細胞;1B:非凝集生長毛乳頭細胞。二者大多匹配,差異點主要集中在相對低分子質量蛋白質,在此區域凝集生長毛乳頭細胞的蛋白點數高于非凝集生長毛乳頭細胞
二、RT-PCR結果
為了驗證雙向電泳的研究結果,本研究通過RT-PCR技術在mRNA水平驗證膜聯蛋白A2的表達特點。凝集生長和非凝集生長DPC總RNA反轉錄為cDNA,以β肌動蛋白作為內參照,分別擴增凝集生長和非凝集生長條件下DPC中膜聯蛋白A2的表達特點,電泳結果經Quatity one軟件分析,可見膜聯蛋白A2在DPC凝集和非凝集狀態下的PCR產物差異有統計學意義(圖2,0.50±0.15比0.35±0.19,t=8.26,P<0.05)。
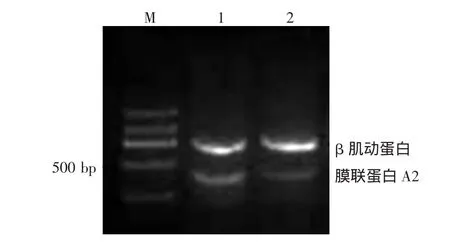
圖2 凝集和非凝集生長毛乳頭細胞(DPC)中膜聯蛋白A2的反轉錄PCR結果 M:標準參照物;1:凝集生長DPC;2:非凝集生長DPC
三、Western印跡結果
1.常規SDS-PAGE電泳:見圖3。凝集生長的DPC總蛋白常規SDS-PAGE后有2條反應條帶(條帶1和2),而非凝集生長的DPC則僅有1條反應條帶(條帶1)。條帶1對應相對分子質量約40 000,而條帶2對應相對分子質量約36 000。

圖3 毛乳頭細胞(DPC)常規電泳的Western印跡結果 M:標準參照物;1:凝集生長DPC;2:非凝集生長DPC
2.雙向電泳:為排除假陽性結果,將毛乳頭細胞總蛋白進行雙向電泳分離并進行免疫印跡檢測,結果(圖4)發現凝集生長的DPC出現2個蛋白點(蛋白點1和2),而非凝集生長的DPC則出現1個蛋白點(蛋白點1),蛋白點1是二者共有蛋白點,與常規電泳結果一致。

圖4 毛乳頭細胞(DPC)雙向電泳的Western印跡結果 4A:凝集生長DPC(蛋白點A和B);4B:非凝集生長DPC(蛋白點A)
討論
膜聯蛋白屬于保守的鈣離子調節磷脂結合蛋白家族,annexin蛋白有2個主要的結構域,即核心結構域和相互作用結構域。人類表達12種annexin,其中膜聯蛋白A2是研究最廣泛的,尤其是在哺乳動物生物學和人類疾病方面[5]。相對分子質量為36 000的膜聯蛋白A2蛋白可產生于內皮細胞、單核細胞、巨噬細胞、樹突細胞、上皮細胞和腫瘤細胞等。人類膜聯蛋白A2是ANXA2基因產物,該基因位于15號染色體(15q21)。
膜聯蛋白A2是一種多功能蛋白質,參與一系列生物學進程,在細胞外分泌、細胞內吞、離子通道導電和鏈接細胞骨架到細胞膜中發揮重要作用[6]。目前的研究主要涉及膜聯蛋白A2與腫瘤的相關性,大量證據顯示,膜聯蛋白A2蛋白在人類很多腫瘤都有高表達,如肺癌[7]。Meta分析顯示,膜聯蛋白A2的過表達可能與惡性腫瘤患者較差的預后有關[8],可能是膜聯蛋白A2在細胞核聚集破壞了著絲點功能,從而導致染色體不穩定,而染色體不穩定與腫瘤發生有關[9]。但膜聯蛋白A2在DPC和毛囊周期調控中的作用尚未見報道,該蛋白在DPC凝集生長中發揮何種作用值得探討。
為了追蹤膜聯蛋白A2在相關領域的研究進展,我們以DPC為特化的成纖維細胞為切入點進行檢索,研究發現膜聯蛋白A2基因在瘢痕疙瘩成纖維細胞高表達[10]。也有結果相反的報道,Kim等[11]發現膜聯蛋白A2在瘢痕疙瘩組織中表達下調,提示膜聯蛋白A2可能通過抑制瘢痕疙瘩成纖維細胞的增殖而參與瘢痕形成。在本研究中,我們發現膜聯蛋白A2存在分子質量不同的2種異構體,膜聯蛋白A2異構體(相對分子質量40 000)在凝集與非凝集生長的DPC均高表達,而經典的膜聯蛋白A2蛋白(相對分子質量36 000)在凝集生長的DPC表達,在非凝集生長的DPC則不表達,表明膜聯蛋白A2可能在DPC的凝集生長中發揮重要作用,但其作用機制尚不明確。
[1]Woo WM,Atwood SX,Zhen HH,et al.Rapid genetic analysis of epithelial-mesenchymal signaling during hair regeneration[J/OL].J Vis Exp,2013,28(72):e4344[2014-10-28].http://www.jove.com/ pdf/4344/jove-protocol-4344-rapid-genetic-analysis-epithelialmesenchymal-signaling-during-hair.
[2]McElwee K,Hoffmann R.Growth factors in early hair follicle morphogenesis[J].Eur J Dermatol,2000,10(5):341-350.
[3]Rushan X,Fei H,Zhirong M,et al.Identification of proteins involved in aggregation ofhuman dermalpapillacellsby proteomics[J].J Dermatol Sci,2007,48(3):189-197.
[4]夏汝山,顧靜,陶詩沁,等.凝集生長毛乳頭細胞分泌性蛋白組的初步分析[J].中華皮膚科雜志,2014,47(10):699-702.
[5]Hedhli N,Falcone DJ,Huang B,et al.The annexin A2/S100A10 system in health and disease:emerging paradigms[J/OL].J Biomed Biotechnol,2012,2012:406273[2014-060-30].http://www.ncbi. nlm.nih.gov/pmc/articles/PMC3496855/
[6]Bharadwaj A,Bydoun M,Holloway R,et al.Annexin A2 heterotetramer:structure and function[J].Int J Mol Sci,2013,14(3): 6259-6305.
[7]Yang J,Yang F,Nie J,et al.Evaluation of Annexin A2 as a novel diagnostic serum biomarker for lung cancer[J].Cancer Biomark, 2015,15(2):211-217.
[8]Liu X,Ma D,Jing X,et al.Overexpression of ANXA2 predicts adverse outcomes of patients with malignant tumors:a systematic review and meta-analysis[J].Med Oncol,2015,32(1):392.
[9]Kazami T,Nie H,Satoh M,et al.Nuclear accumulation of annexin A2 contributes to chromosomal instability by coilin-mediated centromere damage[J/OL].Oncogene,2014.doi:10.1038/onc. 2014.345[2014-11-26].http://www.researchgate.net/publication/ 267453466_Nuclear_accumulation_of_annexin_A2_is_involved_ in_chromosomal_instability_by_coilinmediated_centromere_damage.
[10]Satish L,Lyons-Weiler J,Hebda PA,et al.Gene expression patterns in isolated keloid fibroblasts[J].Wound Repair Regen, 2006,14(4):463-470.
[11]Kim SH,Jung SH,Chung H,et al.Annexin A2 participates in human skin keloid formation by inhibiting fibroblast proliferation[J].Arch Dermatol Res,2014,306(4):347-357.
Expression characteristics of annexin A2 in dermal papilla cells with aggregative behavior
Xia Rushan,Sun Hui, Tao Shiqin,Cao Lei,Yang Lijia.Department of Dermatology,Wuxi No.2 People′s Hospital,Wuxi 214002,Jiangsu,China Corresponding author:Yang Lijia,Email:yanglijia726@163.com
ObjectiveTo analyze the expression characteristics of annexin A2 in dermal papilla cells(DPCs)with aggregative behavior.MethodsReverse transcriptase-polymerase chain reaction(RT-PCR)and Western blot were performed to measure themRNA andprotein expressions of annexin A2 respectively in DPCs with or without aggregative behavior.ResultsThe mRNA expression level of annexin A2 was significantly higher in DPCs with aggregative behavior than in those without aggregative behavior(0.50±0.15 vs.0.35±0.19,t=8.26,P<0.05).Western blot showed that annexin A2 had two isoforms,including one isoform with a relative molecular mass of 40 000 and the other one with a relative molecular mass of 36 000.The annexin A2 isoform with a relative molecular mass of 40 000 was highly expressed in both DPCs with aggregative behavior and those without aggregative behavior,while the other isoform was only expressed in DPCs with aggregative behavior.ConclusionAnnexin A2 may be closely related to the aggregative growth of DPCs.
Hair follicle;Annexin A2;Cell growth processes;Reverse transcriptase polymerase chain reaction; Blotting,Western;Dermal papilla cells
10.3760/cma.j.issn.0412-4030.2015.10.013
南京醫科大學重點項目(NJMU233);無錫市衛生局面上項目(ML201202)
214002江蘇,無錫市第二人民醫院皮膚科
楊莉佳,Email:yanglijia726@163.com
2014-12-31)
(本文編輯:尚淑賢)

