STAT3和P16在人腦神經膠質瘤中的表達及臨床意義
邵冰水 毛沖沖 翟廣 劉獻志
(鄭州大學第一附屬醫院 神經外科 河南 鄭州 450052)
神經膠質瘤是中樞神經系統中最為常見的惡性腫瘤,約占顱內腫瘤的40% ~50%[1]。近年來,雖然神經外科的技術水平、放療設備和化療藥物等方面都有了長足發展,但由于神經膠質瘤具有侵襲性生長,與正常的腦組織相粘連、分解不清,對放、化療高度抵抗等特點,治療效果并不理想。信號轉導及轉錄激活因子3(signal transducer and activator of transcription3,STAT3)屬于胞漿蛋白家族,具有信號轉導、轉錄調控雙重功能[2]。P16 又叫做MTS(multiple tumor suppressor 1)基因,是一種抑癌基因,它可以調控細胞周期,負調節細胞的增殖及分裂。本實驗的目的是研究人腦神經膠質瘤中STAT3 和P16 表達情況,進行差異性及相關性統計分析,進而探討二者在人腦神經膠質瘤中的表達和相互關系,為臨床的診斷和治療提供參考。
1 材料與方法
1.1 標本來源 收集2012年10月至2013年11月期間鄭州大學第一附屬醫院75 例膠質瘤患者術中切除的膠質瘤組織和臨床資料,根據病理檢測結果,其中男性患者42 例,女性患者33 例,年齡在14 ~72 歲之間,平均年齡為(43.28 ±13.65)歲。其中年齡<43 歲患者45 例,年齡≥55 歲患者29 例。腫瘤直徑≤3 cm的患者13 例,直徑3 ~5 cm 的患者28 例,直徑>5 cm的患者33 例。按照WHO(2000年)膠質瘤病理分級標準,可分為Ⅰ級17 例,Ⅱ級20 例,Ⅲ級18 例,Ⅳ級20 例。將Ⅰ級、Ⅱ級歸為低級別組,Ⅲ級、Ⅳ級歸為高級別組。另外收集10 例該科室同時期因重度顱腦外傷行內減壓手術切除的腦組織作為正常腦組織(切片均經病理科醫師審定)。選取標準:所有患者無其他嚴重合并癥,均為首次行手術治療,術前均未行放療、化療等治療。相關影像學檢查均于手術前完善。所有標本在手術切除之后30 min 內放入液氮罐中,然后置于-80℃Thermol 低溫冰箱中進行保存。所取標本均通過本院倫理學委員會及患者家屬同意。
1.2 主要儀器與實驗試劑
1.2.1 主要儀器 圖像采集采用顯微數碼照像系統(德國Lecia);圖片分析系統及其他儀器由本院病理科提供。
1.2.2 實驗試劑 兔抗人STAT3 多克隆抗體及鼠抗人P16 單克隆抗體均購于武漢博士德公司;S-P9000試劑盒、DAB 顯示增強劑、PBS、蘇木素染液等均購于北京中杉金橋生物技術有限公司。
1.3 實驗方法 先用4%甲醛將組織標本固定1 h,石蠟包埋;用多聚賴氨酸對載玻片進行預防脫片處理;切片(厚約3 μm);采用S-P 免疫組化法對75 例人腦神經膠質瘤及10 例正常腦組織進行STAT3 及P16 蛋白的特異性檢測,操作步驟嚴格按照試劑盒說明書進行。流程如下:切片脫蠟、沖洗、烤片;冷卻后用蒸餾水、PBS 緩沖液反復沖洗;H2O250 μl 滴加在切片標本上,室溫下孵育15 min,再次沖洗;滴加1∶100 稀釋的一抗,陰性對照組用PBS 緩沖液代替一抗,將切片和保濕盒一同放入4℃恒溫箱過夜(約16 ~18 h);PBS緩沖液沖洗、復溫,再次沖洗;DAB 顯色;蘇木素復染;常規乙醇梯度脫水;封片(中性樹膠),觀察。
1.4 結果分析 雙人雙盲法觀察切片,將陽性著色細胞所占視野內細胞的百分比與細胞著色強度相結合計算(二級計分法)。具體標準如下:未著色為0 分,弱染色為1 分,中等染色為2 分,強染色為3 分。然后按著色陽性細胞占同類細胞數的百分比給予計分:1 分(0% ~5%),2 分(6% ~25%),3 分(26% ~50%)和4 分(>50%)。最終的結果為陽性細胞的百分率計分和染色強度計分的乘積產生的加權分數,即:0 分為陰性(-),1 ~4 分為弱陽性(+ ),5 ~8 分為陽性(+ +),9 ~12 分為強陽性(+ + +)。
1.5 統計學處理 所有實驗數據均采用SPSS 17.0統計學軟件進行分析。陽性表達情況的比較采用χ2檢驗與Spearman 秩相關法進行相關性分析,P <0.05為差異有統計學意義。
2 結果
2.1 STAT3 在正常腦組織和人腦神經膠質瘤中的表達 STAT3 蛋白表達的陽性信號主要位于胞漿中,少量位于胞核。在10 例正常腦組織標本中,STAT3 表達全陰性。在低級別人腦神經膠質瘤中,STAT3 的陽性表達率為37.84%(14/37),高級別組為71.05%(27/38);STAT3 在低級別組人腦神經膠質瘤中的表達水平明顯低于高級別組,差異具有統計學意義(P=0.008)。按照秩相關法對表達水平和病理級別進行分析,得出相關系數r=0.457,P=0.000。見圖1、2、3。

圖1 STAT3 在正常腦組織中的表達(SP×400)

圖2 STAT3 在低級別膠質瘤中的表達(SP×400)

圖3 STAT3 在高級別膠質瘤中的表達(SP×400)
2.2 P16 在正常腦組織和人腦神經膠質瘤中的表達P16 蛋白表達的陽性信號主要位于胞漿中,少量位于胞核中。在10 例正常腦組織中標本中,P16 表達全陽性。在低級別人腦神經膠質瘤中,P16 的陽性表達率為78.4%(29/37),高級別組為28.95%(11/38);P16 在低級別組人腦神經膠質瘤中的表達水平明顯高于高級別組,差異具有統計學意義(P=0.029)。按照秩相關法對表達水平和病理級別進行分析,得出相關系數r =0.457,P=0.003。見圖4、5、6。
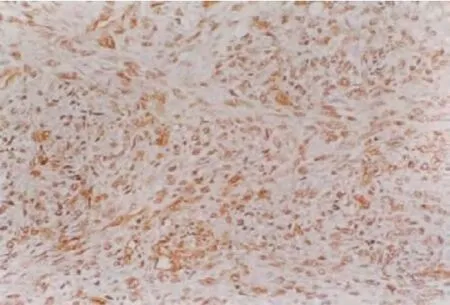
圖4 P16 在正常腦組織中的表達(SP×400)
圖5 P16 在低級別膠質瘤中的表達(SP×400)

圖6 P16 在高級別膠質瘤中的表達(SP×400)
2.3 STAT3 與P16 在人腦神經膠質瘤中表達的相關性 根據Spearman 等級相關性分析,STAT3 蛋白和P16 蛋白之間存在相關性,進一步分析可得:r=-1.000,P <0.05,STAT3 與P16 在人腦神經膠質瘤中的表達存在負相關。見表1。

表1 ARHI 蛋白與突變型P53 蛋白等級相關圖表
3 討論
信號轉導和轉錄激活因子(signal transducers and activators of transcription,STATs)屬于一類轉錄因子,是由酪氨酸蛋白激酶活化,介導細胞反應性和增生性信號的細胞質轉錄因子家族[3]。具有信號轉導與轉錄調控雙重功能。至今在哺乳動物體內細胞發現的STATs 主要成員有7 個,1994年作為白細胞介素-6信號轉導中的急性期反應因子,STAT3 被提取純化出來[4-5]。有研究表明,STAT3 可以通過JAK/STAT 途徑,掌控下游多種基因的轉錄激活[6],在調節細胞生長、分化以及凋亡等過程中發揮著重要影響。研究發現,與正常腦組織中的膠質細胞相比,STAT3 在惡性膠質瘤細胞中存在異常的活化,提示人腦膠質瘤的發生與STAT3 蛋白的異常活化可能存在一定的相關性。另外,有研究顯示[7],STAT3 的活化在神經干細胞的分化中發揮著重要作用,神經干細胞中抑制STAT3 蛋白的表達可以使干細胞向神經元的方向分化。從實驗結果可以看出,STAT3 在高級別的人腦神經膠質瘤中的表達水平明顯要高于低級別膠質瘤(P <0.05),由此可以得出結論,隨著人腦神經膠質瘤惡性程度的增加,STAT3 蛋白的表達水平也逐漸增高。
P16 基因,又叫做多腫瘤抑制基因(multiple tumor suppressor 1,MTS1),定位于人類9 號染色體9p21,對細胞的生長起著負性調節作用。由Kamb 等[8]在1994年首次報導在人腦膠質瘤細胞株當中存在P16 基因的丟失,隨后Carydis 等[9]又證實了P16 基因以及其表達的丟失常見于惡性程度比較高的原發性人腦神經膠質瘤中。從實驗結果可以看出,P16 在低級別組人腦神經膠質瘤中的表達水平明顯高于高級別組人腦神經膠質瘤(P <0.05),由此得出結論:隨著人腦神經膠質瘤病理級別以及惡性程度的增高,P16 的表達逐漸減弱。
根據實驗結果,STAT3 在人腦神經膠質瘤中的表達隨著病理級別的升高逐漸增強,P16 在人腦神經膠質瘤中隨著病理級別的升高,表達逐漸減弱。二者呈負相關性。通過大量查閱文獻發現,STAT3 對VEGF的表達具有調控作用,通過阻斷STAT3 信號轉導通路能導致VEGF 表達的下調,從而使惡性腫瘤血管形成的能力降低。
綜上所述,隨著STAT3 和P16 及其相關性研究的逐漸深入,二者可能成為判斷人腦膠質瘤惡性程度及預后的有效指標,然而當前STAT3 和P16 的協調作用和互相制約的相關機制及如何聯合靶點治療的機制尚待解決,但為聯合檢測、評估人腦膠質瘤的診療提供了新的途徑和思路。
[1]王俊杰,王剛,周章明,等.神經膠質瘤的治療研究進展[J].癌癥進展,2011,1(7):63-67.
[2]李少君,姚聲濤.STAT3 與腦膠質瘤[J].國際檢驗醫學雜志,2010,9(2):990-993.
[3]Johnson H M,Noon-Song E,Ahmed C M.Controlling nuclear jaks and stats for specific gene activation by Ifn γ and other cytokines:A possible steroid-like connection[J].J Clin Cell Immunol,2011,410(3):648-653.
[4]Liu C B,Wang R,Dong M W,et al.Expression of hepcidin at the choroid plexus in normal aging rats is associated with IL-6/Stat3 signaling pathway[J].Sheng Li Xue Bao,2014,66(6):639-646.
[5]Tadokoro T,Wang Y,Barak L S,et al.IL-6/STAT3 promotes regeneration of airway ciliated cells from basal stem cells[J].Proc Natl Acad Sci U S A,2014,111(35):E3641-E3649.
[6]Bonetto A,Aydogdu T,Jin X,et al.JAK/STAT3 pathway inhibition blocks skeletal muscle wasting downstream of IL-6 and in experimental cancer cachexia[J].Am J Physiol Endocrinol Metab,2012,303(3):E410-E421.
[7]成翔,金國華,張新化,等.STAT3 基因沉默促進大鼠海馬神經干細胞向神經元分化[A].中國解剖學會.中國解剖學會2013年年會論文文摘匯編[C].中國解剖學會,2013:1.
[8]Kamb A,Shattuck E D,Eeles R,et al.Analysis of the p16 gene(CDKN2)as a candidate for the chromosome 9p melanoma susceptibility locus[J].Nat Genet,1994,8(1):23-26.
[9]Carydis V B,Walker T,Wing A,et al.Utility of p16(ink4a)immunocytochemistry in liquid-based cytology specimens from women treated for high-grade squamous intraepithelial lesions[J].Acta Cytol,2007,51(4):517-522.

