新型脫細胞半月板細胞外基質的制備及其生物相容性的研究
郭維民,劉舒云,高鉞,黃靖香,彭江,汪愛媛,王玉,盧世璧,郭全義
·論著·
新型脫細胞半月板細胞外基質的制備及其生物相容性的研究
郭維民,劉舒云,高鉞,黃靖香,彭江,汪愛媛,王玉,盧世璧,郭全義
目的探索新型脫細胞半月板細胞外基質(dMECM)的制備方法,并對其細胞相容性進行研究。
細胞外基質;關節(jié)半月板;組織工程;生物相容性材料;脫細胞
半月板是一對位于膝關節(jié)的新月形纖維軟骨組織,具有負重傳遞、吸收震蕩、穩(wěn)定關節(jié)等重要功能[1]。由于其內側區(qū)域缺少血管及神經組織,一旦發(fā)生損傷后往往難以自愈[2]。半月板組織工程的發(fā)展為半月板損傷的治療提供了新的希望。一般來說,組織工程技術主要由種子細胞、組織工程支架、生物學和生物力學刺激三部分組成[3-4]。其中組織工程支架是非常重要的組成部分,所以選擇合適的半月板生物支架材料至關重要。采用脫細胞的方法去除細胞抗原和細胞核物質但保留組織的天然細胞外基質(extracellular matrix,ECM)成分和生物活性物質,可以提供細胞生長的天然微環(huán)境,并有利于種子細胞的黏附、增殖及分化。脫細胞技術已經廣泛用于不同的組織工程領域,包括血管、心臟瓣膜、軟骨和神經組織工程[5-7]。然而,半月板組織工程領域卻缺乏相關的研究。因此,本實驗目的是通過濕法粉碎、差速離心的方法制備新型的脫細胞半月板細胞外基質(decellularized meniscal extracellular matrix,dMECM)生物材料,并對其理化性能及生物相容性進行檢測。
1 材料與方法
1.1 實驗材料
1.1.1 材料及動物新鮮豬關節(jié)購自北京市屠宰場,共購取10個月豬齡的20個膝關節(jié)。2.5月齡的健康新西蘭白兔8只,雌雄不限,體重2.5 kg,由解放軍總醫(yī)院實驗動物中心提供。所有的動物實驗方案均經解放軍總醫(yī)院倫理委員會批準。
1.1.2 試劑DMEM培養(yǎng)基、0.2%的II型膠原酶、0.25%胰蛋白酶為美國Sigma公司產品;胎牛血清(FBS)購自美國Gibco公司;青霉素-鏈霉素-兩性霉素(三抗)購自碧云天生物技術公司;速新眠II號(戊巴比妥鈉注射液)購自北京軍事醫(yī)學科學院;氯胺酮注射液購自華北制藥集團有限責任公司;天狼猩紅、甲苯胺藍染料購自北京化學試劑公司。
1.1.3 儀器低溫高速離心機為美國Beckman公司產品;噴金鍍膜機為美國Denton Vacuum Desk-Ⅱ公司產品;BB5060型CO2培養(yǎng)箱為德國Heraeus公司產品;冰凍切片機為日本Leica公司產品;BH-2型倒置顯微鏡鏡、IX 70型熒光顯微鏡、多功能顯微鏡均為日本Olympus公司產品;JSM-6700F型掃描電鏡為日本JEOL公司產品;細胞培養(yǎng)板、培養(yǎng)瓶、離心管、載玻片為美國Corning costar公司產品。
1.2 方法
1.2.1 dMECM及其修飾蓋玻片的制備在無菌條件下將豬關節(jié)腔切開,切取半月板組織(圖1A),并將其切成1 mm×1 mm×1 mm的薄片(圖1B),裝入無菌的容器內,雙氧水漂洗3次,每次5 min。將雙氧水吸除,然后無菌PBS溶液再漂洗3次,每次5 min。用勻漿機將漂洗后的半月板制成懸浮液的漿料(圖1C)。低溫高速離心機1500 r/min離心5 min,分離大顆粒的懸浮微粒;取上清液分別以2000 r/min離心15 min;取上清液以6000 r/min離心20 min;10 000 r/min離心30 min,收集沉淀。再次加入PBS緩沖液混勻沉淀,以10 000 r/min離心洗滌3次,制備成3%(重量/體積)dMECM混懸液(圖1D),于4℃保存。將dMECM制備成1 mg/ml的混懸液,無菌蓋玻片(2 cm×2 cm)置于六孔板底部。按1 ml/孔包被六孔板,對照組加入1 ml無菌三蒸水,在室溫下風干。所有步驟均在無菌條件下操作。
1.2.2 dMECM光鏡觀察取1000 μl dMECM,加無菌三蒸水稀釋20倍,混勻后滴取少量混懸液于載玻片上,置于光學顯微鏡下觀察。
1.2.3 半月板組織、勻漿沉淀、dMECM組織化學染色觀察
切片準備:用冰凍切片的方法將新鮮的豬半月板、1500和6000 r/min勻漿沉淀、dMECM切成5 μm厚的薄片,丙酮固定30 min,室溫下晾干,PBS漂洗。
HE染色:將半月板切片行蘇木素染色5 min,流水沖洗,過1%鹽酸乙醇,稍水洗,0.5%伊紅液染色3 min,蒸餾水稍水洗,逐級酒精脫水,二甲苯透明,樹脂封片,光鏡下觀察。
天狼猩紅染色:將半月板切片及dMECM薄片行0.1%苦味酸天狼猩紅溶液染色30 min,蒸餾水漂洗,逐級酒精脫水,二甲苯透明,樹脂封片,偏振光顯微鏡下觀察。
甲苯胺藍染色:將半月板切片及dMECM薄片行1%甲苯胺藍醋酸水溶液染色5 min,蒸餾水漂洗,逐級酒精脫水,二甲苯透明,樹脂封片,光鏡下觀察。
Hoechst 33258染色:將半月板切片、1500和6000 r/min勻漿沉淀、dMECM薄片滴加Hoechst 33258染色液,置于黑暗處10 min,吸除染液,PBS漂洗3次,每次5 min,熒光顯微鏡下觀察。
1.2.4 內側半月板細胞分離培養(yǎng)及傳代取新西蘭大白兔,術前稱重,按照氯胺酮與速眠新II號1∶1(V/V)比例肌肉注射(0.5 ml/kg)麻醉。將動物仰臥位固定于手術臺上,膝關節(jié)屈曲90°并消毒鋪巾。無菌條件下顯露膝關節(jié),沿半月板關節(jié)囊外緣切取半月板組織,放入無菌培養(yǎng)皿內,并迅速將培養(yǎng)皿置于超凈工作臺內,切取半月板內側2/3區(qū)域半月板組織。用無菌PBS液清洗內側區(qū)域半月板3次;洗凈后,吸除多余PBS,將半月板組織置于無菌玻璃瓶內,用無菌眼科剪剪成1 mm× 1 mm×1 mm碎塊,再加入10倍于體積的0.2% II型膠原酶,置于37℃、5%CO2培養(yǎng)箱內借助磁力攪拌器作用消化30~60 min,至消化液變渾濁,組織碎塊消失;將含10%FBS的DMEM培養(yǎng)液終止消化,將0.75×106個/ml原代細胞于75 cm2的培養(yǎng)瓶內培養(yǎng)。顯微鏡下觀察細胞生長情況,待細胞生長至80%~90%融合時,用0.25%的胰酶消化傳代。取P3代細胞用于實驗。
1.2.5 兔半月板細胞與dMECM修飾蓋玻片的復合將P3代的兔半月板細胞胰酶消化,Hanks'液充分洗滌,制備成3×104個/ml細胞的懸液,接種于含dMECM修飾蓋玻片的六孔板及對照組六孔板內,1 ml/孔。將六孔板置于37℃、5%CO2培養(yǎng)箱孵育30 min,確保細胞黏附。然后每孔添加2 ml含10%FBS的DMEM培養(yǎng)液,繼續(xù)37℃、5%CO2培養(yǎng)箱培養(yǎng)。
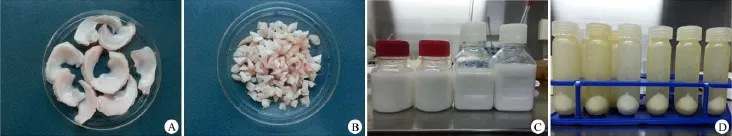
圖1 dMECM的制備(A:豬半月板;B:半月板碎片;C:半月板勻漿;D:dMECM)Figure 1Preparation of dMECM(A:Porcine meniscus;B:Meniscal fragments;C:Meniscal suspension;D:dMECM)
1.2.6 掃描電鏡觀察將體外培養(yǎng)7 d的半月板細胞/蓋玻片復合物取材(每組隨機選取5個樣本),無菌PBS(pH 7.4)緩沖液充分洗滌,置于2.5%戊二醛4℃下固定24 h,1%鋨酸4℃下固定4 h,梯度酒精脫水,醋酸異戊酯處理15 min,冷凍干燥,鍍膜,噴金,粘托,掃描電鏡下觀察。
2 結果
2.1 dMECM光鏡觀察
dMECM混懸液在光學顯微鏡下,可見呈細絲狀的膠原微絲結構(圖2)。
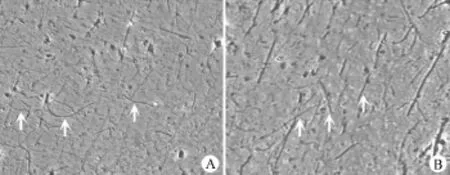
圖2 dMECM混懸液光鏡觀察,白色箭頭所指為膠原細絲結構(A:低倍鏡下;B:高倍鏡下)Figure 2dMECM suspension observed by light microscope,thecollagenfilamentstructure(whitearrow)(A:Low magnification;B:High magnification)
2.2 半月板與dMECM組織化學成分比較
豬半月板(外側區(qū)域)HE染色(圖3)可見細胞呈圓形或橢圓形,細胞外基質含量豐富,細胞包裹其中。半月板天狼猩紅染色(圖4A),在偏光顯微鏡下進行觀察,可見緊密排列,顯示很強雙折光性,呈黃色或紅色的I型膠原纖維;顯示弱的雙折光性,呈多種色彩的疏松網狀分布的II型膠原纖維;同樣的,經過脫細胞后的dMECM(圖4B)也可見I、II膠原纖維染色。半月板甲苯胺藍染色(圖5A)可見強陽性染色,經過脫細胞后的dMECM甲苯胺藍染色(圖5B)也呈現(xiàn)強陽性染色。熒光顯微鏡下觀察,半月板Hoechst 33258染色(圖6A),可見熒光染色陽性的DNA(熒光亮點);經過離心后的1500、6000 r/min勻漿沉淀Hoechst 33258染色陽性(圖6B,6C),而且隨著轉數(shù)增加,沉淀內的DNA逐漸減少;最后,dMECM Hoechst 33258染色陰性(圖6D),未見明顯的細胞DNA物質殘留。
2.3 半月板細胞形態(tài)觀察
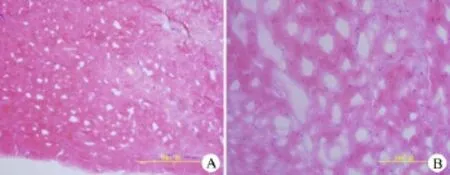
圖3 半月板切片HE染色(A:低倍鏡下;B:高倍鏡下)Figure 3HE staining of the meniscus(A:Low magnification;B:High magnification)

圖4 半月板(A)與dMECM(B)天狼猩紅染色Figure 4Picrosirius red staining of the native meniscus(A)and dMECM(B)
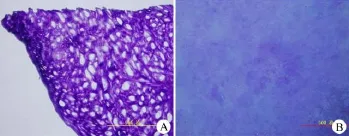
圖5 半月板(A)與dMECM(B)甲苯胺藍染色Figure 5Toluidine blue staining of the native meniscus(A)and dMECM(B)
內側區(qū)域的半月板經過II型膠原酶消化后,細胞于0.5~1.0 h后開始貼壁生長,6~8 h后可見大量細胞貼壁,多呈梭形或者多角形,細胞核為圓形或者橢圓形,位于細胞的中心,細胞漿含量豐富。原代細胞培養(yǎng)7 d左右,細胞達到80%~90%融合,此時細胞呈現(xiàn)圓形或者橢圓形,立體感強,折光性較好(圖7A)。原代細胞經過0.25%的胰酶消化后傳代培養(yǎng),可見傳代后的細胞生長速度明顯加快,細胞形態(tài)多發(fā)生改變,由圓形細胞為主轉變?yōu)殚L梭形細胞為主。傳到第3代時,可見細胞生長狀態(tài)良好,呈長梭形,分散均勻,生長增殖活躍(圖7B)。
2.4 掃描電鏡觀察
掃描電鏡結果顯示,半月板細胞/dMECM修飾蓋玻片復合物體外培養(yǎng)7 d后,對照組(圖8A)由于表面光滑,細胞胞體比較明顯;dMECM表面組細胞(圖8B)深陷于dMECM構建的三維結構內,細胞胞體不顯著,但是可見細胞黏附更加緊密,突起向平板四周展開,范圍更加廣泛,而且表面更為粗糙。

圖6 半月板、勻漿沉淀、dMECM Hoechst 33258染色(A:半月板;B:1500 r/min勻漿沉淀;C:6000 r/min勻漿沉淀;D:dMECM)Figure 6Hoechst 33258 staining of the native meniscus,suspension deposit and dMECM(A:Native meniscus;B:1500 r/min suspension deposit;C:6000 r/min suspension deposit;D:dMECM)
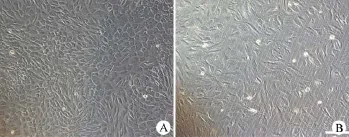
圖7 兔半月板纖維軟骨細胞倒置顯微鏡觀察(A:P0代細胞;B:P3代細胞)Figure 7Rabbit meniscal fibrochondrocytes images observed by inverted microscope(A:P0meniscal fibrochondrocytes images;B:P3meniscal fibrochondrocytes images)

圖8 體外培養(yǎng)7 d的半月板細胞/蓋玻片復合物掃描電鏡觀察(A:對照組;B:dMECM修飾蓋玻片組)Figure 8SEM images of the meniscal fibrochondrocytes/ growth surfaces constructs culturing in vitro 7 days(A:Control group;B:The dMECM growth surfaces group)
3 討論
近年來半月板損傷病例逐漸增多,而半月板損傷與骨關節(jié)炎的發(fā)生密切相關[8-10],如何早期修復半月板損傷,避免晚期骨關節(jié)炎的發(fā)生,給我們提出了巨大的挑戰(zhàn)。組織工程支架的制備是組織工程領域的關鍵因素,所以必須選擇優(yōu)良的支架材料。脫細胞技術興起于20世紀90年代,其主要目的是通過去除移植免疫源性物質,盡可能保留ECM成分及其生物活性物質[11]。ECM在調節(jié)細胞的黏附、增殖、生長、分化當中發(fā)揮著至關重要的作用,它構成了細胞外復雜的骨架結構,是細胞生長的天然微環(huán)境,在支持、連接細胞組織結構的同時,參與維持并調節(jié)細胞和組織的各項重要生理功能[12-14]。不可否定,采用脫細胞的方法制備的ECM生物材料可以很好地仿生細胞生長的天然微環(huán)境,促進種子細胞的生長、分化,利于構建更加成熟的組織工程半月板。
本實驗采用濕法粉碎和差速離心的方法,制備了新型的dMECM材料。利用不同的離心速度將粉碎后的ECM成分與DNA物質分離。經過離心的作用,粉碎比較徹底的膠原和其他ECM成分懸浮在上清液中,較大的膠原、大塊DNA以及包裹在基質內的DNA被分離在沉淀當中。隨著離心速度的不斷提高,ECM成分與DNA物質逐漸分離。差速離心的方法與常用的脫細胞方法比較,因其未添加任何化學和酶類物質,能夠避免其他雜質摻雜,極大地減小了細胞毒性,更大程度地保留天然ECM成分、多肽物質和細胞因子。
從半月板ECM組成成分的角度分析,構成半月板ECM的主要成分分別是膠原(75%)和糖胺聚糖(GAGs,17%)類物質。天狼猩紅、甲苯胺藍染色結果均證實dMECM具有和天然半月板相似的膠原及GAGs成分,因此在成分組成上為種子細胞提供了天然的仿生生長微環(huán)境。我們在未來的實驗中會深入探索dMECM和天然半月板內I型和II膠原定量成分的比較。另一方面,dMECM生物材料Hoechst 33258熒光染色的陰性結果證實了通過差速離心法制備的dMECM很好地去除細胞DNA物質,也就是去除了移植免疫源性物質,但是微量的DNA殘留情況還需要我們進一步研究。以上兩個方面說明,通過差速離心法制備的新型dMECM已經達到了脫細胞技術制備生物材料的目的。掃描電鏡結果顯示,體外培養(yǎng)的半月板細胞在dMECM修飾蓋玻片組黏附緊密,說明dMECM材料具有良好的生物相容性特征,這可能和dMECM材料內含有較多的膠原物質有關,相關研究顯示膠原物質有利于細胞與生物材料的黏附;另一方面,dMECM修飾蓋玻片組和對照組比較表面更為粗糙,說明dMECM材料可促進半月板細胞分泌更多的細胞外基質成分,進一步說明了dMECM材料可以促進細胞的生長和分化。
綜上所述,本實驗制備的新型dMECM材料可以很好地保留天然的半月板ECM成分,極大去除細胞DNA物質,且具有良好的生物相容性,是未來半月板組織工程領域非常有前景的支架材料。
[1]Messner K,Gao J.The menisci of the knee joint.Anatomical and functional characteristics,and a rationale for clinical treatment.J Anat,1998,193(Pt 2):161-178.
[2]Rubman MH,Noyes FR,Barber-Westin SD.Arthroscopic repair of meniscal tears that extend into the avascular zone.A review of 198 single and complex tears.Am J Sports Med,1998,26(1):87-95.
[3]Cima LG,Vacanti JP,Vacanti C,et al.Tissue engineering by cell transplantation using degradable polymer substrates.J Biomech Eng,1991,113(2):143-151.
[4]Langer R,Vacanti JP.Tissue engineering.Science,1993,260(5110):920-926.
[5]Chen RN,Ho HO,Tsai YT,et al.Process development of an acellular dermal matrix(ADM)for biomedical applications.Biomaterials,2004,25(13):2679-2686.
[6]Hudson TW,Liu SY,Schmidt CE.Engineering an improved acellular nerve graft via optimized chemical processing.Tissue Eng,2004,10(9-10):1346-1358.
[7]Yang Q,Peng J,Guo Q,et al.A cartilage ECM-derived 3-D porous acellular matrix scaffold for in vivo cartilage tissue engineering with PKH26-labeled chondrogenic bone marrow-derived mesenchymal stem cells.Biomaterials,2008,29(15):2378-2387.
[8]Englund M,Roos EM,Lohmander LS.Impact of type of meniscal tear on radiographic and symptomatic knee osteoarthritis:a sixteen-year followup of meniscectomy with matched controls.Arthritis Rheum,2003,48(2):2178-2187.
[9]Berthiaume MJ,Raynauld JP,Martel-Pelletier J,et al.Meniscal tear and extrusion are strongly associated with progression of symptomatic knee osteoarthritis as assessed by quantitative magnetic resonance imaging.Ann Rheum Dis,2005,64(4):556-563.
[10]Fautrel B,Hilliquin P,Rozenberg S,et al.Impact of osteoarthritis:results of a nationwide survey of 10,000 patients consulting for OA. J Joint Bone Spine,2005,72(3):235-240.
[11]Gilbert TW,Sellaro TL,Badylak SF.Decellularization of tissues and organs.Biomaterials,2006,27(19):3675-3683.
[12]Rosso F,Giordano A,Barbarisi M,et al.From cell-ECM interactions to tissue engineering.J Cell Physiol,2004,199(2):174-180.
[13]Daley WP,Peters SB,Larsen M.Extracellular matrix dynamics in development and regenerative medicine.J Cell Sci,2008,121(Pt 3):255-264.
[14]Rozario T,DeSimone DW.The extracellular matrix in development and morphogenesis:a dynamic view.Dev Biol,2010,341(1):126-140.
MethodsPorcine knee meniscus were collected immediately after slaughter,and cut into slices under aseptic condition.The novel dMECM was prepared by using waterproof pulverization and differential centrifugation approach.Picrosirius red and toluidine blue staining were carried out with the purpose of comparing the collagen and glycosaminoglycans(GAGs)content of native meniscus with dMECM.Hoechst 33258 staining was used to detect the presence of DNA debris in dMECM.The rabbit inner meniscal fibrochondrocytes(P3)were seeded in the dMECM modified coverslips,and then the cells/coated surface constructs were observed by scanning electron microscopy(SEM)to evaluate the biocompatibility after 7 d culture.
ResultsAs for the histological assessment,Picrosirius red and toluidine blue staining of dMECM were all positive and similar to native meniscus,but Hoechst 33258 staining was negative.SEM assessment showed that cells grown on the modified growth surface of dMECM adhered tightly and secreted numerous ECM.
ConclusiondMECM prepared in this experiment can well preserve meniscal ECM components,effectively remove the cellular DNA,and possess a good biocompatibility.It may be a promising candidate biomaterial for meniscal tissue engineering applications in advance.
The preparation of a new type of decellularized meniscal extracellular matrix and its biocompatibility
GUO Wei-min,LIU Shu-yun,GAO Yue,HUANG Jing-xiang,PENG Jiang,WANGAi-yuan,WANG Yu,LU Shi-bi,GUO Quan-yi
ObjectiveTo explore a novel approach to prepare the decellularized meniscal extracellular matrix(dMECM)and study its biocompatibility.
Extracellular matrix;Semilunar cartilages;Tissue engineering;Biocompatible materials;Decellularization AuthorAffiliation:Institute of Orthopaedics,Chinese PLAGeneral Hospital,Beijing 100853,China
GUO Quan-yi,Email:doctorguo_301@163.com
10.3969/cmba.j.issn.1673-713X.2015.01.003
國家自然科學基金(81472092);國家高技術研究發(fā)展計劃(863計劃)(2012AA020502)
100853北京,中國人民解放軍總醫(yī)院骨科研究所
郭全義,Email:doctorguo@163.com
2014-12-24
方法無菌條件下收集新鮮的豬半月板組織,切碎,采用濕法粉碎、差速離心的方法制備dMECM生物材料。通過天狼猩紅、甲苯胺藍染色方法分別比較天然半月板與dMECM中膠原以及糖胺聚糖含量的區(qū)別;采用Hoechst 33258熒光染色法觀察脫細胞后dMECM中DNA殘留情況。將P3代的兔內側半月板細胞種植在鋪有dMECM的蓋玻片上,體外培養(yǎng)7 d后行掃描電鏡檢測其細胞相容性。
結果本實驗制備的dMECM天狼猩紅、甲苯胺藍染色均呈陽性,并且與天然半月板染色類似;dMECM行Hoechst 33258染色呈陰性;掃描電鏡結果顯示種植于dMECM表面上的半月板細胞黏附緊密,可見大量細胞ECM的分泌。結論本實驗制備的dMECM可以很好地保留天然半月板ECM成分,有效地去除DNA物質,并且具有良好的生物相容性,是未來半月板組織工程領域非常有前景的支架材料。
www.cmbp.net.cn中國醫(yī)藥生物技術,2015,10(1):5-10
www.cmbp.net.cn Chin Med Biotechnol,2015,10(1):5-10

