下調G3BP對抑制腫瘤細胞遷移能力的研究
張浩,張彩霞,喻冬柯,邵榮光,何紅偉
·論著·
下調G3BP對抑制腫瘤細胞遷移能力的研究
張浩,張彩霞,喻冬柯,邵榮光,何紅偉
目的探討利用siRNA和靶向G3BP的多肽藥物下調G3BP后對多種腫瘤細胞遷移能力的影響。
方法采用人纖維肉瘤HT1080細胞、乳腺癌MCF-7細胞以及人非小細胞肺癌H1299細胞,應用siRNA特異性干擾G3BP后,通過劃痕實驗觀察其對腫瘤細胞遷移能力的影響;用多肽藥物GAP161作用于腫瘤細胞后,利用劃痕實驗以及Transwell遷移實驗觀察其對腫瘤細胞遷移能力的影響;在MCF-7細胞中高表達G3BP1,在MDA-MB-231細胞中用siRNA下調G3BP1后,采用人全基因芯片分析G3BP1高表達和低表達后的基因表達譜,并進行信號通路分析。
結果siRNA特異性下敲G3BP1和G3BP2后,HT1080、MCF-7和H1299細胞的遷移能力顯著降低。利用靶向G3BP的特異性多肽藥物GAP161作用于多種腫瘤細胞后,腫瘤細胞的遷移能力顯著下調。全基因組芯片分析表明:多個基因同時在G3BP1高表達和低表達組中發生變化,該變化與細胞遷移相關的細胞黏附、整合素、MAPK等信號通路有關。
結論G3BP下調后能夠顯著降低腫瘤細胞的遷移能力。靶向G3BP的多肽藥物具有顯著抑制腫瘤細胞遷移的作用。下調或者高表達G3BP后可通過下調或者上調多種與細胞黏附、整合素、MAPK等信號通路相關基因發揮作用。
細胞系,腫瘤;細胞遷移抑制;基因表達譜;MAP激酶信號系統;G3BP
腫瘤轉移是惡性腫瘤的重要生物學特征,大多數癌癥患者并非死于原發性癌而是死于轉移性癌。惡性腫瘤的發生與轉移是多因素、多基因相互協調作用的多階段過程,因此控制癌癥細胞的運動在腫瘤治療中非常重要。G3BP1是通過免疫共沉淀分離得到的第一個RasGAP SH3結構域結合蛋白,之后發現G3BP2也可與RasGAP相互作用,從而認為G3BP在Ras信號傳導途徑中起作用[1-3]。研究發現,G3BP在多種腫瘤中過表達,包括頭頸部癌、肺癌、結直腸癌和乳腺癌[4-5]。G3BP還參與腫瘤侵襲轉移相關基因的表達,Taniuchi等[6-7]發現G3BP能夠結合并且降解BART的mRNA,從而下調它的表達量。BART能夠抑制腫瘤細胞的轉移和侵襲。前期研究我們發現,下調G3BP能夠抑制HCT116細胞增殖并且引起細胞凋亡,還能夠抑制肺癌細胞的增殖和侵襲轉移能力[8-9]。本研究中我們采用特異性siRNA和靶向G3BP的多肽藥物GAP161作為工具,探討了G3BP對多種腫瘤細胞遷移能力的影響,進一步采用基因芯片的方法對瞬時下敲和高表達G3BP1的乳腺癌細胞進行全基因組表達譜分析,分析其對遷移相關基因以及信號傳導通路的影響,為G3BP作為一個腫瘤轉移標志物的研究提供基礎。
1 材料與方法
1.1 材料
1.1.1 細胞與細胞培養人纖維肉瘤HT1080細胞用含10%胎牛血清和雙抗(青霉素及鏈霉素各100 kU/L)RPMI 1640液培養于37℃、5%CO2培養箱中。人乳腺癌MCF-7和人非小細胞肺癌H1299細胞用含10%胎牛血清和雙抗(青霉素及鏈霉素各100 kU/L)DMEM液培養于37℃、5% CO2培養箱中。人乳腺癌MDA-MB-231細胞用含10%胎牛血清和雙抗(青霉素及鏈霉素各100 kU/L)L15液培養于37℃、5%CO2培養箱中。
1.1.2 實驗儀器5415型臺式離心機為德國Eppendorf公司產品;芯片雜交盒、芯片清洗盒、芯片雜交儀和LuxScan 10K/A雙通道激光掃描儀購自北京博奧生物有限公司;Transwell小室為美國Corning公司產品。
1.1.3 主要試劑DMEM、RPMI 1640、L15培養基購自美國Hyclone公司;新生胎牛血清購自美國Gibco公司;多肽藥物GAP161由武漢凱泰新生物技術有限公司合成提供,用生理鹽水配制成10 mmol/L貯存液,-80℃保存;質粒pcDNA3.1由本室保存;脂質體Lipofectamine2000和Lipofectamine RNAiMAX均購自美國Invitrogen公司;人類全基因組寡聚核苷酸芯片購自臺灣Phalanxiotech公司;芯片雜交試劑盒購自美國Genisphere公司。
1.2 方法
1.2.1 siRNA設計和合成由廣州銳博公司設計合成G3BP1和G3BP2的siRNA。靶向G3BP1的siRNA序列為5'GCAACAGUAUUUCGGUA UAdT dT-3',靶向G3BP2的siRNA序列為5'GU AAGAAAGUAGCCAUAAAdT dT-3'。對照mock siRNA序列是5'UUCUCCGAACGUGUCACGU dT dT-3'。將合成的siRNA粉末用緩沖溶液溶解,配成20 μmol/L的儲備溶液。
1.2.2 細胞轉染將對數生長期細胞用2 ml含10%胎牛血清的無抗生素組織培養液以30萬個/孔接種到六孔板中。將100 nmol/L siRNA或者2 μg pcDNA-G3BP1用無抗生素無血清的Opti-MEM培養液250 μl稀釋,取6 μl脂質體與250 μl無抗生素無血清的Opti-MEM培養液混勻,5 min之內將siRNA或pcDNA溶液與脂質體稀釋液輕輕混勻。siRNA或pcDNA與脂質體復合物于室溫靜置20 min后,把500 μl siRNA(pcDNA)-脂質體復合物加到細胞培養板中。細胞在給藥前用無抗生素無血清的Opti-MEM培養液洗1遍后,再加入新的500 μl無抗生素無血清Opti-MEM培養液。這樣,轉染后每孔溶液終體積為1000 μl。轉染5 h后,每孔中補加1000 μl含20%胎牛血清的無抗生素培養液。
1.2.3 劃痕愈合實驗將對數生長期的細胞消化、計數,每孔以3×105個/ml的細胞數接種于6孔板中,分別進行以下兩種方式處理:①當細胞生長24 h后,覆蓋度接近100%時,用10 μl Tip頭在單層細胞上劃痕,PBS沖洗后,在含有特定濃度多肽藥物的無血清培養基中繼續培養;②當細胞生長24 h后,進行siRNA轉染,繼續培養24 h,當覆蓋度接近100%時,用10 μl Tip頭在單層細胞上劃痕,PBS沖洗,在無血清培養基中繼續培養。每隔一段時間,于倒置顯微鏡下觀察傷痕合攏的情況,并照相。實驗重復3次。如下公式計算細胞遷移率:
遷移率(%)=(原劃痕寬度-現劃痕寬度)/原劃痕寬度×100%
1.2.4 Transwell遷移實驗在Transwell(8.0 μm)的上室中加入無血清培養基,于37℃培養箱中平衡過夜。取對數生長期的細胞,消化計數。用含無血清培養基洗滌細胞3次。用含無血清及不同濃度多肽藥物(或不同細胞)的培養基重懸細胞,使細胞密度為2×105個/ml,在Transwell的上室中加入100 μl細胞重懸液,2×104個/孔,下室加入600 μl的培養液(含20%血清),置培養箱中培養24~48 h。取出Transwell小室,棄培養液,用PBS輕柔洗滌3遍,甲醇固定10 min,PBS洗3遍。下室側表面的細胞為遷移穿透膜的細胞,蘇木素染色。顯微鏡下觀察,每張膜計數3~5個100倍視野,計算遷移細胞數。實驗重復3次,取平均值。
1.2.5 基因芯片雜交分析收集siRNA干擾48 h的MDA-MB-231細胞,以及轉染pcDNA-G3BP1 48 h的MCF-7細胞,用Trizol提取總RNA,純化后,將RNA逆轉錄并標記熒光基團,與人全基因組芯片進行雜交,基因芯片掃描儀進行掃描并分析得到全基因的表達數據。取表達差異大于1.5倍的基因進行代謝通路和信號傳導通路分析。
1.3 統計學處理
每次實驗至少重復3次,結果用平均值表示,兩組均數比較采用兩樣本Student's t檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1 下敲G3BP抑制腫瘤細胞遷移能力
之前我們的研究結果顯示,下敲G3BP后能夠抑制非小細胞肺癌H1299細胞的侵襲遷移能力[9]。此次,我們采用siRNA特異性下敲G3BP1和G3BP2 24 h后,通過劃痕實驗觀察其對HT1080、MCF-7和H1299細胞等腫瘤細胞遷移能力的影響(圖1)。結果顯示,用G3BP1-siRNA和G3BP2-siRNA處理后,HT1080細胞的遷移率降為32.39%和49.17%;MCF7細胞的遷移率降為12.08%和11.94%;H1299細胞的遷移率降為16.11%和34.29%。結果表明,下敲G3BP能夠顯著抑制腫瘤細胞的劃痕愈合能力,從而抑制腫瘤細胞的遷移能力。

圖1 下敲G3BP對腫瘤細胞HT1080(A)、MCF-7(B)和H1299(C)遷移能力的抑制作用(與對照組相比,*P<0.05)Figure 1Knockdown of G3BP inhibited the migration of tumor cell HT1080(A),MCF-7(B)and H1299(C)(*P<0.05 vs control)
2.2 靶向G3BP的多肽藥物GAP161抑制腫瘤細胞遷移
前期研究結果表明,多肽藥物GAP161靶向G3BP,處理細胞后能夠降低G3BP蛋白[8]。為了驗證siRNA的結果,我們用GAP161處理腫瘤細胞,觀察其對細胞遷移能力的影響。采用10、30 μmol/L GAP161處理細胞,細胞劃痕實驗結果表明GAP161能夠顯著抑制HT1080(31.82%和13%)(圖2)、MCF-7(33.75%和16.92%)(圖3)及H1299(15.83%和8.19%)(圖4)的遷移能力。進一步,采用Transwell實驗檢測GAP161對腫瘤細胞遷移能力的影響。結果顯示,GAP161處理后,能夠顯著抑制HT1080、MCF-7和H1299的遷移能力(圖2~4)。
2.3 瞬時高表達G3BP1后細胞轉移相關基因表達譜變化
為了進一步探討G3BP1發揮其生物學功能的分子機制,我們采用基因芯片的方法分析G3BP1表達的變化對細胞基因水平的影響。選擇侵襲轉移能力較低的MCF-7細胞檢測G3BP1對細胞內遷移相關基因的影響。結果顯示,G3BP1高表達后能夠誘導與細胞增殖、運動以及代謝有關的許多其他基因表達的變化。與對照組相比,G3BP1高表達后共1565個基因表達發生了改變(>1.5倍),其中有673個基因表達上調,892個基因表達下調。以Kyoto百科全書基因以及基因組(Kyoto encyclopedia of genes and geneomes,KEGG)對表達差異大于1.5倍的基因所參與的信號通路進行分析[10]。結果顯示,在這些上調的基因中,G3BP1高表達誘導了包括MAPK、黏附連接以及細胞骨架調節等細胞遷移相關基因的表達(表1)。
2.4 瞬時下敲G3BP1后細胞轉移相關基因表達譜變化

圖2 GAP161對HT1080細胞遷移能力的抑制作用(與對照組相比,*P<0.05)(A:劃痕實驗;B:Transwell實驗)Figure 2GAP161 inhibited HT1080 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
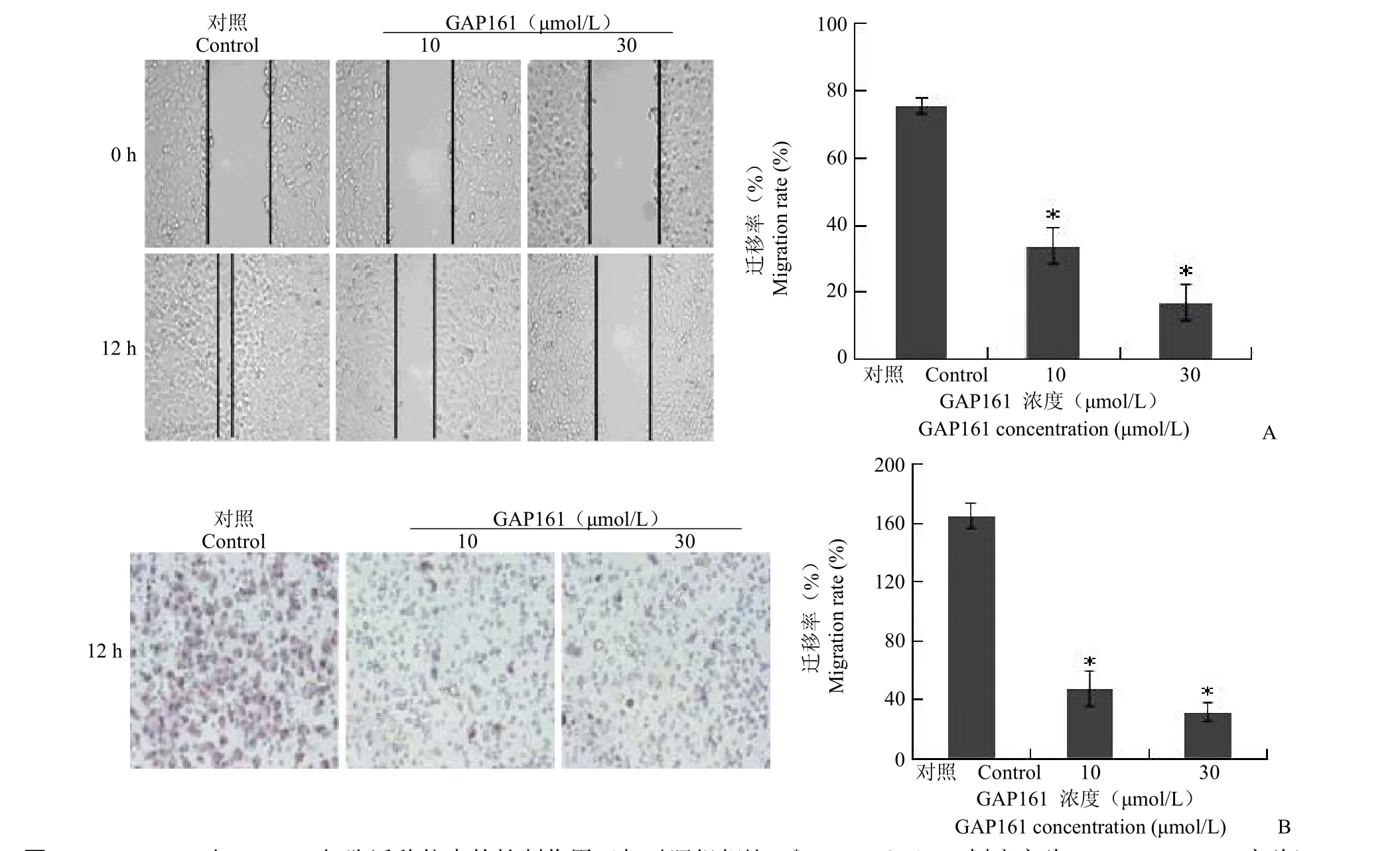
圖3 GAP161對MCF-7細胞遷移能力的抑制作用(與對照組相比,*P<0.05)(A:劃痕實驗;B:Transwell實驗)Figure 3GAP161 inhibited MCF-7 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
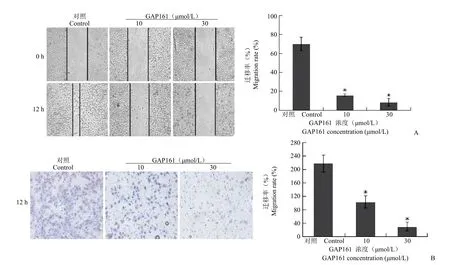
圖4 GAP161對H1299細胞遷移能力的抑制作用(與對照組相比,*P<0.05)(A:劃痕實驗;B:Transwell實驗)Figure 4GAP161 inhibited H1299 cell migration(*P<0.05 vs control)(A:Wound healing assay;B:Transwell assay)
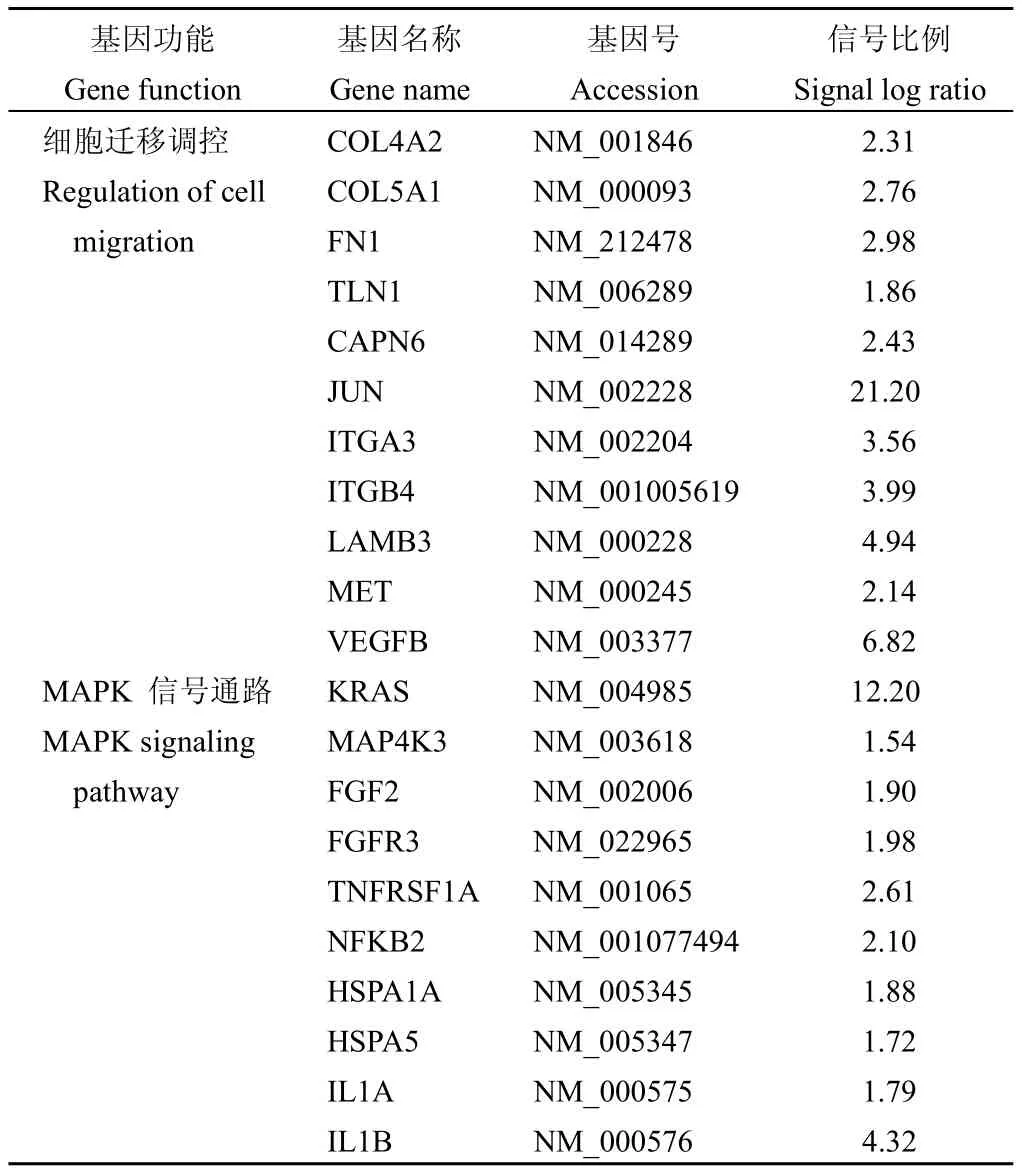
表1 MCF-7細胞中高表達G3BP1后上調的細胞遷移相關基因和信號通路Table 1Overexpression of G3BP1 upregulates migration associated genes and signaling pathways in MCF-7 cells
選擇侵襲轉移能力較高的MDA-MB-231細胞檢測G3BP1-siRNA對細胞基因表達的影響。通過G3BP1-siRNA處理組細胞與mock-siRNA處理組細胞之間基因表達差異的比較,顯示G3BP1-siRNA能夠降低細胞增殖、運動以及代謝有關的許多基因的表達。與mock-siRNA處理組相比,G3BP1-siRNA處理組細胞共940個基因表達發生了改變(>1.5倍),其中有195個基因表達上調,745個基因表達發生下調。KEGG信號通路分析表明,與高表達G3BP1對MCF-7細胞相關基因表達的影響相反,G3BP1-siRNA抑制了包括MAPK、黏附連接以及細胞骨架調節等細胞遷移相關基因的表達(表2)。
3 討論
癌癥細胞在侵襲以及惡化過程中,能夠通過自身的運動在組織中遷移。日前有研究人員發現,早期階段未侵入周邊組織的乳腺癌細胞已經含有高運動性的細胞,為腫瘤進行轉移擴散做好準備[11]。腫瘤細胞的運動包括許多過程,為許多信號分子所調控,如FAK調節的細胞與基質之間的黏附,MLCK以及Rho相關卷曲螺旋形成蛋白激酶(Rho/ROCK)等調控的肌球蛋白收縮等[12-13]。
我們前期研究證實,下調G3BP能夠抑制肺癌細胞的轉移侵襲能力[9]。為了探討G3BPs在其他多種腫瘤細胞遷移侵襲中的作用,采用siRNA特異性瞬時沉默腫瘤細胞中的G3BPs來觀察腫瘤細胞運動能力的變化。結果發現,下調G3BP后,多種腫瘤細胞包括HT1080、MCF-7和H1299的運動遷移能力都受到了抑制。GAP161是靶向G3BP的特異性多肽藥物,它能夠降低G3BP的表達。用GAP161處理腫瘤細胞后,HT1080、MCF-7和H1299細胞遷移能力顯著降低。
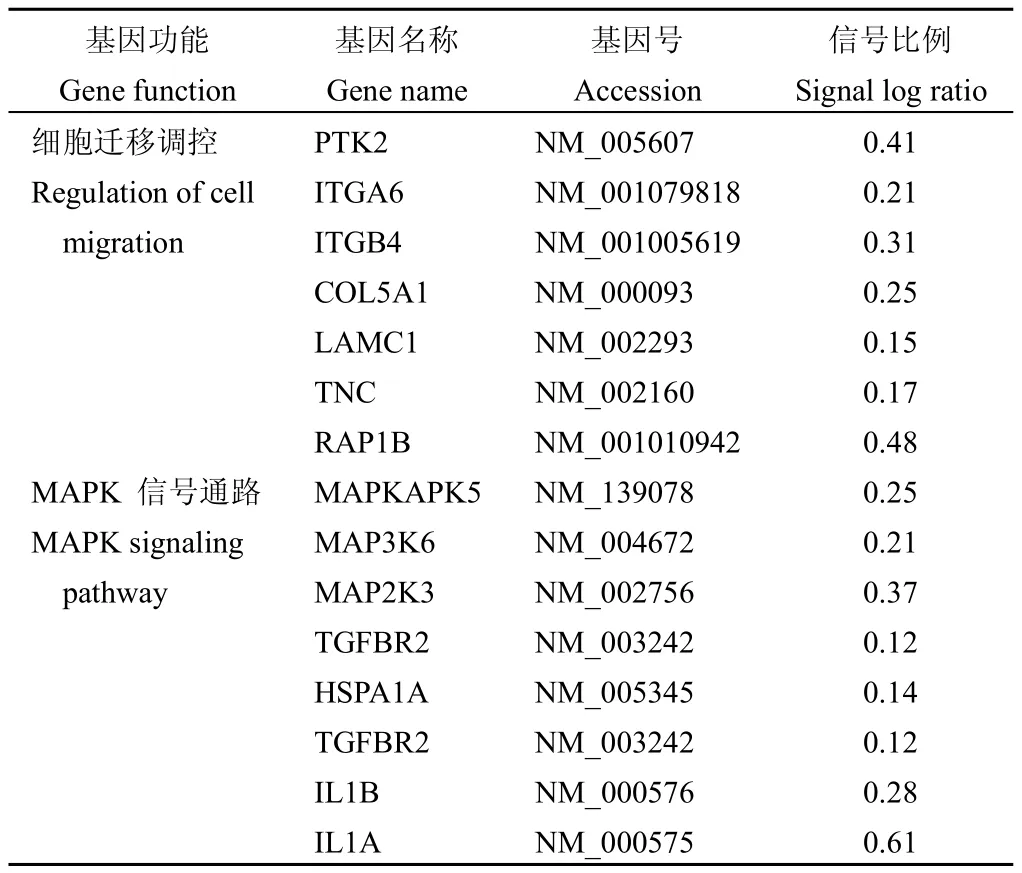
表2 MDA-MB-231中下敲G3BP1后抑制的細胞遷移相關基因和信號通路Table 2Knockdown of G3BP1 inhibits migration associated genes and signaling pathways in MDA-MB-231 cells
已有研究發現,G3BP參與了腫瘤侵襲轉移相關基因的表達[6-7]及細胞骨架的動態變化,而細胞骨架重構在腫瘤的侵襲轉移過程中有重要作用[14-15]。但缺乏G3BP如何參與腫瘤細胞的遷移侵襲的分子機制研究,也未見對全基因組水平的影響展開研究。我們在侵襲能力較低的乳腺癌MCF-7細胞中高表達G3BP1,并且在惡性程度較高、侵襲能力較強的MDA-MB-231細胞中下敲G3BP1,收集mRNA后分別進行基因芯片分析。結果表明,上調G3BP1后能夠引起腫瘤細胞MAPK、Wnt、TGF-β、細胞周期、細胞黏附連接以及細胞骨架調節等相關信號通路發生變化。其中,與轉移能力相關的細胞黏附、整合素和MAPK等信號通路和基因都發生上調。而對G3BP1下敲的MDA-MB-231細胞進行了全基因組分析后,結果顯示,下敲G3BP1后顯著下調了轉移相關的信號通路和基因,其影響的信號通路和基因與上調G3BP1后影響的信號通路相似。
綜上所述,沉默G3BP可降低腫瘤細胞遷移能力。因此,G3BP可以作為一個潛在的抗腫瘤轉移治療靶點和分子標志物。通過全基因組芯片分析,表明下敲G3BP可以影響腫瘤轉移侵襲相關信號通路和基因表達,并且為深入研究G3BP參與腫瘤侵襲轉移的分子機制提供基礎。
[1]Irvine K,Stirling R,Hume D,et al.Rasputin,more promiscuous than ever:a review of G3BP.Int J Dev Biol,2004,48(10):1065-1077.
[2]Parker F,Maurier F,Delumeau I,et al.A Ras-GTPase-activating protein SH3-domain-binding protein.Mol Cell Biol,1996,16(6):2561-2569.
[3]Zhang H,Shao RG.G3BP:a promising target for cancer therapy.Acta Pharm Sinica,2010,45(8):945-951.(in Chinese)張浩,邵榮光.G3BP:一個潛在的腫瘤治療靶點.藥學學報,2010,45(8):945-951.
[4]French J,Stirling R,Walsh M,et al.The expression of Ras-GTPase activating protein SH3 domain-binding proteins,G3BPs,in human breast cancers.Histochem J,2002,34(5):223-231.
[5]Guitard E,Parker F,Millon R,et al.G3BP is overexpressed in human tumors and promotes S phase entry.Cancer Lett,2001,162(2):213-221.
[6]Taniuchi K,Nishimori I,Hollingsworth MA.Intracellular CD24 inhibits cell invasion by posttranscriptional regulation of BART through interaction with G3BP.Cancer Res,2011,71(3):895-905.
[7]Taniuchi K,Nishimori I,Hollingsworth MA.The N-terminal domain of G3BP enhances cell motility and invasion by posttranscriptional regulation of BART.Mol Cancer Res,2011,9(7):856-866.
[8]Zhang H,Zhang S,He H,et al.GAP161 targets and downregulates G3BP to suppress cell growth and potentiate cisplaitin-mediated cytotoxicity to colon carcinoma HCT116 cells.Cancer Sci,2012,103(10):1848-1856.
[9]Zhang H,Zhang SH,He HW,et al.Downregulation of G3BPs inhibits the growth,migration and invasion of human lung carcinoma H1299 cells by suppressing the Src/FAK-associated signaling pathway. Cancer Gene Ther,2013,20(11):622-629.
[10]Ogata H,Goto S,Sato K,et al.KEGG:kyoto encyclopedia of genes and genomes.NucleicAcids Res,1999,27(1):29-34.
[11]Pearson GW,Hunter T.Real-time imaging reveals that noninvasive mammary epithelial acini can contain motile cells.J Cell Biol,2007,179(7):1555-1567.
[12]Sonoda Y,Matsumoto Y,Funakoshi M,et al.Anti-apoptotic role of focal adhesion kinase(FAK).Induction of inhibitor-of-apoptosis proteins and apoptosis suppression by the overexpression of FAK in a human leukemic cell line,HL-60.J Biol Chem,2000,275(21):16309-16315.
[13]Zhao JH,Reiske H,Guan JL.Regulation of the cell cycle by focal adhesion kinase.J Cell Biol,1998,143(7):1997-2008.
[14]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation. Cell,2011,144:646-674.
[15]Schmitz AA,Govek EE,B?ttner B,et al.Rho GTPases:signaling,migration,and invasion.Exp Cell Res,2000,261(1):1-12.
MethodsEffect of G3BP knockdown on tumor cell migration was examined by wound healing assay in HT1080,MCF-7 and H1299 cells.Effect of GAP161 on the migration of tumor cells was measured by wound healing assay and Transwell assay.Human whole genome oligonucleotide microarray was used to analyze the gene expression profiles in MCF-7 cells with G3BP1 over-expression and MDA-MB-231 cells with G3BP1 knockdown.Pathway analysis was then performed according to the microarray data.
ResultsDown-regulation of G3BP1 and G3BP2 by specific siRNAs significantly inhibited cell migration in HT1080,MCF-7 and H1299 cells.GAP161 also significantly reduced the tumor cell migration ability.Whole genome microarray analysis showed that over-expression of G3BP1 and knockdown G3BP1 in MCF-7 and MDA-MB-231 cells,respectively,affected cell adhesion,integrin and MAPK signaling pathways in an opposite manner.
ConclusionKnockdown of G3BP by siRNA significantly inhibited tumor cell migration.G3BP-targeted peptide G3BP1 markedly reduced the cell migration abilities.Over expression of G3BP1 could up-regulate genes expression associated with cell adhesion,integrin and MAPK signaling pathways,while down-regulation of G3BP1 exerts opposite effects.
Down-regulation of G3BPinhibits tumor cell migaration
ZHANG Hao,ZHANG Cai-xia,YU Dong-ke,SHAO Rong-guang,HE Hong-wei
ObjectiveTo investigate the effect of G3BP down-regulation by siRNA or G3BP-targeted peptide GAP161 on tumor cell migration.
Cell line,tumor;Cell migration inhibition;Gene expression profiling;MAP kinase signaling system;G3BP
HE Hong-wei,Email:hehwei@163.com
10.3969/cmba.j.issn.1673-713X.2015.01.004
國家自然科學基金(81302802);國家重點基礎研究發展計劃(973計劃)(2009CB521807);“重大新藥創制”國家科技重大專項(2012ZX09301-002)
100050北京,中國醫學科學院北京協和醫學院醫藥生物技術研究所腫瘤室
何紅偉,Email:hehwei@163.com
2014-06-03
www.cmbp.net.cn中國醫藥生物技術,2015,10(1):11-17
Author Affiliation:Department of Oncology,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences,Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(1):11-17

