胰高血糖素樣肽-1受體激動劑減輕小鼠體質量的作用機制研究
于倩,李春君,丁敏,邢云芝,于德民
胰高血糖素樣肽-1受體激動劑減輕小鼠體質量的作用機制研究
于倩,李春君,丁敏,邢云芝,于德民△
目的探討胰高血糖素樣多肽-1受體激動劑(GLP-1Ra)減輕小鼠體質量的作用機制。方法正常對照(N)組8只小鼠以普通飼料喂養,高脂飲食(HF)組32只以高脂飼料喂養,造模成功后的小鼠分為單純HF組(HF)組、處死前寒冷刺激(CS)組和200、400 μg/kg GLP-1 Ra干預[Lira(200)、Lira(400)]組,喂養8周。觀察各組小鼠的體質量、血糖及三酰苷油(TG)的水平變化。HE染色觀察小鼠不同部位白色脂肪(WAT)形態學改變;免疫組織熒光染色、Real-time PCR方法觀察利拉魯肽對棕色脂肪(BAT)特異因子UCP-1表達的影響;Western blot方法觀察UCP-1表達的調節因子PPAR-γ共激活因子1α(PGC-1α)表達的影響。結果Lira(200)組和Lira(400)組平均體質量低于HF組(P<0.05)。HF組較N組血糖和TG水平均升高,Lira(200)組和Lira(400)組血糖和TG水平較HF組降低(P<0.05)。Lira(200)組及Lira(400)組腎周與腹股溝皮下脂肪組織部分轉變為含有微小脂滴的棕色樣脂肪細胞,UCP-1蛋白和基因、PGC-1α蛋白表達水平較HF組均有不同程度的增加,Lira(400)組均強于Lira(200)組(P<0.05)。結論GLP-1Ra能明顯減輕小鼠體質量,其機制可能與增加UCP-1表達,促進白色脂肪發生棕色樣變有關。
糖尿病,2型;超重;疾病模型,動物;胰高血糖素樣多肽-1受體激動劑;胰高血糖素樣肽-1;解偶聯蛋白-1;棕色脂肪樣變;利拉魯肽
研究顯示,在世界范圍內肥胖和糖尿病的患病率逐年增加,2型糖尿病(T2DM)患者中有80%合并肥胖[1]。傳統降血糖藥物如磺脲類、噻唑烷二酮類(TZDs)及胰島素多存在可致體質量增加等不良反應。胰高血糖素樣肽(GLP)-1受體激動劑(GLP-1Ra)——利拉魯肽已經被證實在降血糖的同時,也能有效地減輕體質量[2-3]。筆者前期研究發現,加用利拉魯肽可使肥胖T2DM患者的體質量平均減少5.62 kg,腰圍平均減少5.7 cm[4],但其具體機制尚未明確。另有研究顯示,應用利拉魯肽治療4周的T2DM患者的24 h基礎代謝率明顯增加,體質量降低,能量消耗增加[5]。動物模型研究顯示,GLP-1干預能使小鼠棕色脂肪組織(BAT)產熱增加[6];給大鼠靜脈注射GLP-1可使其體溫增加0.3℃[7]。本研究旨在探討GLP-1Ra減輕小鼠體質量的作用機制,以期為臨床研究提供參考。
1 資料與方法
1.1 一般資料4周齡的清潔級雄性C57BL/6小鼠40只,體質量(19.07±1.30)g,購自北京華阜康生物科技股份有限公司。高脂飼料配方參考文獻[8],購自北京華阜康實驗動物有限責任公司。血糖試紙及血糖儀購自上海羅氏制藥有限公司。利拉魯肽購自諾和諾德中國制藥有限公司。微量注射器購自上海醫用制品有限公司。抗PPAR-γ共激活因子1α(PGC-1α)抗體購自美國Abcam公司。熒光素(FITC)標記的二抗購自美國Invitrogen公司。逆轉錄試劑盒及SYBR Green熒光定量PCR試劑盒分別購自美國Thermo和pro?mega公司。
1.2 方法
1.2.1 動物模型的建立及分組小鼠由專人飼養,室溫為20~22℃,濕度40%~70%,晝夜比12 h∶12 h。全部動物適應性喂養1周后,隨機分為正常對照(N)組8只和高脂飲食(HF)組32只。N組以普通飼料喂養,HF組以高脂飼料喂養,所有小鼠在造模期間均自由攝食和飲水,飼料和水每日更換1次,第10周末,高脂喂養組C57BL/6小鼠按體質量篩選肥胖小鼠。肥胖模型標準為:平均體質量大于同周齡N組平均體質量+1.96倍標準差且超過N組平均體質量的20%即為肥胖。本實驗成功誘導肥胖小鼠26只(81.25%),按照隨機數字表法分為單純HF組(HF)組,處死前4℃72 h寒冷刺激(CS)組,利拉魯肽200 μg/kg干預組[Lira(200)組]和400 μg/kg干預組[Lira(400)組]。重新分組后,HF組、CS組、Lira(200)組和Lira(400)組小鼠繼續以高脂飼料喂養8周。
1.2.2 血糖和血脂水平測定每周監測小鼠空腹體質量和血糖水平1次,方法為禁食12 h后尾尖取血,應用血糖儀測定,持續8周。在第8周末將小鼠麻醉取血,血標本3 000 r/ min離心5 min,取血清,應用全自動生化分析儀測定小鼠血漿中總三酰甘油(TG)水平。
1.2.3 組織標本采集于干預第8周末稱量體質量、測定血糖后,行內眥取血,頸椎脫臼法處死小鼠。血標本3500 r/min離心5 min,取血清,放入-80℃冰箱保存。再迅速解剖,分別留取肩胛間棕色脂肪組織、腹股溝皮下脂肪組織及腎周脂肪組織和附睪脂肪組織4處不同部位的脂肪組織,稱質量,每種脂肪組織再分為兩部分,其中一部分迅速放入液氮凍存,用于Real-time PCR、Western blot等檢測;另一部分固定于10%福爾馬林中,用于形態學及病理學觀察,并同時行免疫組織熒光檢測。
1.2.4 脂肪組織免疫熒光分析UCP-1的表達載玻片經純丙酮1∶150稀釋的多聚賴氨酸處理,切片厚度為4 μm。10%福爾馬林固定,二甲苯透明,5℃浸蠟30 min 2次,包埋組織塊;4 μm的組織切片附于經多聚賴氨酸附膜的載玻片上,60℃過夜;切片分別浸于二甲苯脫蠟,100%、95%、90%、85%、75%體積分數的乙醇脫水,枸櫞酸緩沖液抗原修復,微波自然冷卻;滴加5%山羊血清封閉液,滴加一抗UCP-1(1∶100),4℃過夜;滴加FITC熒光標記山羊抗兔IgG二抗(l∶20),37℃溫箱孵育1 h(避光),DAPI染液進行細胞核熒光染色,抗熒光衰減封片劑封片;(×100)顯微鏡下拍照。
1.2.5 Real-time PCR方法檢測mRNA表達水平(1)脂肪組織總RNA提取。用Trizol按步驟提取大鼠腎皮質總RNA,紫外分光光度計測定示樣品光密度(OD)260/OD280比值在1.8~2.0為純度較高,計算濃度,采用1%的瓊脂糖凝膠電泳鑒定RNA完整性。(2)cDNA的合成。以RNA為模板,oligo(dT)為引物,在逆轉錄酶MMLV的催化下合成cDNA。(3)引物合成。應用primer6.0軟件設計引物,用NCBI blast評價,再由上海生工合成。引物GAPDH:上游5′-TCAACAG?CAACTCCCAC-3′,下游5′-GGTCCAGGGTTTCTTACTC-3′,擴增產物150 bp;UCP-1:上游5′-ACTGCCACACCTCCAGT?CATT-3′,下游5′-CAAGGTAACGCCAGGAAT-3′,擴增產物200 bp。(4)Real-time PCR。SYBRGreenⅠ與雙鏈DNA結合后發出熒光,通過檢測反應體系中的SYBRGreenⅠ的熒光強度監測RCR產物的擴增量。反應體系包括12.5 μL SYBR Premix Ex Taq,上、下游引物各0.5 μL,cDNA模板2 μL,ddH2O 9.5 μL,總體系為25 μL。PCR擴增條件:95℃預變性30 s;95℃變性5 s,60℃退火且延伸30 s,共40個循環;最后生成熔解曲線。目的基因與內參基因擴增閾值的差值,即△CT值,根據公式2-ΔΔCt計算出樣品初始模板量進行分析。
1.2.6 Western blot檢測脂肪組織蛋白表達脂肪組織蛋白裂解,SDS-PAGE電泳,轉膜,免疫反應,化學發光、顯影,進行圖像分析。各部位脂肪組織稱質量,液氮、研缽粉碎組織塊,加入RIPA緩沖液(50 g組織加入1 μL RIPA),PMSF(10 mmol/L),利用Polytron進一步勻漿(15 000 r/min,共1 min)維持4℃,冰上孵育30min,移入離心管4℃,約20000g(15000 r/min)離心15 min,上清液為細胞裂解液后分裝,-20℃保存,進行Bradford比色法測定蛋白質濃度,取相同質量的細胞裂解液(體積×蛋白質濃度),并加等體積的2×電泳加樣緩沖液,沸水浴中5 min,上樣,電泳(濃縮膠20 mA,分離膠35 mA),電轉膜儀轉膜(100 mA 40 min),麗春紅染膜,考馬斯亮藍染膠,Western blot試劑盒顯色。
1.3 統計學方法采用SPSS 20.0統計軟件進行統計學處
2 結果
2.1 各組小鼠體質量的比較Lira(200)組和Lira(400)組平均體質量低于HF組(P<0.05)。Lira(200)組和Lira(400)組差異無統計學意義,見表1。
Tab.1Comparison of general indexes and biochemical parameters between five groups of mice表1 各組體質量、血糖及TG比較
Tab.1Comparison of general indexes and biochemical parameters between five groups of mice表1 各組體質量、血糖及TG比較
*P<0.05;a與N組比較,b與HF組比較,c與CS組比較,d與Lira(200)組比較,P<0.05
體質量(g)2 6 . 5 2 ± 3 . 3 2 3 3 . 6 7 ± 4 . 2 6a3 3 . 1 2 ± 3 . 8 7a2 9 . 7 4 ± 3 . 5 7abc2 8 . 2 5 ± 3 . 2 4abc8 . 5 3*組別N組H F組C S組L i r a(2 0 0)組L i r a(4 0 0)組F n 8 6 6 7 7血糖(m m o l / L)5 . 9 ± 1 . 0 2 1 0 . 5 ± 1 . 7 3a1 0 . 2 ± 1 . 5 6a7 . 5 6 ± 1 . 3 3abc6 . 8 8 ± 1 . 4 9abc6 4 . 5 0*T G(m m o l / L)1 . 0 2 ± 0 . 1 4 1 . 2 8 ± 0 . 1 3a1 . 2 2 ± 0 . 1 8a1 . 1 6 ± 0 . 1 8ab1 . 0 8 ± 0 . 1 6bcd8 . 1 0*
2.2 各組小鼠血糖和TG水平的比較HF組較N組血糖和TG水平均升高,Lira(200)組和Lira(400)組血糖和TG水平較HF組降低(P<0.05),CS組與HF組血糖和TG水平差異無統計學意義,見表1。
2.3 腎周脂肪組織形態學表現N組小鼠腎周白色脂肪細胞排列整齊,細胞內含一大脂滴,細胞核位于一側。HF組小鼠脂肪細胞數目增多,體積增大。CS組腎周脂肪細胞變小,大脂滴數目減少,多被小脂滴取代,出現了類似棕色脂肪的形態。Lira(200)組及Lira(400)組小鼠腎周脂肪細胞小而密,胞質內可見許多微小脂滴,利拉魯肽干預后使腎周白色脂肪組織出現了棕色樣脂肪細胞樣的形態學特征,見圖1。
2.4 腹股溝皮下脂肪組織形態學表現N組小鼠腹股溝皮下白色脂肪細胞排列整齊,細胞內含一大脂滴,細胞核位于一側。HF組小鼠脂肪細胞體積明顯增大。CS組小鼠皮下脂肪細胞體積變小,大脂滴內出現許多小脂滴,表現出類似棕色脂肪的形態。Lira(200)組及Lira(400)組小鼠皮下脂肪細胞體積較HF組減小,胞質內也出現小脂滴,利拉魯肽干預后使腹股溝皮下白色脂肪組織也出現了棕色樣脂肪細胞的形態學特征,見圖2。
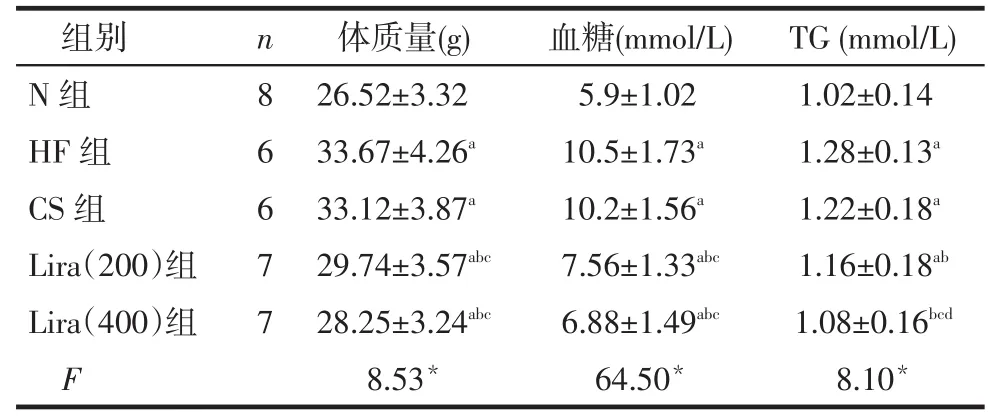
2.5 各組腎周及腹股溝皮下脂肪中UCP-1表達的免疫熒光檢測結果HF組腹股溝皮下脂肪中UCP-1陽性表達與N組差異無統計學意義外,HF組、CS組、Lira(200)組和Lira(400)組較N組腎周脂肪組織和腹股溝皮下脂肪組織中UCP-1蛋白熒光顯色均增加;與HF組比較,CS組、Lira(200)和Lira(400)組的兩部位脂肪中UCP-1陽性表達均明顯增加,其中CS組最為明顯,Lira(400)強于Lira(200)組(P<0.05),見圖3,表2。
Tab.2Results of UCP1 detected by immunohistochemistry in peri-renal WAT and inguinal subcutaneous WAT表2 各組腎周和腹股溝皮下脂肪UCP-1免疫熒光結果(IOD值,)

Tab.2Results of UCP1 detected by immunohistochemistry in peri-renal WAT and inguinal subcutaneous WAT表2 各組腎周和腹股溝皮下脂肪UCP-1免疫熒光結果(IOD值,)
*P<0.05;a與N組比較,b與HF組比較,c與CS組比較,d與Lira(200)組比較,P<0.05
組別N組H F組C S組L i r a(2 0 0)組L i r a(4 0 0)組F n 8 6 6 7 7腎周(× 1 03)1 2 . 8 5 ± 2 . 9 9 2 4 . 7 3 ± 5 . 4 6a6 4 . 7 5 ± 7 . 5 4ab4 2 . 2 3 ± 5 . 8 6abc4 8 . 2 8 ± 7 . 5 3abcd7 . 9 1*腹股溝(× 1 03)1 6 . 6 4 ± 3 . 2 8 1 9 . 5 8 ± 3 . 9 5 5 8 . 5 2 ± 7 . 9 1ab3 2 . 2 6 ± 5 . 1 5abc4 5 . 7 9 ± 5 . 9 2abcd1 2 . 6 3*
2.6 各組腎周及腹股溝皮下脂肪中UCP-1 mRNA表達水平比較HF組腹股溝皮下脂肪中UCP-1mRNA表達與N組差異無統計學意義外,HF組、CS組、Lira(200)組和Lira(400)組較N組腎周脂肪組織和腹股溝皮下脂肪組織中UCP-1mRNA表達均增加;與HF組比較,CS組、Lira(200)和Lira(400)組的兩部位脂肪中UCP-1mRNA表達均明顯增加,其中CS組最為明顯,Lira(400)強于Lira(200)組(P<0.01),見圖4。
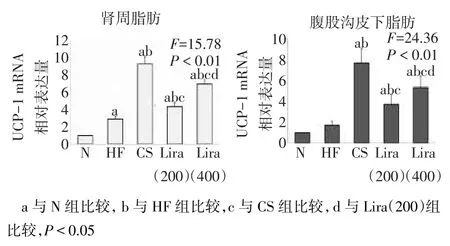
Fig.4The expression of UCP1 mRNA in peri-renal WAT and inguinal subcutaneous WAT圖4 各干預組小鼠腎周和皮下脂肪中UCP-1 mRNA表達
2.7 GLP-1Ra對PGC-1α表達的影響HF組腹股溝皮下脂肪中PGC-1α表達水平與N組差異無統計學意義外,HF組、CS組、Lira(200)組和Lira(400)組較N組在兩部位均增高(P<0.05);與HF組比較,CS組、Lira(200)和Lira(400)組的兩部位脂肪中PGC-1α表達均明顯增加,其中CS組最為明顯,Lira(400)組較Lira(200)組表達水平升高更為明顯(P<0.05),見圖5。
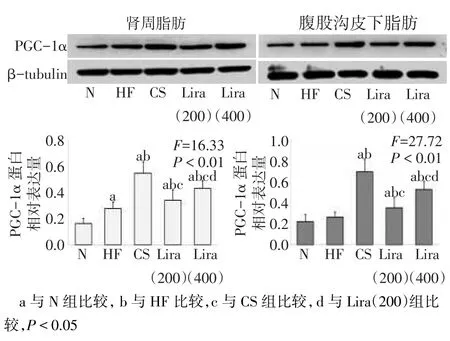
Fig.5The expression of PGC-1a protein in peri-renal WAT and inguinal subcutaneous WAT圖5 各組小鼠腎周及腹股溝皮下脂肪中PGC-1α蛋白表達水平
3 討論
GLP-1及其受體激動劑都具有葡萄糖依賴的促胰島素分泌和抑制胰高血糖素分泌的作用,能有效降低血糖,同時還具有延緩胃排空、增加飽腹感及抑制食欲的作用,因此,能兼顧降低體質量[9]。臨床研究證實,GLP-1能抑制健康受試者餐后血漿TG和游離脂肪酸(FFA)水平的增加[10],也可降低T2DM患者血漿極低密度脂蛋白(VLDL)和FFA水平[11]。本研究結果顯示,Lira(200)及Lira(400)組小鼠的體質量、血糖及TG水平明顯低于HF組,提示GLP-1Ra干預能引起血糖、體質量及TG水平明顯降低,而且隨著GLP-1Ra干預劑量的增加,其水平有進一步下降的趨勢。處死小鼠后對其各部位脂肪稱量亦發現,GLP-1Ra干預后,小鼠各部位脂肪組織均較HF組明顯減少,這也進一步證實了GLP-1Ra能有效控制血糖且兼顧減輕體質量,其中以減少脂肪組織含量更為顯著,同時還能改善血脂代謝紊亂。
脂肪組織主要分為棕色脂肪(BAT)、白色脂肪(WAT)以及在WAT中可能出現具有BAT形態及功能特征的米色脂肪[12-13]。WAT主要存在于皮下脂肪以及腹腔中的內臟,僅含少量線粒體,一般無線粒體UCP-1表達,主要作用為貯存脂肪,含量增多可引起超重、肥胖、胰島素抵抗及2型糖尿病;與之相反,BAT細胞富含線粒體,含大量在線粒體內膜特異表達的UCP-1。UCP-1是一種質子轉運蛋白,驅使質子從線粒體內膜漏出,進而改變電化學梯度,解偶聯ATP的同時增加其氧化磷酸化,從而將化學能轉化為熱能釋放,因此,其具有對抗低溫和寒冷,以及抵抗肥胖、抵抗糖尿病的天然作用[9]。本研究病理染色結果顯示,腎周及腹股溝皮下脂肪在寒冷刺激及GLP-1Ra干預后變化明顯,脂肪細胞明顯減少,脂滴增多,部分大脂滴轉變為微小脂滴,形態發生顯著改變。
本研究的分子生物學結果與病理染色結果趨勢相一致,Lira(200)組和Lira(400)組較HF組腎周脂肪組織及腹股溝皮下脂肪組織中UCP-1蛋白熒光顯色均增加。腎周脂肪及腹股溝皮下脂肪和睪周脂肪組織相同,均來源于白色脂肪組織,但能在寒冷刺激及GLP-1Ra的干預下出現棕色樣脂肪細胞的形態特征,而且免疫熒光組織化學檢測結果顯示這2組棕色脂肪特異標志蛋白UCP-1表達較N組和HF組均明顯升高,表明腎周及腹股溝皮下WAT可能具有BAT樣生物學作用的前體細胞,可在寒冷刺激及GLP-1Ra干預下出現棕色樣變,并增加BAT特異性蛋白UCP-1的表達水平。
目前尚未發現某種單一的具有組織特異性的調節因子能夠主導完整的BAT形成過程。但是隨著研究的深入,已發現一些轉錄調節因子對BAT細胞的形成起著關鍵作用。其中,PGC1-α作為一種轉錄共激活因子在BAT中高度表達,而且PGC1-α在WAT中表達時,能激活適應性產熱相關基因程序[1]。本研究發現,Lira(200)及Lira(400)組PGC-1α蛋白表達水平較mRNA升高更為明顯,且在腎周和腹股溝皮下WAT中,隨著GLP-1Ra干預劑量的增加,PGC-1α蛋白表達水平水平有進一步增加的趨勢,Li?ra(400)組比Lira(200)組升高更為顯,提示GLP-1Ra可能干預誘導了腹股溝皮下和腎周的WAT表達PGC-1α,進而促進了明顯的BAT樣改變。
綜上所述,GLP-1Ra引起體質量降低的可能機制為:PGC-1α的表達激活促進了UCP-1的表達上調,進而誘導白色脂肪發生棕色樣變,從而起到降低體質量的作用。
(圖1~3見插頁)
[1]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.doi:10.1001/ja?ma.2013.168118.
[2]Nauck M,Frid A,Hermansen K,et al.Efficacy and safety compari?son of liraglutide,glimepiride,and placebo,all in combination with metformin in type 2 diabetes[J].Diabetes Care,2009,32(1):84-90. doi:10.2337/dc08-1355.
[3]Garber A,Henry R,Ratner R,et al.LEAD-3(Mono)Study Group. Liraglutide versus glimepiride monotherapy for type 2 diabetes(LEAD-3 Mono):a randomised,52-week,phase III,double-blind,parallel-treatment trial[J].Lancet,2009,373(9662):473-481.doi: 10.1016/S0140-6736(08)61246-5.
[4]Li CJ,Li J,Zhang QM,et al.Efficacy and safety comparison be?
tween liraglutide as add-on therapy to insulin and insulin dose-in?crease in Chinese subjects with poorly controlled type 2 diabetes and abdominal obesity[J].Cardiovasc Diabetol,2012,11:142.doi: 10.1186/1475-2840-11-142.
[5]Horowitz M,Flint A,Jones KL,et al.Effect of the once-daily hu?man GLP-1 analogue liraglutide on appetite,energy intake,energy expenditure and gastric emptying in type 2 diabetes[J].Diabetes ResClinPract,2012,97(2):258-266.doi:10.1016/j.dia?bres.2012.02.016.
[6]Lockie SH,Heppner KM,Chaudhary N,et al.Direct control of brown adipose tissue thermogenesis by central nervous system glu?cagon-like peptide-1 receptor signaling[J].Diabetes,2012,61(11): 2753-2762.doi:10.2337/db11-1556.
[7]Osaka T,Endo M,Yamakawa M,et al.Energy expenditure by intra?venous administration of glucagon-like peptide-1 mediated by the lower brainstem and sympathoadrenal system[J].Peptides,2005,26(9):1623-1631.
[8]Bostr?m P,Jun Wu,Mark P,et al.A PGC1 α-dependent myokine that drives browning of white fat and thermogenesis[J].Nature,2012,481(7382):463-468.
[9]Holst JJ.The physiology of glucagon-like peptide 1[J].Physiol Rev, 2007,87(4):1409-1439.
[10]Meier JJ,Gethmann A,G?tze O,et al.Glucagon-like peptide 1 abolishes the postprandial rise in triglyceride concentrations and lowers levels of non-esterified fatty acids in humans[J].Diabetolo?gia,2006,49(3):452-458.
[11]Toft-Nielsen MB,Madsbad S,Holst JJ.Determinants of the effec?tiveness of glucagon-like peptide-1 in type 2 diabetes[J].J Clin En?docrinol Metab,2001,86(8):3853-3860.
[12]Walden TB,Hansen IR,Timmons JA,et al.Recruited vs.nonre?cruited molecular signatures of brown,"brite",and white adipose tissues[J].Am J Physiol Endocrinol Metab,2012,302(1):E19-31. doi:10.1152/ajpendo.00249.2011.
[13]Seale P,Conroe HM,Estall J,et al.Prdm16 determines the thermo?genic program of subcutaneous white adipose tissue in mice[J].J Clin Invest,2011,121(1):96-105.doi:10.1172/JCI44271.
[14]Tiraby C,Tavernier G,Lefort C,et al.Acquirement of brown fat cell features by human white adipocytes[J].J Biol Chem,2003,278(35): 33370-33376.
(2015-09-16收稿 2015-10-30修回)
(本文編輯 陸榮展)
Mechanism of glucagon-like peptide 1 receptor agonist induced weight loss of mice
YU Qian,LI Chunjun,DING Min,XING Yunzhi,YU Demin△
Metabolic Diseases Hospital&Tianjin Institute of Endocrinology,Tianjin Medical University/Ministry of Health Key Laboratory of Hormones and Development,Tianjin 300070,China△
ObjectiveTo investigate the possible mechanisms of glucagon-like peptide 1 receptor agonists(GLP-1Ra)induced weight loss.MethodsHigh fat diet induced obese c57BL/6 mice were divided into normal control group(N,n=8),high fat feeding group(HF,n=32)and GLP-1Ra group treated with GLP-1Ra(liraglutide 200 μg/(kg·d)or 400 μg/(kg·d)for 8 weeks).Changes of body weight,blood glucose and three acyl glycosides(TG)levels were observed in three groups.HE staining was used to observe the morphological changes.Immunofluorescence staining and real-time PCR were used to mea?sure the expression of UCP-1.Furthermore,the expression of PGC-1α in protein level was observed to explore the possible mechanism of GLP-1Ra induced browning in white fat(WAT).ResultsAfter 8-week liraglutide(Lira)administration,the body weights were significantly reduced in obese mice(P<0.05).The levels of blood glucose and TG were significantly high?er in HF group than those in N group,which reduced significantly in Lira(200 μg·kg-1)and Lira(400 μg·kg-1)administra?tion groups(P<0.05).HE staining showed adipocytes in perirenal and inguinal subcutaneous adipose tissue partly acquired brown-like morphological characteristics.The expression levels of UCP-1 protein and mRNA and PGC-1α protein were ele?vated in adipse tissues,which increased more in Lira(400)than those in Lira(200,P<0.05).ConclusionGLP-1Ra can induce weight loss through white fat browning by activation of UCP-1.
diabetes mellitus,type 2;overweight;disease models,animal;GLP-1Ra;glucagon-like peptide-1;uncou?pling protein-1;adipocyte browning;Liraglutide
R587.1
A
10.11958/j.issn.0253-9896.2015.11.003
國家青年科學基金項目(81300663/H0713);天津市衛生局科技基金(2013KZ098)
天津醫科大學代謝病醫院,衛生部激素與發育重點實驗室(郵編300070)
于倩(1986),博士,主要從事2型糖尿病發病機制研究
△通訊作者E-mail:yudemintij@126.com

