鮑曼不動桿菌外膜蛋白A的克隆表達及純化
魏常梅,王俊瑞,孫 鵬,張軍力
(1內蒙古醫(yī)科大學,內蒙古呼和浩特010110;2內蒙古醫(yī)科大學附屬醫(yī)院檢驗科,內蒙古呼和浩特010050;3內蒙古醫(yī)科大學病原生物學實驗室,內蒙古呼和浩特010059)
·基礎與轉化醫(yī)學·
鮑曼不動桿菌外膜蛋白A的克隆表達及純化
魏常梅1,王俊瑞2,孫 鵬3,張軍力2
(1內蒙古醫(yī)科大學,內蒙古呼和浩特010110;2內蒙古醫(yī)科大學附屬醫(yī)院檢驗科,內蒙古呼和浩特010050;3內蒙古醫(yī)科大學病原生物學實驗室,內蒙古呼和浩特010059)
目的:通過分子克隆方法制備鮑曼不動桿菌外膜蛋白A(OmpA)純化蛋白,為進一步研究鮑曼不動桿菌OmpA蛋白的生物學活性提供基礎.方法:首先采用PCR方法擴增鮑曼不動桿菌標準菌株ATCC19606株外膜蛋白A編碼基因(OmpA),構建其原核表達載體pET30a/ompA,所得產(chǎn)物經(jīng)PCR方法和測序進行鑒定.之后篩選陽性表達載體,將其轉化至大腸桿菌表達宿主菌BL21,最后將表達的蛋白質進行純化.結果:重組表達載體pET30a/ompA構建成功,并經(jīng)PCR方法和測序方法進行鑒定;重組蛋白在所構建的原核表達系統(tǒng)中實現(xiàn)了高表達,純化后得到了高純度的OmpA蛋白.結論:本次試驗通過分子克隆技術,使鮑曼不動桿菌OmpA蛋白在構建的原核表達系統(tǒng)中成功表達,并且獲得了高純度的目標蛋白,為進一步研究鮑曼不動桿菌外膜蛋白A的生物學活性及抗體的保護作用奠定了基礎.
鮑曼不動桿菌;外膜蛋白A;表達及純化
0 引言
鮑曼不動桿菌是一種非發(fā)酵糖類、動力陰性、氧化酶陰性的革蘭氏陰性桿菌,其廣泛分布于自然界、醫(yī)院環(huán)境以及人體表面,是引起醫(yī)院感染的重要致病菌之一[1].根據(jù)國家細菌監(jiān)測網(wǎng)統(tǒng)計,我國不同地區(qū)醫(yī)院中鮑曼不動桿菌檢出率逐年增高,已成為臨床感染疾病中的主要細菌.現(xiàn)如今,鮑曼不動桿菌對于亞胺培南、美羅培南等碳青霉烯類抗生素持續(xù)保持了較高的耐藥率[2-6].據(jù)文獻報道,鮑曼不動桿菌外膜蛋白的表達情況與多種抗生素的抗性具有明顯的相關性[7].外膜蛋白(outer membrane protein,OMP)是細菌肽聚糖外脂質雙層鑲嵌的特殊蛋白質,它被證實可以負責細菌代謝相關物質的運輸、參與鮑曼不動桿菌耐藥機制等,屬于國內外相關研究領域的熱點之一[8].研究顯示,外膜蛋白可以改變細菌外膜的通透性、改變抗生素結合靶位,還可以促進β-內酰胺酶的產(chǎn)生等[9-12].OmpA不僅可以參與以上耐藥機制,還與鮑曼不動桿菌毒力及致病性密切相關,其可以促進形成生物膜來保護細菌、結合宿主細胞表面的特定成分并侵入、誘導細胞凋亡等[13-16].但鮑曼不動桿菌的OmpA蛋白參與毒力產(chǎn)生的具體機制及其它生物學活性尚不明確.
本研究旨在通過分子克隆技術獲取鮑曼不動桿菌OmpA純化蛋白,以期進一步探索OmpA在鮑曼不動桿菌中的毒力表達情況及其具體生物學活性.
1 材料和方法
1.1 實驗材料 細菌RNA提取試劑盒、細菌DNA提取試劑盒、瓊脂糖凝膠DNA回收試劑盒來自北京天根公司.DNA聚合酶購自BPI公司.RT-PCR試劑盒、反轉錄試劑盒、內切酶來自大連寶生物有限公司.質粒pET30a來自Novagen公司.BL21感受態(tài)細胞購自北京天根生化科技有限公司.
1.2 實驗器材 高速冷凍離心機來自HITACHI CR-21GIII公司.VITEK-32全自動微生物分析鑒定儀來自法國梅里埃公司,基礎電泳儀、電泳槽、來自BIO-RAD公司,Tanon-1600凝膠成像儀來自Tanon公司.
1.3 實驗方法
1.3.1 OmpA基因擴增鮑曼不動桿菌RNA提取首先復蘇鮑曼不動桿菌臨床分離株ATCC19606株,之后常規(guī)培養(yǎng)18~24 h,將菌液12 000 r/min,離心2 min收集菌體,用含有400 mg/L溶菌酶的100 μL TE緩沖液懸浮菌體.加入350 μL裂解液RL,震蕩混勻,12 000 r/min,離心2 min.將得到的上清轉移至另一EP管,加入250 μL無水乙醇,混勻,將溶液沉淀一起轉入吸附柱CR3,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.加入350 μL去蛋白液RW1,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.DNase I工作液的配置:將10 μLDNase I儲存液加入新的RNase-Free離心管中,之后放入70 μL RDD溶液,混勻.向CR3加入80 μLD-Nase I工作液,置于室溫15 min.加入350 μL去蛋白液RW1,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.之后加入500 μL漂洗液RW,室溫2 min,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.重復清洗一次.12 000 r/min,離心2 min,棄去廢液,室溫晾置數(shù)分鐘.轉入新的RNase-Free離心管,吸附膜中間懸空滴加100 μLRNase-Free ddH2O,室溫2 min,12 000 r/min,離心2 min,得到RNA溶液.
反轉錄.配置RT反應液:4 μL 5×PrimeScript RT Master Mix,16 μL RNA溶液.反應程序:37℃,15 min;85℃,5 s;4℃.將RNA轉錄為cDNA,-80℃保存.
設計引物及合成.采用 Genbank中的EWO26642.1基因序列設計并合成引物,設計的引物序列為,F(xiàn):GGAATTCTTCCAAGACAGCCAACACAA-CAAT,R:CCGCTCGAGTTGAGCTGCTGCAGGAGCT-GCC.合成由上海生工生物工程有限公司完成.
PCR.反應體系:1 μL模板,3 μL dNTP(2.5 mmol/L stock),5 μL Buffer(10X),0.2 μL引物F, 0.2 μL引物R,0.2 μL(5unit/μL)聚合酶(Taq DNA Polymerase,BPI),37.5 μL ddH2O.反應程序:95℃,5 min;95℃,40 s,56℃,40 s,72℃,1 min,共30個循環(huán);72℃,10 min.
PCR產(chǎn)物回收.將目的基因DNA條帶從瓊脂糖凝膠中切下,放入干凈的離心管、稱質量.加入等倍體積溶液PN,50℃水浴至膠塊完全溶解.將所得溶液加入500 μL平衡液BL處理的吸附柱CA2中,室溫5 min,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.加入600 μL漂洗液PW,12 000 r/min,離心30~60 s,倒掉廢液,將吸附柱放回收集管.重復清洗一次.12 000 r/min,離心2 min,棄去廢液,室溫晾置數(shù)分鐘.轉入新的離心管,吸附膜中間懸空滴加30 μL ddH2O,室溫5 min,12 000 r/min,離心2 min,得到DNA溶液.
1.3.2 構建重組質粒及其驗證 目的片段的酶切.20 μL PCR回收產(chǎn)物,2 μLEcoR I,2 μLXho I,5 μL 10 ×Buffer,37℃孵育過夜.采用瓊脂糖凝膠DNA回收試劑盒將酶切產(chǎn)物回收.
載體的酶切.20 μL載體(pET30a)質粒2 μL EcoR I,2 μL Xho I,5 μL 10×Buffer,37℃孵育過夜.采用瓊脂糖凝膠DNA回收試劑盒將酶切的載體回收.
連接及轉化.連接體系:3 μL酶切回收產(chǎn)物,1 μL載體(pET30a),5 μL的2×Rapid Buffer,1 U T4 DNA Ligase,混勻后置于16℃孵育過夜.轉化:取出100 μL保存于-80℃的感受態(tài)細胞(BL21)置于冰上緩慢解凍.感受態(tài)細胞解凍后將連接產(chǎn)物加入并混勻,在0℃冰水混合物中放置30 min.快速移入42℃水浴鍋中熱激90 s.之后0℃冰浴2 min,再加入800 μL無任何抗性的 LB液體培養(yǎng)基.混勻后在37℃水浴箱震蕩培養(yǎng)45~60 min.之后5 000 r/min離心3 min,棄上清,留取約100~150 μL液體,吹打混勻重新懸浮菌體,將菌液涂布于有相應抗性的LB平板.待平板晾干,置于37℃培養(yǎng)箱倒置過夜培養(yǎng).
菌液PCR驗證.挑取轉化平板上的單個菌落于1 mL相應抗性的液體LB中,37℃搖床培養(yǎng)4 h;各取1 μL進行PCR驗證,體系如下:1 μL模板,1 μL引物F,1 μL引物R,7 μL ddH2O,10 μL 2X Taq mix-ture.反應程序:95℃,5 min;95℃,40 s,56℃,40 s,72℃,1 min,共30個循環(huán);72℃,10 min.
小量表達.由轉化的平板中挑取單個克隆接種到1.5 mL的LB液體培養(yǎng)基中,置于37℃搖床,200 r/min進行培養(yǎng).將其培養(yǎng)至A=0.6時,IPTG(0.5 mmol/L)誘導,之后37℃,200 r/min培養(yǎng)2 h.取出誘導后的菌液1 mL,12 000 r/min將其離心1 min,棄去上清,再用50~100 μL 10 mmol/L Tris-HCl(pH 8.0)溶液將沉淀吹散,之后加入緩沖液等體積的2× loading buffer,置于100℃煮沸5 min,最后電泳進行檢測.
細菌基因的PCR及測序驗證.采用天根公司的細菌DNA提取試劑盒提取陽性克隆菌的DNA,之后用下述驗證引物進行PCR.PCR里所用的引物與上述“1.3.1”中PCR擴增所用引物相同.得到的PCR產(chǎn)物送至上海生工生物工程有限公司進行基因測序.將測序所得結果在NCBI blast數(shù)據(jù)庫中進行對比、分析.
1.3.3 重組蛋白大量表達及其純化 蛋白的大量表達.挑選經(jīng)過驗證的正確菌株,接1~2 μL活化的菌液到10 mL LB液體培養(yǎng)基中,置于37℃,200 r/min培養(yǎng).將培養(yǎng)得到的菌液轉接至500 mL LB液體培養(yǎng)基并混勻,之后37℃,200 r/min進行,將其培養(yǎng)至A=0.6時,再IPTG(0.5 mmol/L)誘導4 h.將誘導后的菌體收集:6 000 r/min,離心5 min.棄去上清.之后進行超聲破菌:用25 mL 10 mmol/L Tris-HCl(pH8.0)溶液將沉淀吹散,再超聲.進行電泳確定其表達形式:取菌液100 μL進行超聲(500 W,90次,每次3 s,間隔6 s),將超聲后的菌懸液12 000 r/min,離心10 min,再取50 μL上清液轉移至另一EP管,將上清除去,剩余的沉淀用50 μL 10 mmol/L Tris-HCl(pH8.0)溶液將其吹散,之后加入50 μL 2×loading buffer,置于100℃煮沸5 min,最后進行電泳.
蛋白的純化.用去離子水洗鎳柱(Ni Sepharose 6 Fast Flow,GE Healthcare),至其pH調至7.0.之后進行掛鎳,至pH2~3.用去離子水洗柱至pH7.0.加入10 mmol/L Tris-HCl(pH8.0)溶液平衡鎳柱,大約100 mL.再用含0.5 mol/L氯化鈉的10 mmol/L Tris-HCl(pH8.0)溶液平衡鎳柱,約50 mL.之后稀釋樣品進行上樣.樣品中含氯化鈉,使其終濃度為0.5 mol/L.上樣結束后,用含0.5 mol/L氯化鈉的10 mmol/L Tris-HCl(pH8.0)溶液洗柱.再分別用含15 mmol/L咪唑、60 mmol/L咪唑、300 mmol/L咪唑的10 mmol/L Tris-HCl(pH8.0)(含0.5 mol/L氯化鈉)溶液洗脫,分別收集蛋白峰.最后電泳檢測蛋白純化效果.
2 結果
2.1 目的基因序列 在PubMed數(shù)據(jù)庫中檢索鮑曼不動桿菌外膜蛋白A的蛋白信息,得到其基因序列.TTCCAAGACAGCCAACACAACAATGGCGGTAAAGA TGGTAACTTAACTAACGGTCCTGAGTTACAAGACGA TTTATTCGTTGGCGCAGCTCTTGGTATCGAGTTAACT CCATGGTTAGGTTTCGAAGCTGAATATAACCAAGTT AAAGGCGACGTAGACGGCGCTTCTGCTGGTGCTGA ATATAAACAAAAACAAATCAACGGTAACTTCTATGT TACTTCTGATTTAATTACTAAAAACTACGACAGCAA AATCAAGCCGTACGTATTATTAGGTGCTGGTCACTA TAAATACGACTTTGATGGCGTAAACCGTGGTACACG TGGTACTTCTGAAGAAGGTACTTTAGGTAACGCTGG TGTTGGTGCTTTCTGGCGCTTAAACGACGCTTTATCT CTTCGTACTGAAGCTCGTGCTACTTATAATGCTGATG AAGAGTTCTGGAACTATACAGCTCTTGCTGGCTTAAA CGTAGTTCTTGGTGGTCACTTGAAGCCTGCTGCTCCT GTAGTAGAAGTTGCTCCAGTTGAACCAACTCCAGTT GCTCCACAACCACAAGAGTTAACTGAAGACCTTAA CATGGAACTTCGTGTGTTCTTTGATACTAACAAATCA AACATCAAAGACCAATACAAGCCAGAAATTGCTAAA GTTGCTGAAAAATTATCTGAATACCCTAACGCTACTG CACGTATCGAAGGTCACACAGATAACACTGGTCCAC GTAAGTTGAACGAACGTTTATCTTTAGCTCGTGCTAA CTCTGTTAAATCAGCTCTTGTAAACGAATACAACGTT GATGCTTCTCGTTTGTCTACTCAAGGTTTCGCTTGGG ATCAACCGATTGCTGACAACAAAACTAAAGAAGGTC GTGCTATGAACCGTCGTGTATTCGCGACAATCACTG GTAGCCGTACTGTAGTAGTTCAACCTGGTCAAGAAG CGGCAGCTCCTGCAGCAGCTCAA
2.2 目的基因PCR擴增 鮑曼不動桿菌標準菌株ATCC19606株OmpA基因經(jīng)PCR擴增后所得片段(1 000 bp)(圖1).PCR擴增的片段大小和預期的片段大小相一致.
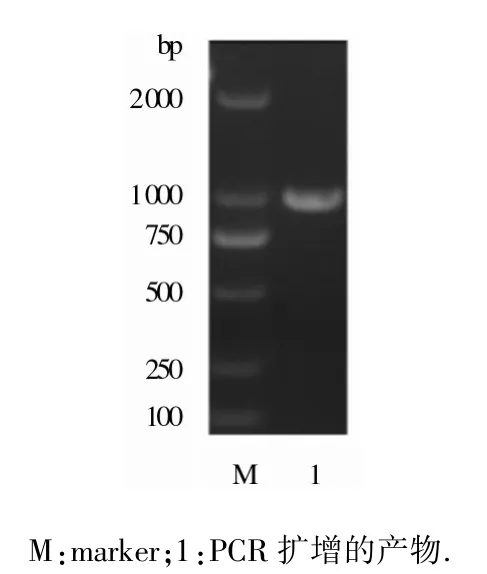
圖1 PCR擴增產(chǎn)物瓊脂糖凝膠電泳結果
2.3 菌液PCR驗證 載體和目的片段雙酶切并連接、轉化后的菌液PCR驗證結果見圖2.菌液擴增片段大小與目的片段大小一致.
2.4 構建重組質粒成功后蛋白小量表達結果 將構建的重組質粒進行小量表達,可檢測到與預期大小一致的目的蛋白(圖3).

圖2 菌液PCR產(chǎn)物瓊脂糖凝膠電泳結果
2.5 重組質粒PCR驗證及測序鑒定 經(jīng)過PCR驗證和測序鑒定,PCR擴增產(chǎn)物瓊脂糖凝膠電泳結果顯示與預期大小片段一致的基因片段(圖4),PCR產(chǎn)物1 000 bp.將產(chǎn)物送至上海生工生物工程有限公司進行測序,測序結果部分圖譜見圖5.將測序結果與NCBI數(shù)據(jù)庫序列進行比對,其同源性為 100%(圖6).
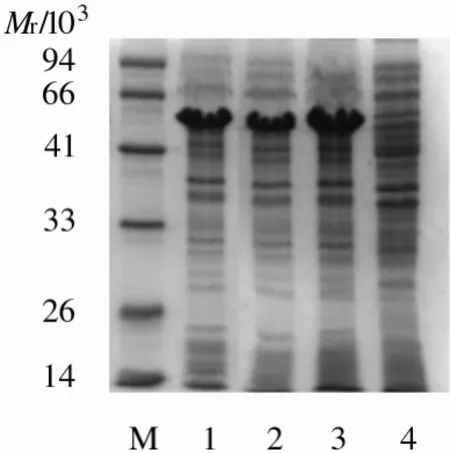
圖3 小量表達蛋白的SDS-PAGE電泳結果

圖4 插入序列PCR驗證結果
圖5 OmpA插入片段測序部分圖譜
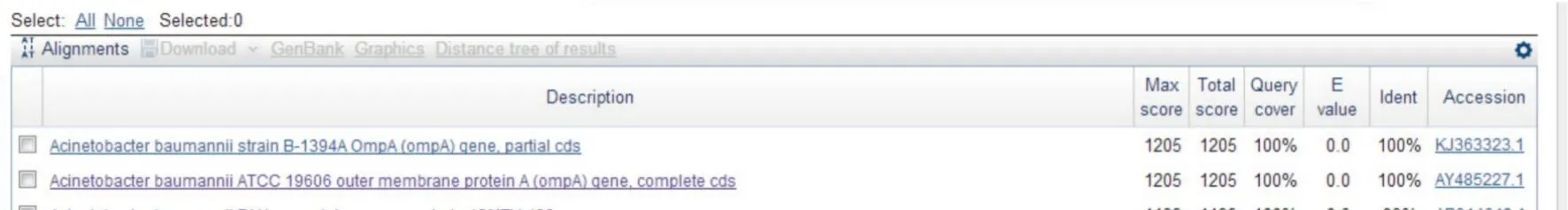
圖6 插入序列同源性比對結果
2.6 目的蛋白在菌體中的大量表達 目的蛋白經(jīng)過大量表達后再進行SDS-PAGE觀察,結果顯示與預期大小蛋白的表達相一致(圖7).
2.7 純化蛋白的表達 目的蛋白經(jīng)純化后蛋白電泳結果顯示了與預期大小一致的蛋白表達(圖8).
3 討論
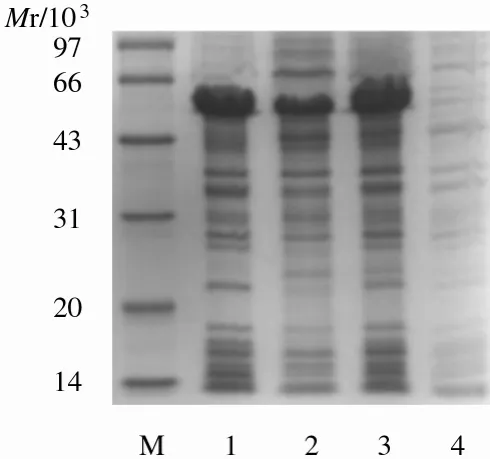
圖7 大量表達目的蛋白SDS-PAGE電泳結果
鮑曼不動桿菌OmpA是目前研究領域里最為深入的外膜蛋白之一.多項研究顯示,鮑曼不動桿菌已經(jīng)成為全球院內感染的主要形式,由于其抵抗幾乎所有的常規(guī)抗生素,現(xiàn)在被美國傳染病學會列為危險六個微生物之一[17-18].有研究發(fā)現(xiàn),鮑曼不動桿菌OmpA基因的缺失會導致氯霉素、氨曲南和萘啶酸等藥物的最小抑菌濃度值[12].OmpA是鮑曼不動桿菌的主要非特異性通道,會使細菌整個外膜的滲透性減低.該蛋白的低滲透連同β內酰胺酶構成和多種藥物外排泵同時存在,是多種抗生素高耐藥必不可少的機制[19].OmpA蛋白被認為是靜脈感染后鮑曼不動桿菌體液免疫應答主要靶標[20],可以將外膜錨定到細胞壁[21],與真核細胞相互作用,誘導其凋亡.但是,鮑曼不動桿菌的OmpA蛋白其他具體的生物學活性尚不明確.因此,本研究旨在初步構建OmpA重組蛋白,便于今后更好地探討OmpA蛋白的生物學活性及其具體致病機制.

圖8 蛋白純化后電泳結果
本研究從鮑曼不動桿菌臨床分離株中成功克隆了OmpA基因,并采用原核表達載體pET30a對Om-pA基因進行表達.本次實驗中通過雙酶切與載體pET30a成功重組.之后,采用PCR方法驗證得到與預期大小一致的基因片段,其基因測序結果表明目的基因片段與GenBank中鮑曼不動桿菌菌株OmpA基因一致性高達100%,證實了本研究所選菌株OmpA基因與比對序列高度同源,也說明了該基因具有高度保守性.經(jīng)大腸桿菌誘導表達目的蛋白,驗證結果顯示該蛋白相對分子質量為50 kD左右,與預期結果一致.但由于本研究所獲得重組蛋白含量有限,關于鮑曼不動桿菌OmpA蛋白其他具體的生物學活性尚不能確定,有待進一步擴大樣本量進行驗證.
綜上所述,本研究采用基因重組的方法成功獲得了高純度的鮑曼不動桿菌OmpA重組蛋白,并采用PCR方法和基因測序方法進行驗證,為進一步研究OmpA蛋白在鮑曼不動桿菌生物學活性以及致病機制奠定了基礎.
[1]習慧明,徐英春,朱德妹,等.2010年中國CHINET鮑曼不動桿菌耐藥性監(jiān)測[J].中國感染與化療雜志,2012,12(2):98-104.
[2]胡付品,朱德妹,汪 復,等.2013年中國CHINET細菌耐藥性監(jiān)測[J].中國感染與化療雜志,2014,14(5):365-374.
[3]孟 峻,張軍力,王俊瑞,等.鮑曼不動桿菌感染的臨床分布及耐藥性分析[J].內蒙古醫(yī)科大學學報,2014,36(4):293-296.
[4]Garcia-Quintanilla M,Pulido MR,McConnell MJ.First steps to-wards a vaccine against Acinetobacter baumannii[J].Curr Pharm Biotechnol,2013,14(10):897-902.
[5]張 輝,張小江,徐英春,等.2012年中國CHINET不動桿菌屬細菌耐藥性監(jiān)測[J].中國感染與化療雜志,2014,14(5):392 -397.
[6]李光輝,朱德妹,汪 復,等.2012年中國CHINET血培養(yǎng)臨床分離菌的分布及耐藥性[J].中國感染與化療雜志,2014,14(6):474-481.
[7]吳春陽,錢雪峰,張險峰,等.多重耐藥鮑曼不動桿菌外排泵基因和外膜蛋白基因的檢測[J].臨床檢驗雜志,2013,31(7):531-534.
[8]溫順航,李昌崇.鮑曼不動桿菌外膜蛋白研究進展[J].國際呼吸雜志,2011,31(19):1512-1515.
[9]Doi Y,Murray GL,Peleg AY.Acinetobacter baumannii:evolution of antimicrobial resistance-treatment options[J].Semin Respir Crit Care Med,2015,36(1):85-98.
[10]Gaddy JA,Tomaras AP,Actis LA.The Acinetobacter baumannii 19606 OmpA Protein Plays a Role in Biofilm Formation on Abiotic Surfaces and in the Interaction of This Pathogen with Eukaryotic Cells[J].Infect Immun,2009,77(8):3150-3160.
[11]劉青松,孫靜娜,代麗麗,等.鮑曼不動桿菌的耐藥機制研究進展[J].中國微生態(tài)學雜志,2015,27(1):108-111.
[12]Smani Y,F(xiàn)àbrega A,Roca I,et al.Role of OmpA in the multidrug resistance phenotype of Acinetobacter baumannii[J].Antimicrob A-gents Chemother,2014,58(3):1806-1808.
[13]Moon DC,Choi CH,Lee JH,et al.Acinetobacter baumannii outer membrane protein A modulates the biogenesis of outer membrane ves-icles[J].J Microbiol,2012,50(1):155-160.
[14]Park JS,Lee WC,Choi S,et al.Overexpression,purification,crys-tallization and preliminary X-ray crystallographic analysis of the periplasmic domain of outer membrane protein A from Acinetobacter baumannii[J].Acta Crystallogr Sect F Struct Biol Cryst Commun,2011,67(Pt 12):1531-1533.
[15]Jin JS,Kwon SO,Moon DC,et al.Acinetobacter baumannii Se-cretes Cytotoxic Outer Membrane Protein A via Outer Membrane Ves-icles[J].PLoS One,2011,6(2):e17027.
[16]Choi CH,Lee JS,Lee YC,et al.Acinetobacter baumannii invades epithelial cells and outer membrane protein A mediates interactions with epithelial cells[J].BMC Microbiol,2008,8:216.
[17]Baig A,Cabral TM,Corbett CR.Development and characterization of monoclonal antibodies for rapid detection of Acinetobacter bau-mannii[J].Monoclon Antib Immunodiagn Immunother,2014,33(4):291-298.[18]Chiang MH,Sung WC,Lien SP,et al.Identification of novel vac-cine candidates against Acinetobacter baumanniiusing reverse vaccin-ology[J].Hum Vaccin Immunother,2015,11(4):1065-1073.
[19]Sugawara E,Nikaido H.OmpA Is the Principal Nonspecific Slow Porin of Acinetobacter baumannii[J].J Bacteriol,2012,194(15):4089-4096.
[20]Luo G,Lin L,Ibrahim AS,et al.Active and passive immunization protects against lethal,extreme drug resistant-Acinetobacter bauman-nii infection[J].PLoS One,2012,7(1):e29446.
[21]Park JS,Lee WC,Yeo KJ,et al.Mechanism of anchoring of OmpA protein to the cell wall peptidoglycan of the gram-negative bacterial outer membrane[J].FASEB J,2012,26(1):219-228.
Cloning expression and purification of Acine-tobacter baumannii outer membrane protein A
WEI Chang-Mei1,WANG Jun-Rui2,SUN Peng3,ZHANG Jun-Li21
Inner Mongolia Medical University,Hohhot 010110,China;2Clinical Laboratory,Affiliated Hospital of Inner Mongolia Medi-cal University,Hohhot 010050,China;3Pathology laboratory,Inner Mongolia Medical University,Hohhot 010059,China
AIM:To provide a basis study for the biological ac-tivity of Acinetobacter baumannii outer membrane protein A(Om-pA)in Acinetobacter baumannii by preparing purified OmpA with molecular cloning technology.METHODS:PCR method was used toamplifycoded geneofOmpA ofstandard strains ATCC19606,and construct the prokaryotic expression vector pET30a/ompA.The roducts were verified by PCR method.Then the positively expressed vector was selected and was transformed into Escherichia coli expression strain(BL21 strain).The ex-pression products were purified finally.RESULTS:pET30a/om-pA recombination expression vector was successfully constructed and verified by PCR method.The target protein was highly ex-pressed in prokaryotic expression system,and the ideal OmpA of Acinetobacter baumannii was obtained.CONCLUSION:In this experiment,Acinetobacter baumannii outer membrane protein A gene was successfully expressed in the constructed prokaryotic ex-pression system by molecular cloning technology and the highly purified target protein,which provide a basis for further investiga-ting the biological activities of Acinetobacter baumannii OmpA protein and the protective effects of its polyclonal antibody.
Acinetobacter baumannii;outer membrane protein A;expression and purification
R378
A
2095-6894(2015)05-001-06
2015-04-01;接受日期:2015-04-10
內蒙古自然科學基金(2013MS1127)
魏常梅.在讀碩士.E-mail:weichangmei1234@163.com
張軍力.E-mail:junli0099@sina.com

