左心室中部肥厚型梗阻性心肌病的臨床特點及預后
安碩研, 樊朝美,趙世華,田月琴,劉延玲,段福建,王志民,王紅月,蔡遲,閆麗榮,郭曦瀅,楊尹鑒,李一石
臨床研究
左心室中部肥厚型梗阻性心肌病的臨床特點及預后
安碩研, 樊朝美,趙世華,田月琴,劉延玲,段福建,王志民,王紅月,蔡遲,閆麗榮,郭曦瀅,楊尹鑒,李一石
目的:本研究旨在探究左心室中部肥厚型梗阻性心肌病(MVOHCM)患者的臨床特點及長期預后。
方法:對66例MVOHCM患者的發病率、臨床特征、心血管事件發生率和死亡率進行了回顧性分析。根據Kaplan-Meier法計算累積生存率。使用單因素和多因素Cox風險模型計算心原性死亡和心血管事件的危險因素及95%可信區間。
結果:66例MVOHCM患者在2 413例肥厚型心肌病(HCM)患者中約占2.74%。平均診斷年齡為(40.16±14.64)歲。經過平均(7.30±6.25)年的隨訪,MVOHCM患者的心血管死亡率為13.64%,不明原因暈厥[風險比(HR):13.37,95%可信區間(CI):1.65~114.46,P=0.015]是心血管死亡的獨立預測因子。30例(45.45%)患者至少發生了一次心血管事件,其中最常見的是非持續性室性心動過速(NSVT)。13例(19.70%)患者合并心尖室壁瘤,此類患者更易發生NSVT。
結論:MVOHCM預后不良。心血管事件發生率高,部分患者合并心尖室壁瘤形成。早期診斷對MVOHCM患者的合理治療十分必要。
左心室中部;肥厚;梗阻;心尖室壁瘤
Methods: A total of 66 MVOHCM patients treated in our hospital were retrospectively studied for their morbidity, clinical characteristics and mortality. The cumulative survival rate was calculated by Kaplan-Meier method; the risk factors for cardiac death and cardiovascular events were analyzed by uni- and multivariate Cox proportional hazard model.
Results: There were 66 (2.74%) patients suffering from MVOHCM among 2413 patients of hypertrophic cardiomyopathy and the average diagnostic age was (40.16 ± 14.64) years. With (7.30 ± 6.25) years of follow-up study, the cardiovascular mortality was 13.6% and unexplained syncope (HR=13.37, 95% CI: 1.65-114.46, P=0.015) was the independent predictor for cardiovascular death. There were 45.45% (30/66) patients experienced at least 1 time of cardiovascular event and the most frequent one was non-sustained ventricular tachycardia (NSVT); 19.70% (13/66) of patients combined with apical aneurysms, and they were more inclined to experience NSVT.
Conclusion: MVOHCM patients usually have unfavorable prognosis with the higher incidence of cardiovascular events, some patients may develop apical aneurysm. The early diagnosis of MVOHCM is important for appropriate treatment.
(Chinese Circulation Journal, 2015,30:1053.)
肥厚型心肌病是由于編碼心肌肌小節蛋白的基因突變所致的常染色體顯性遺傳性心臟病,其心臟的形態、功能和臨床表現均具有高度的異質性[1]。左心室中部肥厚型梗阻性心肌病(MVOHCM)是肥厚型心肌病的罕見亞型,其梗阻位于左心室中部,特征為左心室中部乳頭肌及室間隔中部心肌異常肥厚,左心室心尖部與基底部間存在壓力階差而左心室流出道無壓力階差。
自1975年首次報道此病以來,僅有少數病例報道及小樣本量隊列研究[2-4]。其臨床特點、影像學特征、診斷、發病率、心血管死亡率等依舊存在許多盲點。此外,部分患者合并心尖室壁瘤,而合并室壁瘤患者的臨床特點及對長期預后的影響亦不明確。本研究旨在闡明該病的臨床特征和長期預后。
1 資料與方法
研究對象:1994-01至2011-12期間,共66例患者診斷為MVOHCM,占所有肥厚型心肌病患者(2 413例)的2.74%。診斷標準:肥厚型心肌病定義為:舒張期末左心室最大室壁厚度≥15 mm,同時排除其他導致心肌肥厚的疾病,或最大室壁厚度為13 mm或14 mm伴肥厚型心肌病陽性家族史和(或)心電圖有肥厚型心肌病典型改變[5,6]。MVOHCM定義為:靜息狀態下左心室中部峰值壓差≥30 mmHg(1 mmHg=0.133 kPa),且收縮期左心室中部閉塞或梗阻呈“沙漏狀”。
資料采集主要分為三部分:通過首次臨床評價采集基線信息,利用門診隨診及電話隨訪獲得生存資料及其他臨床數據,通過病史資料查詢和隨訪獲得心血管事件發生時間及具體表現。本研究遵循赫爾辛基原則并獲得我院倫理委員會批準。
主要心血管事件包括:(1)心房顫動;(2)非持續性室性心動過速(NSVT):24 h動態心電圖提示室性心律持續時間<30 s;(3)心肌梗死;(4)血栓栓塞性腦卒中或短暫性腦缺血發作(TIA);(5)紐約心臟病協會心功能分級>I級的進展性心力衰竭。
疾病相關性死亡:(1)心原性猝死(SCD),其中心臟停搏后復蘇、植入型心律轉復除顫器(ICD)除顫等同于心原性猝死;(2)肥厚型心肌病相關栓塞事件所致卒中引起死亡,多見于心房顫動[7]。
臨床終點事件定義為全因死亡及疾病相關死亡。對24例癥狀嚴重者行室間隔心肌切除術、室間隔酒精消融術,隨訪終止于上述治療時。
影像學評估:按照美國超聲心動圖學會標準,所有患者均使用二維多普勒超聲心動圖評估基線情況。39例行心臟磁共振(CMR)成像檢查。13例合并心尖室壁瘤的MVOHCM患者中12例行正電子發射計算機斷層顯像(PET)或單光子發射計算機斷層成像術(SPECT)檢查及選擇性冠狀動脈造影和左心室造影檢查。
2 結果
基線臨床特征(表1):MVOHCM占肥厚型心肌病總人群的2.74%(66/2 413)。66例MVOHCM患者中男性占47例(71.20%),62例就診時即出現癥狀,主要包括呼吸困難、胸痛、頭暈、一過性黑朦、不明原因暈厥。14例(21.21%)患者既往有肥厚型心肌病家族史,6例(9.09%)患者有猝死家族史,24例(36.36%)患者既往有高血壓病史,18例(27.27%)合并高脂血癥,14例(21.21%)合并冠心病,1例(1.52%)合并糖尿病。
超聲心動圖、心電圖及CMR成像(表1):MVOHCM患者心電圖表現并無特異性。靜息狀態左心室中部峰值壓差平均為(68.91±29.36)mmHg(30~171 mmHg)。
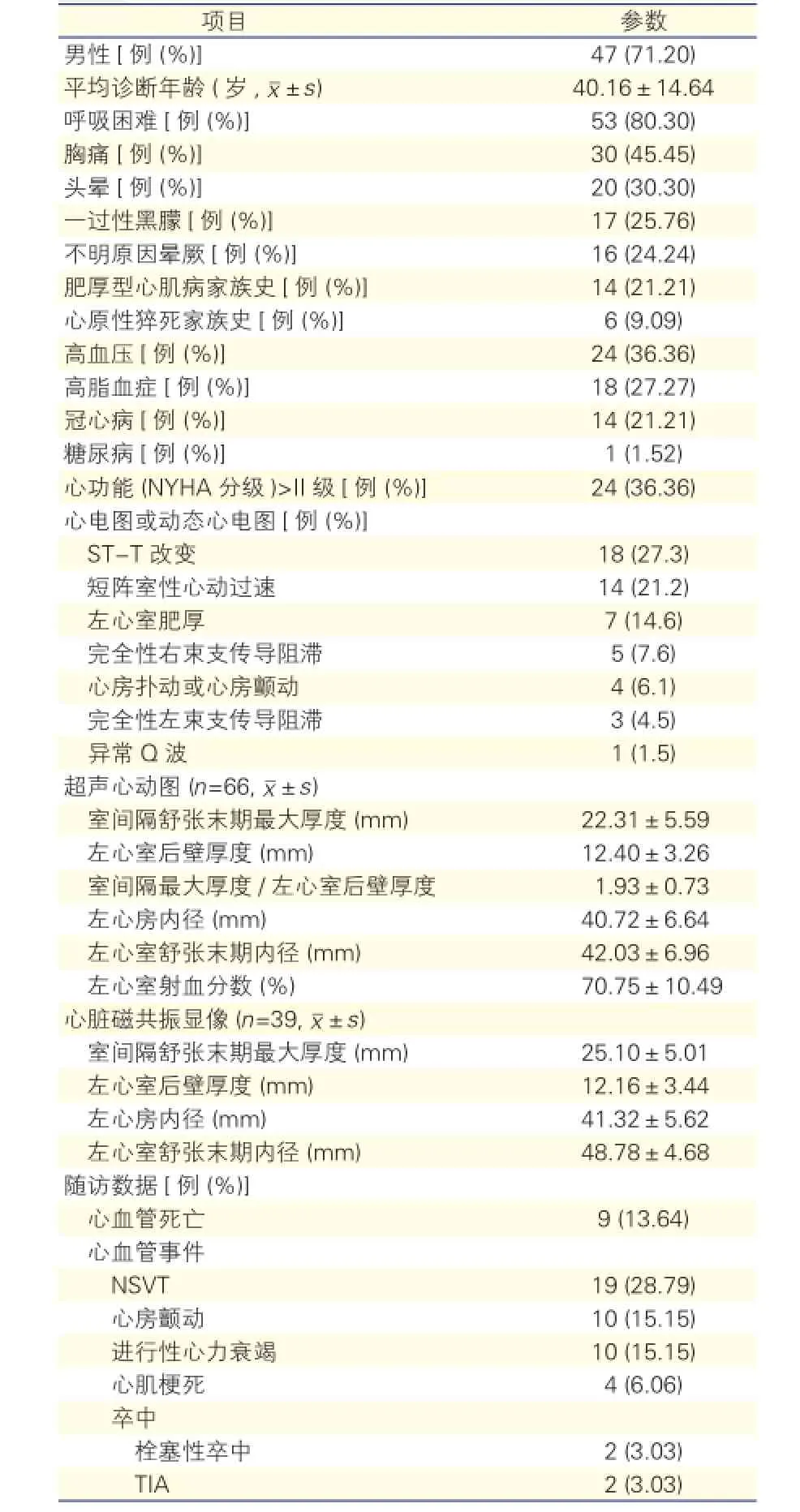
表1 MVOHCM患者臨床特點基線值及隨訪數據(n=66)
臨床轉歸:66例患者均接受了回顧性隨訪,平均隨訪期為(7.30±6.25)年(中位隨訪時間:4.9年)。9例(13.64%)患者出現心血管死亡,包括1例心原性猝死,4例心臟停搏后復蘇,4例心室顫動導致ICD除顫。5年和10年生存率分別為(87±5)%和(81±6)%。多變量Cox回歸分析提示不明原因暈厥[風險比(HR)=13.37,95%可信區間(CI):1.65~114.46,P=0.015]為心血管死亡的獨立預測因子。
隨訪期間30例(45.45%)患者出現47次心血管事件,包括19次非陣發性室性心動過速(NSVT),10次心房顫動,10次進展性心力衰竭,4次卒中,4次心肌梗死。5年和10年的無事件生存率分別為(57±7)%和(37±8)%。19例(28.79%)患者發生NSVT,NSVT為發生率最高的心血管事件。多因素Cox回歸分析提示不明原因暈厥(HR=3.42,95%CI:1.13~10.40,P=0.03)是NSVT的獨立預測因子。
心尖室壁瘤:隨訪期內13例(19.70%)患者合并心尖室壁瘤,其中3例(23.08%)有附壁血栓形成。與不合并心尖室壁瘤患者相比,合并心尖室壁瘤的患者更易發生心血管事件(P=0.001),但二者心血管死亡率差異無統計學意義。
心尖室壁瘤的影像學及組織病理學特征:13例并心尖室壁瘤的患者中12例行CMR檢查,均表現出心尖區室壁明顯變薄、膨出,呈矛盾運動,室壁瘤邊緣及相鄰室間隔、左心室游離壁表現出透壁強化(圖1)。3例患者選擇性冠狀動脈造影見左前降支明顯狹窄(狹窄程度≥50%),統計分析顯示室壁瘤與冠狀動脈病變無關。12例患者收縮末期左心室腔中部閉塞呈“沙漏狀”(圖2)。
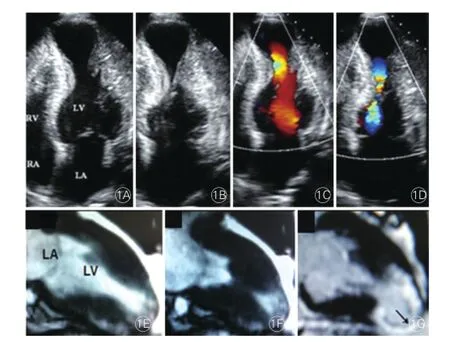
圖1 54歲MVHOCM男性患者經胸二維超聲心動圖,彩色多普勒血流顯像及心臟磁共振成像檢查
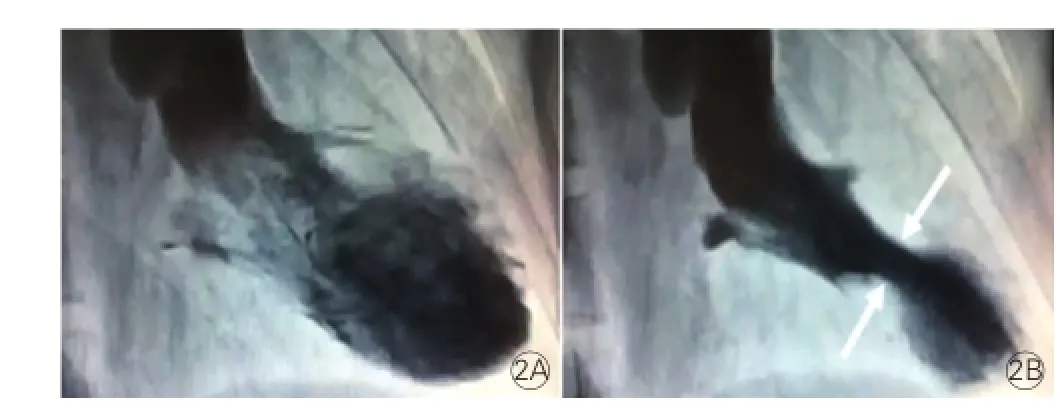
圖2 MVHOCM患者左心室造影圖
12例患者行99Tcm-甲氧基異丁基異腈單光子發射型計算機斷層顯像(99Tcm-MIBI SPECT)及門控18F-氟代脫氧葡萄糖正電子發射計算機斷層顯像(18F-FDG PET)。SPECT顯像提示左心室心尖部嚴重的不可逆性灌注缺損,PET提示同一部位存在放射性缺損,提示灌注/代謝匹配。在左心室中部水平,SPECT提示左心室下壁灌注減低,而PET提示該部位心肌代謝水平正常,提示下壁心肌灌注/代謝不匹配(圖3)。4例患者行手術治療,切除標本送組織病理學檢查。鏡下見室間隔部位心肌細胞異常肥厚且排列紊亂,肌壁間冠狀動脈管壁增厚、管腔狹窄。室壁瘤部位心肌組織完全被纖維組織取代,而心外膜下冠狀動脈未見狹窄(圖4)。

圖3 MVHOCM患者99Tcm-MIBI SPECT及18F-FDG PET成像

圖4 57歲MVHOCM男性患者心尖室壁瘤切除術后心肌標本
對24例(36.36%)藥物治療難以緩解癥狀的患者行介入或手術治療。另外,2例(3.03%)行雙腔起搏器植入術,4例(6.06%)因難以控制的持續性室性心動過速并血流動力學紊亂行ICD植入術。其余36例患者使用β阻滯劑和非二氫吡啶類鈣通道阻滯劑治療。6例患者口服華法林(4例因心尖室壁瘤并附壁血栓,2例因心房顫動),8例因心房顫動口服阿司匹林。
3 討論
本研究搜集了目前國內樣本量最大的一組MVOHCM病例,并對其臨床特點及預后進行研究,此外還總結了MVOHCM合并心尖室壁瘤的臨床特征。此研究結果可能會影響MVOHCM患者的流行病學資料及該病的診斷、治療。
本研究顯示,MVOHCM約占總肥厚型心肌病患者的2.47%,比希臘(8%)、日本(9.4%)所占比例低[8,9]。由于種族差異、選擇偏倚及MVOHCM定義差別,不同研究所得的MVOHCM患病率有所差別。
MVOHCM的結局及預后:本研究顯示MVOHCM患者預后不良。隨訪期間,MVOHCM患者心血管死亡率為13.64%,10年生存率為81%,較心尖肥厚型心肌病(97±2)%低[10]。不明原因暈厥是心血管死亡的獨立預測因子(HR=13.37,95%
CI:1.66~114.46,P=0.015)。
MVOHCM患者心血管事件發生率為45.45%,以NSVT最為常見,出現于約1/3患者中。10年無事件生存率為(37±8)%。不明原因暈厥是NSVT的獨立預測因子(HR=3.42,95%CI:1.13~10.40,P=0.03)。而NSVT是肥厚型心肌病猝死的危險因素[11,12]。因此,對于有不明原因暈厥的MVOHCM患者應行ICD植入術預防心原性猝死。
心尖室壁瘤及其預后:隨訪期間,19.70% MVOHCM患者合并心尖室壁瘤形成。此概率遠高于總肥厚型心肌病人群合并心尖室壁瘤的概率(2.2%)[13]。心尖室壁瘤形成由于左心室中部梗阻及收縮期心室腔壓力升高導致心尖區壓力負荷過重所致。鏡下組織學證實,冠狀動脈微循環結構的特征性改變,如肌壁間冠狀動脈管壁增厚、管腔狹窄,導致冠狀動脈儲備能力下降及心肌缺血,進而導致心肌細胞壞死及心尖室壁瘤形成[14]。
與不合并心尖室壁瘤的MVOHCM患者相比,合并心尖室壁瘤患者的預后較差。室壁瘤區域的運動消失或矛盾運動易致心室腔內血栓形成進而導致卒中,同時室壁瘤邊緣及左心室心肌纖維化邊緣易產生室性心律失常從而導致猝死[15],因此,對于MVOHCM患者及時發現心尖室壁瘤并通過華法林抗凝及植入ICD可以改善預后。
MVOHCM合并心尖室壁瘤患者中,SPECT和PET的聯合應用有助于明確心肌是否存活[16]。合并心尖室壁瘤的MVOHCM患者行SPECT和PET檢查顯示下壁灌注/代謝不匹配,提示存在心肌缺血。術后組織學顯示該處肌壁間冠狀動脈管壁增厚、管腔狹窄,證實此類患者存在冠狀動脈微循環受損。本研究首次聯合使用SPECT、PET及組織學檢查證實,MVOHCM并心尖室壁瘤患者存在冠狀動脈微循環受損。
局限性:本研究為單中心回顧性研究,患者的隨訪時間不統一,因此難以代表中國人群MVOHCM的發病率及臨床特征。中國人群中MVOHCM確切的發病率及臨床特征仍需進一步研究。
結論:MVOHCM患病率相對較低,該病預后不良。MVOHCM并心尖室壁瘤發病率高,預后更差。須盡早識別MVOHCM及是否并心尖室壁瘤,并及時予以合理的治療。
[1] Maron BJ, Maron MS. Hypertrophic cardiomyopathy. Lancet, 2013, 381: 242-255.
[2] ShahA, Duncan K, WinsonG, et al. Severe symptoms in mid and apical hypertrophic cardiomyopathy. Echocardiography, 2009, 26: 922-933.
[3] Sanghvi NK, Tracy CM. Sustained ventricular tachycardia in apical hypertrophic cardiomyopathy, midcavitary obstruction, and apical aneurysm. Pacing ClinElectrophysiol, 2007, 30: 799-803.
[4] Gao XJ, Kang LM, Zhang J, et al. Mid-ventricular obstructive hypertrophic cardiomyopathy with apical aneurysm and sustained ventricular tachycardia: a case report and literature review. Chin Med J (Engl), 2011, 124: 1754-1757.
[5] Gersh BJ, MaronBJ, BonowRO, et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol, 2011, 58: e212-260.
[6] Efthimiadis GK, Parcharidou D, Pagourelias ED, et al. Prevalence and clinical outcomes of incidentally diagnosed hypertrophic cardiomyopathy. Am J Cardiol, 2010, 105: 1445-1450.
[7] Siontis KC, Geske JB , Ong K , et al. Atrial fibrillation in hypertrophic cardiomyopathy: prevalence, clinical correlations, and mortality in a large high-risk population. J Am Heart Assoc, 2014, 25, 3: e001002.
[8] Efthimiadis GK, Pagourelias ED, Parcharidou D, et al. Clinical characteristics and natural history of hypertrophic cardiomyopathy with midventricularobstruction. Circ J, 2013, 77: 2366-2374.
[9] Efthimiadis GK, Pagourelias ED, Parcharidou D, et al. Clinical characteristics and natural history of hypertrophic cardiomyopathy with midventricular obstruction. Circ J, 2013, 77: 2366-2374.
[10] Cai C , Duan F , Yang Y , et al. Comparison of the prevalence, clinical features, and long term outcomes of midventricular hypertrophy vs apical phenotype in patients with hypertrophic cardiomyopathy . Can J Cardiol, 2014, 30: 441-447.
[11] Maron BJ. Risk stratification and role of implantable defibrillators for prevention of sudden death in patients with hypertrophic cardiomyopathy. Circ J, 2010, 74: 2271-2282.
[12] 王妍, 何繼強, 高閱春, 等. 711例肥厚型心肌病患者臨床特征分析. 中國循環雜志, 2011, 6: 434-437.
[13] Maron MS, Finley JJ, Bos JM, et al. Prevalence, clinical significance, and natural history of left ventricular apical aneurysms in hypertrophic cardiomyopathy. Circulation, 2008, 118: 1541-1549.
[14] Minami Y, Kajimoto K, Terajima Y, et al. Clinical implications of midventricular obstruction in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol, 2011, 57: 2346-2355.
[15] Shah DK, Schaff HV, Abel MD, et al. Ventricular tachycardia in hypertrophic cardiomyopathy with apical aneurysm. Ann Thorac Surg, 2011, 91: 1263-1265.
[16] 張凌, 田月琴, 袁建松, 等. 肥厚型心肌病患者核素心肌灌注/代謝顯像的研究. 中國循環雜志, 2011, 6: 438-441.
Clinical Characteristics and Prognosis in Patients With Mid-ventricular Obstructive Hypertrophic Cardiomyopathy
AN Shuo-yan, FAN Chao-mei, ZHAO Shi-hua, TIAN Yue-qin, LIU Yan-ling, DUAN Fu-jian, WANG Zhi-min, WANG Hong-yue, CAI Chi, YAN Li-rong, GUO Xi-ying, YANG Yin-jian, LI Yi-shi.
State Key Laboratory of Clinical Trial Research in Cardiovascular Drugs, Ministry of Health, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Objective: To describe the clinical characteristics with long-term prognosis in patients with mid-ventricular obstructive hypertrophic cardiomyopathy (MVOHCM).
Mid-ventricular; Hypertrophy; Obstruction; Apical aneurysm
2015-03-12)
(編輯:汪碧蓉)
“重大新藥創制”科技重大專項-《心血管創新藥物臨床研究技術平臺建設》(2012ZX09303-008-001);國家臨床重點專科建設項目《衛生部重點實驗室項目》
100037 北京市,北京協和醫學院 中國醫學科學院 國家心血管病中心 阜外醫院 衛生部心血管藥物臨床研究重點實驗室(安碩研、樊朝美、蔡遲、閆麗榮、郭曦瀅、楊尹鑒、李一石),放射科(趙世華),核醫學科(田月琴),超聲科(劉延玲、段福建、王志民),病理科(王紅月)
安碩研 碩士研究生 主要研究方向為心血管專業 Email:anshuoyan@126.com 通訊作者:樊朝美 Email:fred_fan2004@aliyun.com
R54
A
1000-3614(2015)11-1053-05
10.3969/j.issn.1000-3614.2015.11.006

