利用基因芯片篩選烤煙早花基因初探
楊靜 ,陳杰 ,陳建軍 ,鄧世媛 ,邱妙文 ,趙偉才 ,王維
1 黔東南州煙草公司鎮遠縣分公司,貴州鎮遠 557700;
2 華南農業大學農學院,廣東廣州 510642;
3 黔東南州煙草公司,貴州凱里 556000;
4 廣東省煙草南雄科學研究所,廣東南雄 5124002
利用基因芯片篩選烤煙早花基因初探
楊靜1,2,陳杰3,陳建軍2,鄧世媛2,邱妙文4,趙偉才4,王維2
1 黔東南州煙草公司鎮遠縣分公司,貴州鎮遠 557700;
2 華南農業大學農學院,廣東廣州 510642;
3 黔東南州煙草公司,貴州凱里 556000;
4 廣東省煙草南雄科學研究所,廣東南雄 5124002
為研究與煙草早花有關的基因,本試驗利用安捷倫煙草全基因組基因芯片對烤煙品種K326及其抗早花變異系華煙06、K326LF花芽分化過程莖尖端基因表達譜進行分析,篩選出其中與花芽分化可能有主要關系的基因:AGL20、CCR2、ELF4、ERD7、CBF1、COR413-PM1、EMF2、VIP4、COL1、AGL17、COL9、FPA、SWN等,其中 COL2、ELF4的表達差異達到了5倍;AGL62、CBF1、SWN、NAP與FPA的差異大于或等于10倍。該試驗可為進一步研究煙草抗早花機理及培育抗早花新品種提供參考。
烤煙;早花;抗早花;基因芯片;基因
煙草是以收獲葉片為目的的經濟作物,發生早花的煙株由于過早地從營養生長轉入生殖生長,煙株生長勢弱、葉數少,葉片窄小、葉片的產量和質量降低[1,2]。擬南芥開花基因的研究開啟了植物開花基因研究的大門,通過對擬南芥開花基因同源基因的搜尋,水稻、谷物、果樹中與開花相關的基因的研究也已取得了很大的進展,與開花相關的基因相繼被克隆[3-5]。Smykal等人[6]從煙草中克隆了與開花時間相關的基因Nicotiana SOC1(NtSOC1)和Nicotiana FUL(NtFUL),并經過試驗表明它們與光周期特性有關,過表達能引起煙草提早開花。李元元根據不同植物MADS-box家族基因的保守區序列,設計簡并引物,從烤煙品種NC82中克隆出了MADS-box家族的同源基因[7]。王小彥等[8]通過低溫等處理煙草后,分析了低溫誘導煙草早花中的SOC1以及一些與代謝相關的酶、部分植物生長物質的基因表達變化。李爽等人[9]在煙草中轉入小黑楊PsnAP1基因,轉基因煙株提早開花。有研究發現,煙草中PtGT1 基因過表達會導致植株早花[10]。孫穎等人利用RNA-seq技術對油桐2個不同發育時期的花芽的轉錄組進行比較分析,搜尋出103個開花相關基因[11]。隨著絨毛狀煙草和林煙草全基因組序列圖譜的完成和全球第一套煙草全基因組基因芯片制作的完成[12,13],煙草基因組研究已邁開步伐[14]。本研究選用Agilent煙草全基因組表達譜芯片檢測煙草早花及抗早花品系花芽形成過程中成千上萬個基因的表達情況。通過比較基因表達的差異,分析早花品種與抗早花品系在花芽形成機理上的不同,篩選出與抗早花可能有主要關系的基因,以期為進一步研究煙草抗早花機理及培育抗早花新品種提供有價值的參考。
1 材料與方法
1.1 試驗材料種植及采樣
本試驗選用烤煙品種K326及其抗早花變異系華煙06、K326LF作為材料。為了使易早花品種K326與其抗早花品種(品系)華煙06和K326LF的開花時間差異更明顯,試驗播種時間比生產上正常播種期提前20天,使煙苗前期充分感受低溫脅迫。漂浮育苗,成苗后移栽至大田,并于移栽后第20天開始對各品種莖尖端進行花芽分化觀察、適時取樣,每個采樣點取三個莖尖端混合提取RNA作為重復,并且標記好各樣品代號。按照上海生物芯片有限公司提供的采樣指南,所采樣品用液氮固定后冷凍保存(-80℃)備用。采樣時間及試驗材料代號如下:
1.2 RNA的抽提和純化
采用TRIZOL Reagent (Cat#15596-018,Life technologies,Carlsbad,CA,US),抽提所得total RNA質檢合格后使用RNeasy mini kit (Cat#74106,QIAGEN,GmBH,Germany)和 RNase-Free DNase Set(Cat#79254,QIAGEN,GmBH,Germany)純化。試驗樣品RNA采用試劑盒Low Input Quick Amp Labeling Kit,One-Color (Cat#5190-2305,Agilent technologies,Santa Clara,CA,US)和標準操作流程對樣品total RNA中的mRNA進行放大和標記,并用RNeasy mini kit (Cat#74106,QIAGEN,GmBH,Germany) 純化標記后的cRNA。
1.3 芯片雜交掃描
按照Agilent表達譜芯片配套提供的雜交標準流程和配套試劑盒,Gene Expression Hybridization Kit(Cat#5188-5242,Agilent technologies,Santa Clara,CA,US)雜交,并在洗缸staining dishes (Cat#121,Thermo Shandon,Waltham,MA,US)中洗片。完成雜交的芯片采用Agilent Microarray Scanner (Cat#G2565CA,Agilent technologies,Santa Clara,CA,US)進行掃描。
1.4 基因芯片數據分析
掃描數據采用Gene Spring Software 11.0 (Agilent technologies,Santa Clara,CA,US) 進行歸一化處理,所用的算法為Quantile。歸一化的數據根據試驗設計兩兩比較(表1),計算倍數差異Fold Change(FC)=SignalA/ SignalB,算法為 2(歸一化A-歸一化B)。登陸上海伯豪生物服務在線網站(http://www.shanghaibiotech.com/),利用在線SAS系統進行數據分析。通過GO(Gene Ontology)分析對兩倍以上的差異表達基因進行功能注釋,結合NCBI中的基因信息選出可能與開花存在主要關系的基因,分析差異倍數并做聚類分析。
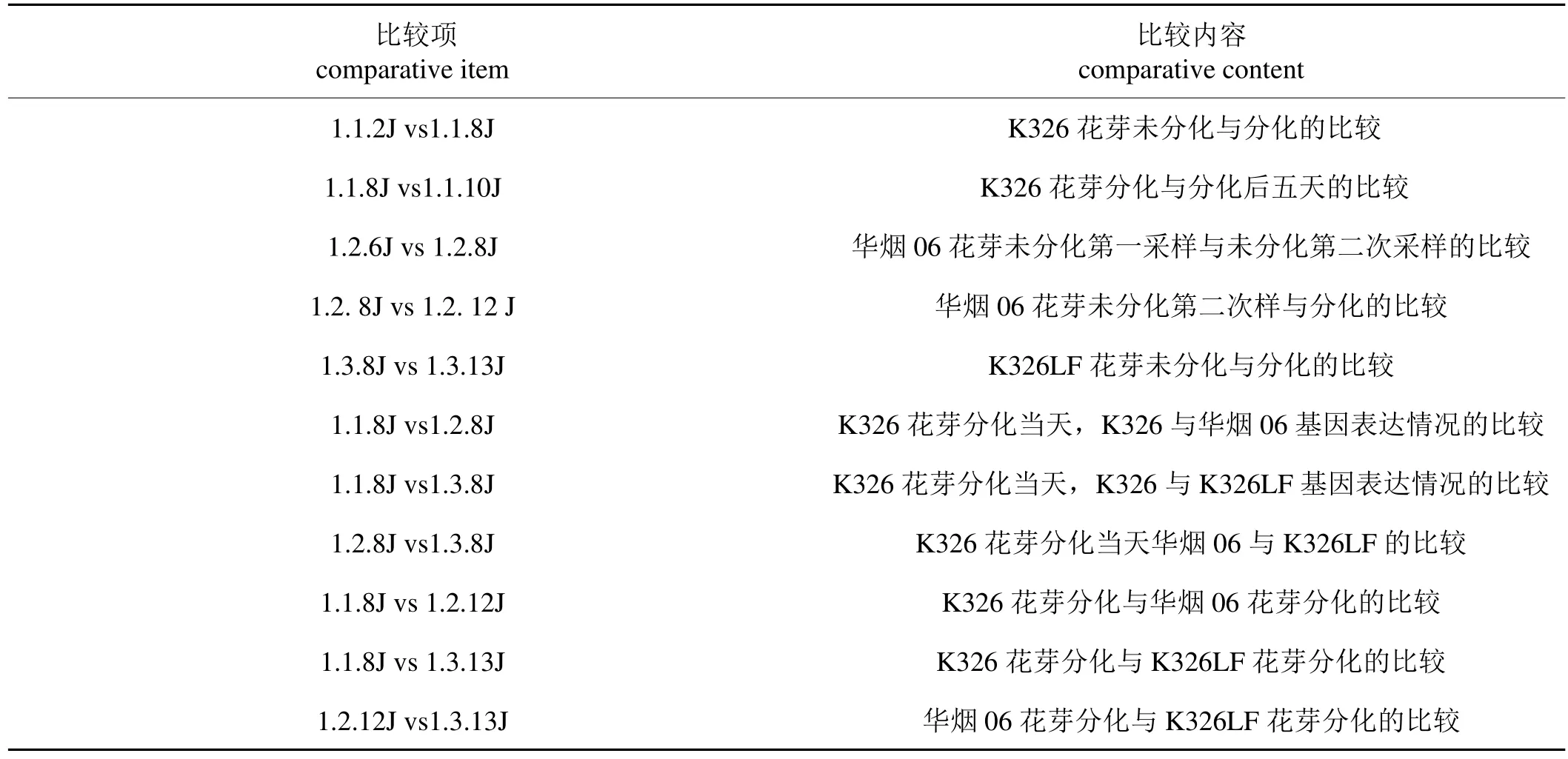
表1 基因芯片檢測結果比較Tab.1 Comparison of gene chip detection results
1.5 熒光定量 PCR驗證
利用煙草Actin基因(AB158612)為內參,從基因芯片分析結果中隨機挑選出5個與開花相關的基因,進行實時熒光定量PCR,三次重復,反應條件為95℃,10min;接著進行40個循環:95℃,15秒;60℃,30 秒。算法為 log22-ΔΔCt。
2 結果
2.1 縱向比較中與開花相關的差異基因表達
2.1.1 各品種(品系)花芽分化過程中開花相關基因的表達
K326花芽未分化和分化相比較,對外界刺激應答的相關基因和生殖發育過程相關的具有功能注釋的差異基因28個,其中上調的有7個,下調的有21個;表達差異在10倍以上的相關基因有5個,其中上調的有1個,下調的有4個。K326花芽分化與分化后五天相比,表達差異在兩倍以上的,與開花、抗寒及干旱脅迫可能有主要關系的基因有18個,其中上調的有11個,下調的有7個;10倍以上的相關基因有5個,1個下調,4個上調。華煙06未分化1與未分化2相比與開花相關的差異基因有15個,其中上調1個,下調14個,2倍差異的有6個,3倍差異的有4個,4倍、5倍的均有1個,10倍以上的有3個。未分化2與分化相比,與開花相關的差異基因有16個,其中上調10個,下調6個,2倍差異的有6個,3倍差異的有5個,4倍、5倍、6倍的均有1個,8倍的1個,10倍以上的有1個。K326LF未分化與分化相比與開花相關的差異表達基因有16個,其中上調10個,下調6個,2倍差異的有11個,3倍差異的有1個,5倍、6倍、7倍的均有1個,10倍以上的有1個。
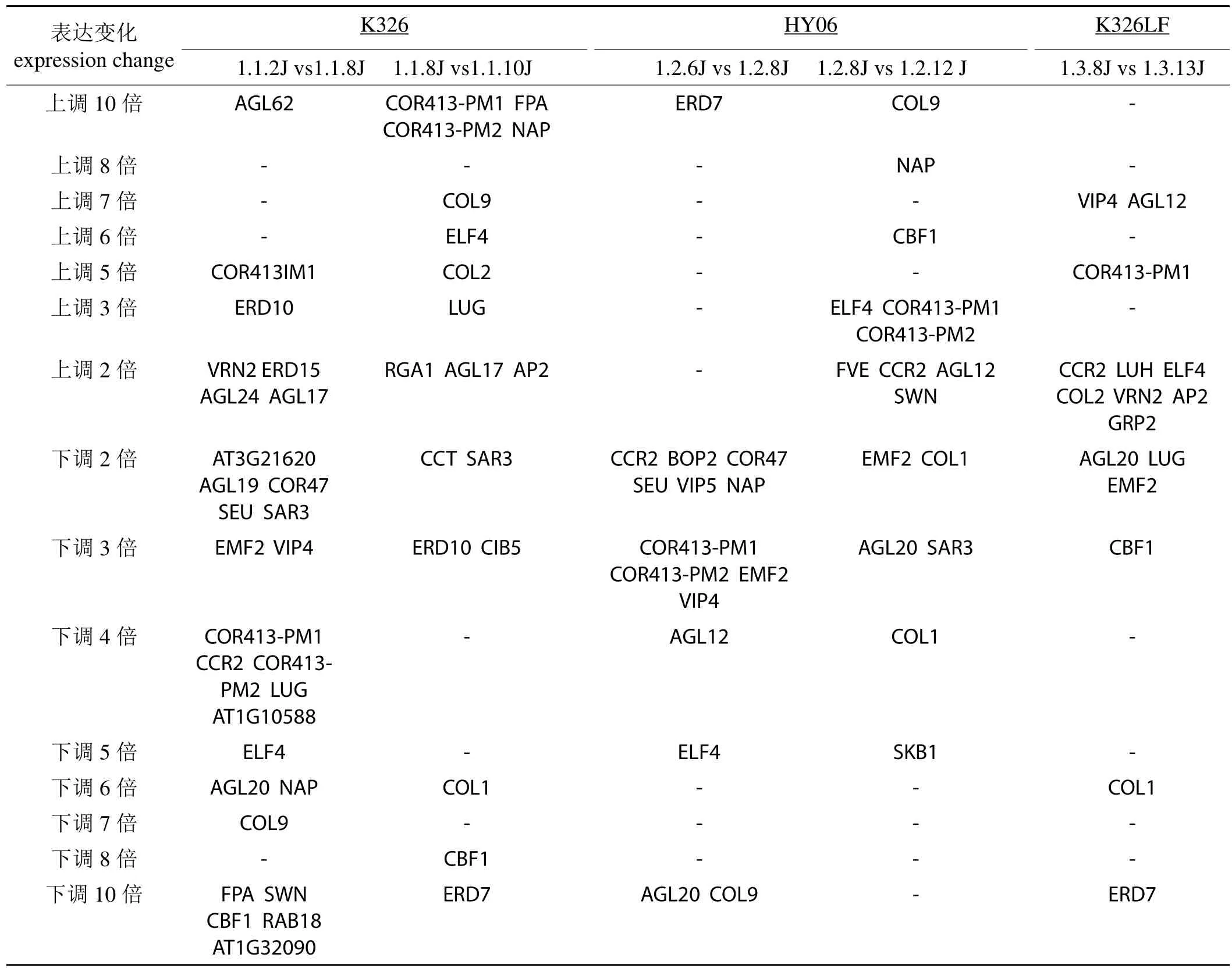
表2 各品種(品系)花芽分化過程中開花相關基因的表達Tab.2 Expression of flowering related genes of various varieti es (strains) in flower bud differentiation process
2.1.2 各品種(品系)縱向比較中開花相關差異表達基因的異同
由表3可以看出,在三者的花芽分化過程中,促進開花的基因AGL20[15]在K326、華煙06及K326LF花芽分化過程中均有表達且不斷上調,說明其對煙株開花具有重要的調控作用。AGL17過表達會導致植株早花[16], K326在未觀察到花芽分化時AGL17已大量表達,這與其早花也許存在著一定的關系。EFL4這個與晝夜節律相關的基因也隨著環境變化在三者中表達情況一致;與環境脅迫相關的基因COR413-PM1和COL1在三者中調控方向一致;其他基因的表達水平在不同品種(品系)中存在差異。
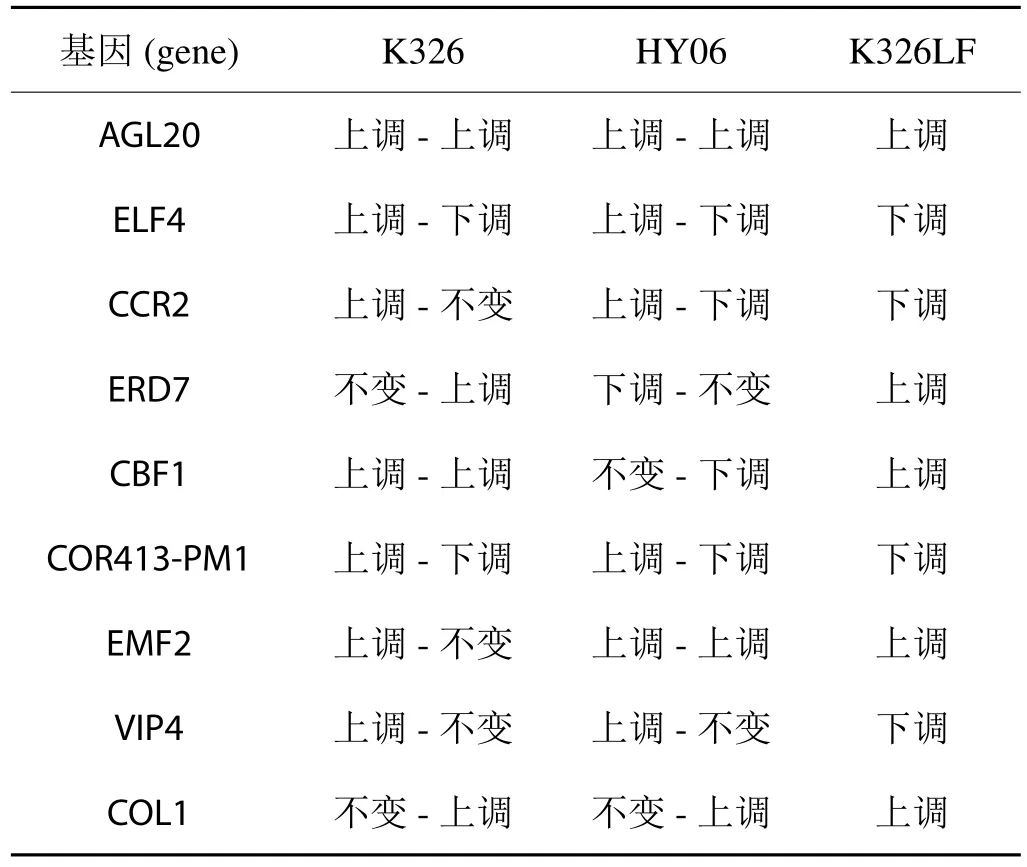
表3 各品種(品系)花芽分化過程中共有的差異的基因的表達Tab.3 Expression of differential gene shared by various variet ies(strains) in flower bud differentiation process
K326、華煙06及K326LF花芽分化過程中共同出現兩倍以上差異表達的基因有AGL20,CCR2,ELF4,ERD7,CBF1,COR413-PM1,EMF2,VIP4,COL1。將K326、華煙06及K326LF花芽分化過程中與開花相關的差異基因表達的異同歸納如下:
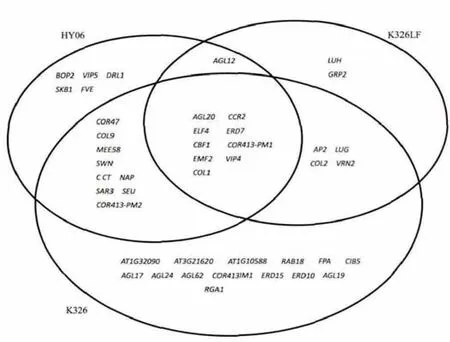
圖2 K326、HY06、K326LF 花芽分化過程中與開花有關的基因Fig.2 Flowering related genes of K326,HY06,K326LF in flower bud differentiation process
2.2 橫向比較中與開花相關的差異基因分析
2.2.1 K326分化當天各品種(品系)間與開花相關的差異基因
K326分化當天, HY06和K326LF同時采樣,與K326相比較,基因芯片中檢測到的差異在2倍以上的與開花相關的基因表達情況歸納為表4。其中K326(1.1.8J)中與開花相關的基因大多相對華煙06(1.2.8J)和K326LF(1.3.8J)上調,華煙06中大多數開花相關的基因相對K326LF下調。

表4 K326花芽分化當天各品種(品系)間開花相關的基因表達Tab.4 Expression of flowering related genes of various varieti es (strains) in K326 flower bud differentiation process
2.2.2 K326、華煙06、K326LF分化時相比與開花相關的差異基因
HY06、K326LF與K326分化時,具有兩倍及兩倍以上差異的與開花相關主要基因的差異情況歸納為表5,其中K326(1.1.8J)相對華煙06(1.2.12J)和K326LF(1.3.13J),大量與開花相關的基因上調。

表5 各品種(品系)分化時與開花相關的差異基因Tab.5 Flowering related differential genes of various varieties (strains) in flower bud differentiation process
2.3 與開花相關的基因的聚類分析
利用SAS在線系統對挑選出的與開花有著主要關系的基因探針進行Heatmap運算,所得結果如圖3所示,圖中紅色區域表示基因上調,綠色區域表示基因下調,黑色表示表達無變化。由聚類結果可以看出,對所采樣品而言,樣品1.1.8J,1.2.8J,1.3.8J的基因表達最相近,即K326花芽分化當天所采樣品的基因表達相接近;1.1.2J與1.2.6J的基因表最相近,即距離K326花芽分化19天時所采的K326莖尖端樣品與距離華煙06花芽分化19天時所采的華煙06莖尖端樣品基因表達最相近。從開花相關的主要基因來看,AGL20,AGL24,AGL17這三個 MADS-box家族基因與VRN2的聚類結果相近。

圖3 各品種(品系)開花相關的主要基因聚類分析Fig.3 Cluster analysis of the main flowering related genes of various varieties (strains)
2.4 芯片數據有效性分析
為了驗證芯片分析結果,隨機挑選了5個與開花有關并具有代表性的差異基因(CCR2,ELF4,AGL20,CBF1,COL9)進行熒光定量PCR驗證。熒光定量PCR所用材料與基因芯片的材料及處理方式完全一樣。從檢測結果中隨機選擇15個比較項進行數據分析,表明驗證結果與芯片試驗結果雖存在一些差異,但總體上基本一致,芯片雜交獲得的基因表達譜信息具有較高的可靠性。
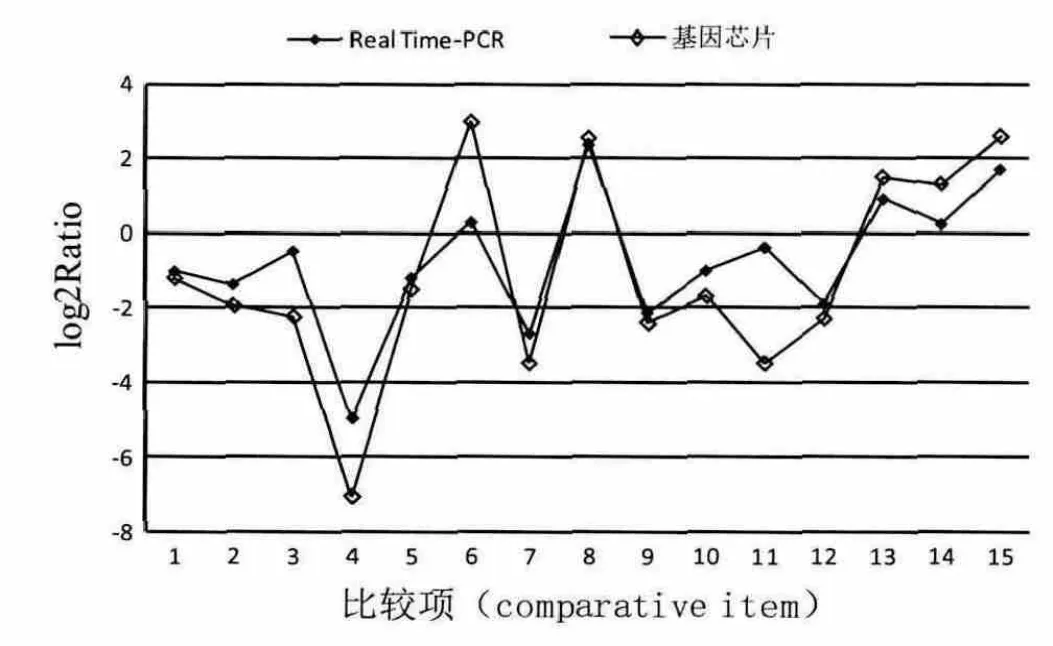
圖4 芯片數據與 Real Time-PCR 結果對比Fig.4 Comparison of gene chip data and Real Time PCR results
3 討論
從表2可看出,在華煙06和K326LF花芽分化過程中,與開花相關的基因表達具有一定的偏向,整個分化過程中呈大部分上調或者大部分下調;K326花芽分化過程中與開花相關的差異基因不僅種類多,而且既有一部分上調,同時又有一部分下調,沒有出現偏向表達。
由表4和表5可以看出,同一天采樣的基因表達相比較差異基因少(表4),雖然莖尖端處于同一種狀態(表5),但是由于采樣日期不同,各樣品間相比差異基因較多。這可能與影響植株大部分基因表達的因素主要是環境有關。Lee等[17]研究表明,植物對環境刺激相當敏感,簡單的觸碰和黑暗處理都有可能影響基因的表達變化。在本試驗聚類結果中,K326開花當天所采三個品種(品系)樣品的基因表達最相近,進一步說明基因的表達受環境影響關系很大,但不同品種(品系)中調控開花的關鍵基因仍通過差異表達決定開花。同時,通過試驗的聚類結果可看到,K326花芽分化前19天所采樣品的表達與華煙06花芽分化前19天所采樣品的表達最相近,這說明無論早花還是晚花的烤煙,在感應到開花信息,達到開花準備的相同時期時,基因的調控機制相近。
前人研究結果表示,基因FPA能夠抑制基因FLC的表達從而促進開花[18,19]。在本試驗中,K326花芽分化過程中FPA的表達在未分化到分化過程中上調了10倍,而在花芽分化過后急劇下降,其對調控K326開花可能有較大影響。AGL20是調控開花的重要基因[20],本試驗中AGL20在K326花芽未分化到分化過程中上調了6倍;與K326相比,華煙06花芽分化過程中雖然AGL20也上調了10倍以上,但抑制開花的基因EMF2和COL9在此過程中也出現上調,這應該與華煙06較晚開花有關,同時說明植株開花是基因共同調控的結果。
研究表明CBF家族基因具有促進FLC表達的作用,導致植株晚花[21]。本試驗中K326分化當天,華煙06和K326LF中CBF1的表達相對K326上調兩倍以上,與K326相比,K326LF中促進開花的MADS-box家族基因AP1[13]的表達量低于K326;華煙06中AGL17和AGL20的表達相對K326LF下調,但其卻早于K326LF出現花芽分化,這應該與華煙06中FPA相對K326LF上調有關。
前人研究表明,AGL20與AP2相互抑制調控開花,AGL20通過抑制CBFs的表達促進開花[22]。 本試驗中K326和K326LF花芽分化過程中都檢測出了AP2,但華煙06中未檢測出,這應該與華煙06花芽分化過程中AGL20出現高于10倍的差異變化,從而抑制了AP2的表達有關(表2)。
安新民等研究表示,從毛白楊中獲得的擬南芥開花相關基因AP3的同源基因PtAP3有可能在誘導植株早花中起到重要的作用[23]。Kelly 等人[24]從煙草中克隆了FLORICAULA(FLO)和LFY的同源基因NFL1和NFL2(Nicotiana FLO/LFY),但試驗證明它們與植株開花并無直接關系。艾育芳等[25]通過同源克隆法從油菜中得到LFY的同源基因BnLFY,試驗表明其在油菜不同時期的根、莖、葉、蕾各器官都有表達,是組成型表達。通過前人的研究可以看出,性狀的表現是基因相互作用的結果,具有相近的序列不一定功能相同。因此,基因芯片檢測出的與開花可能存在主要關系的基因有可能只是與已知的開花基因具有同源性,其功能有待進一步研究。
4 結論
本研究通過分析各品種(品系)自身花芽分化過程基因表達差異的縱向比較及早花品種、抗早花品系間基因表達差異的橫向比較,從中篩選了與開花相關的差異表達基因。在花芽分化過程中起主要作用的基因主要有AGL20、CCR2、ELF4、ERD7、CBF1、COR413-PM1、EMF2、VIP4、COL1、AGL17、COL9、FPA、SWN等。AGL20從K326花芽未分化到分化上調了6倍;從華煙06未分化1(距離其花芽分化的時間與K326花芽未分化到分化的間隔時間相同)到未分化2(K326花芽分化當天)上調了10倍以上,從未分化2到花芽分化又上調了3倍;從K326LF未分化到分化上調了2倍。花芽分化過程中,COL2、ELF4的表達差異達到了5倍;AGL62、CBF1、SWN、NAP與FPA的差異大于或等于10倍。
由于本試驗所用煙草芯片中很多基因的功能都還未知,許多與開花相關的基因的研究仍需要通過合成引物,利用RT-PCR檢測、測序、序列比對等技術進行進一步的探索,以明確煙草中存在的與早花相關的基因。本研究僅僅針對烤煙早花品種及其抗早花品系基因芯片的結果進行了分析研究,為烤煙開花相關的基因研究提供了初步的、最基礎的分析預測。具體烤煙中該表達片段的序列及其在烤煙中的功能仍有待通過測序、克隆、轉基因等進行更深入的研究以明確其在烤煙中的作用。
[1]劉建鋒.煙草早花產生的原因及生產對策[J].陜西農業科學,2005,(2):91 ,130.
[2]金磊,晉艷,周冀衡,等.煙草早花機理及控制的研究進展[J].中國煙草學報,2008,14(1):58-62.
[3]Franklin,KA.Light and temperature signal crosstalk in plant development[J].Current Opinion in Plant Biology,2009,12:63-68.
[4]Horvath D .Common mechanisms regulate flowering and dormancy [J].Plant Science,2009,177(6):523-531.
[5]Matsuda N,Ikeda K,Kurosaka M,et al.Early Flowering phenotype in transgenic pears (Pyrus communis L.)expressing the CiFT gene[J].J.Japan.Soc.Hort.Sci.2009,78(4):410–416.
[6]Smykal P,Gennen J,De Bodt S,et al.Flowering of strict photoperiodic Nicotiana varieties in non-inductive conditions by transgenic approaches[J].Plant Mol Biol,2007,65(3):233-242.
[7]李元元.低溫誘導煙草早花研究與煙草MADS-box基因的同源克隆[J].中國煙草科學,2011,32(3):21-27.
[8]王小彥.低溫誘導煙草早花相關因子的分析[D].河南農業大學碩士論文,2009.
[9]李爽,鄭唐春,臧麗娜,等.小黑楊PsnAP1基因轉化煙草的研究[J].安徽農業科學,2014,42(8):2278-2281,2308.
[10]Wang Yanwen,Wang Wenchao,Jin Shanghui,et al.Overexpression of a putative poplar glycosyltransferase gene,PtGT1,in tobacco increases lignin content and causes early flowering[J].Journal of Experimental Botany,2012,63(7):2799-2808.
[11]孫穎,譚曉風,羅敏,等.油桐花芽2個不同發育時期轉錄組分析[J].林業科學,2014,50(5):70-74.
[12]中國煙草基因組計劃取得重大突破 絨毛狀煙草和林煙草全基因組序列圖譜完成[N/OL].中國煙草,2011-12-13.http://www.tobacco.gov.cn/html/30/3004/3893491_n.html
[13]全球第一套煙草全基因組基因芯片制作完成[N/OL].中國煙草,2013-01-15.http://www.tobacco.gov.cn/html/30/3001/4258838_n.html
[14]煙草全基因組覆瓦式(Tiling)基因芯片設計理念實現及差異基因圖譜繪制[J].中國煙草學報,2013,(2):F0002-F0002.
[15]馬騰飛,林新春.植物SOC1/AGL20基因研究進展[J].浙江農林大學學報,2013,30(6):930-937.
[16]Han P,García-Ponce B,Fonseca-Salazar G,et al.AGAMOUS-LIKE 17,a novel flowering promoter,acts in a FT-independent photoperiod pathway [J].Plant J.2008,55(2):253-65.
[17]Lee D,Polisensky DH,Braam J.Genome-wide identification of touch- and darkness- regulated Arabidopsis genes: a focus on calmodulin-like and XTH genes [J].New Phytologist,2005,165(2):429-444.
[18]Sonmez C,B?urle I,Magusin A,et al.RNA 3’ processing functions of Arabidopsis FCA and FPA limit intergenic transcription[J].Proc Natl Acad Sci USA,2011,108(20):8508-8513.
[19]Willmann M R,Poethig R S.The effect of the floral repressor FLC on the timing and progression of vegetative phase change in Arabidopsis[J].Development,2011,138(4):677-685.
[20]Lee H,Suh S S,Park E,et al.The AGAMOUS-LIKE 20 MADS domain protein integrates floral inductive pathways in Arabidopsis[J].Genes Developme nt,2011,14(18):2366-2376.
[21]Seo E,Lee H,Jeon J,et al.Crosstalk between Cold Response and Flowering in Arabidopsis Is Mediated through the Flowering-Time Gene SOC1 and Its Upstream Negative Regulator FLC [J].ThePlantCell,2009,21:3185–3197.
[22]Tao Zhen,Shen Lisha,Liu Chang,et al.Genomewide identification of SOC1 and SVP targets during the floral transition in Arabidopsis[J].The Plant Journal,2012,70(4):549-561.
[23]An Xinmin,Ye Meixia,Wang Dongmei,et al.Ectopic expression of a poplar APETALA3-like gene in tobacco causes early flowering and fast growth[J].Biotechnology Letters,2011,33(6):1239-1247.
[24]Kelly A J,Bonnlander M B,Meeks-Wagner D R.NFL ,the tobacco homolog of FLORICAULA and LEAFY,is transcriptionally expressed in both vegetative and floral meristems[J].Plant Cell,1995,7:225-234.
[25]艾育芳,陳觀水,周以飛,等.早熟油菜成花相關基因LFY的克隆與分析[J].西北植物學報,2012,32(10):1965-1970.
A preliminary research on screening of premature fowering gene in fue-cured tobacco by microarray
YANG Jing1,2,CHEN Jie3,CHEN Jianjun2,DENG Shiyuan2,QIU Miaowen4,ZHAO Weicai4,WANG Wei2
1 Qiandongnan Zhenyuan County Tobacco Company,Zhenyuan 557700,Guizhou,China;
2 College of Agriculture,South China Agricultural University,Guangzhou 510642,China;
3 Qiandongnan Tobacco Company,Kaili 556000,Guizhou,China;
4 Nanxiong Institute of Tobacco Science,Nanxiong 5124002,Guangdong,China
Agilent Tobacco Oligo Microarray was used to deduce expression profiling of flue-cured tobacco K326 and its premature flowering resistance variety Huayan06,K326LF during flower bud differentiation process.Genes related to flower bud differentiation were screened out: AGL20,CCR2,ELF4,ERD7,CBF1,COR413-PM1,EMF2,VIP4,COL1,AGL17,COL9,FPA andSWN,etc.Among them,COL2 and ELF4 had 5 times difference in terms of expression level while AGL62,CBF1,SWN,NAP had 10 times or above difference with FPA.The study provided a reference for further study of flue-cured tobacco premature flowering resistance mechanism and premature flowering resistance varieties breeding.
flue-cured tobacco;premature flowering;premature flowering resistance;gene chip;gene
楊靜,陳杰,陳建軍,等.利用基因芯片篩選烤煙早花基因初探[J].中國煙草學報,2015,21(3)
國家煙草專賣局重點科技項目“耐低溫抗早花烤煙新品種選育及遺傳生理機理研究”(110200902043);廣東省煙草專賣局(公司)科技項目“耐低溫抗早花烤煙新品種選育”(200816)
楊靜(1988—),碩士研究生,研究方向為煙草遺傳育種, Email:yangjinggzchina@163.com
王維(1972—),博士,副教授,碩士生導師,主要從事煙草生理生化研究,Email: wangwei@scau.edu.cn
2014-08-29
: YANG Jing,CHEN Jie,CHEN Jianjun,et al.A preliminary research on screening of premature flowering gene in flue-cured tobacco by microarray [J].Acta Tabacaria Sinica,2015,21(3)

