紫荊花中多糖的微波提取工藝優化及其抗氧化活性
衛 強,桂 芹,邱 鎮,徐 飛,紀小影
(安徽新華學院藥學院,安徽 合肥 230088)
紫荊花中多糖的微波提取工藝優化及其抗氧化活性
衛 強,桂 芹,邱 鎮,徐 飛,紀小影
(安徽新華學院藥學院,安徽 合肥 230088)
在單因素試驗的基礎上,采用Box-Behnken試驗設計和響應面分析法,研究提取時間、微波功率、液料比對紫荊花中多糖提取量的影響,建立影響因素與響應值之間的數學模型,確立最佳提取工藝。同時,以1,1-二苯基-2-三硝基苯肼自由基清除能力、還原Fe3+能力、羥自由基清除能力驗證紫荊花中多糖的抗氧化活性。結果表明,紫荊花中多糖的最佳提取工藝為:提取時間16 min、液料比40∶1(mL/g)、微波功率2 kW。此條件下提取量可達30.81 mg/g。抗氧化實驗結果表明,紫荊花多糖有一定抗氧化活性。比較微波和煮沸兩種方法提取的紫荊花多糖活性和提取效率,發現微波提取更佳。
紫荊花;微波提取;多糖;響應面法;抗氧化
紫荊花(Cercis chinensis Bunge)系豆科紫荊屬植物,在我國作為景觀植物種植廣泛。紫荊花具有活血通經、消腫止痛、解毒等功效,用于治療月經不調、風濕性關節炎、風濕筋骨痛、鼻中疳瘡等癥[1]。食品工業上還可以提供天然食用紅色素等[2-3]。國內研究表明,紫荊乙醇提取物對癌細胞的細胞周期有明顯抑制作用,并能誘導癌細胞凋亡[4]。另外,紫荊葉提取物具有顯著鎮痛、消炎作用,可增強小鼠耐缺氧和抗疲勞的能力[5]。
研究[6-8]發現,人類90%以上疾病源于氧自由基導致的人體正常細胞和組織損傷,進一步誘發炎癥、腫瘤、帕金森病、老年癡呆癥和心臟病等疾病。多糖及其復合物參與和介導了細胞各種生命活動的調節,具有抗衰老、抑腫瘤、降血脂、降血糖作用[9-10]。國內學者研究證實了紫荊花黃酮類成分的抗氧化活性[11],但對其多糖成分的研究未見報道。本實驗對紫荊花中多糖類成分進行提取和抗氧化研究,以期為進一步開發應用其豐富的資源提供參考。
1 材料與方法
1.1 材料與試劑
紫荊花采自合肥大蜀山區。
葡萄糖 上海士鋒生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 北京索萊寶科技有限公司;其他試劑均為分析純;水為純化水。
1.2 儀器與設備
LDZ4-1.2型低速離心機 北京京立離心機有限公司;KJ-SY-150超聲提取器 北京同德創業科技有限公司;CNWB-C型微波萃取器 廣州萬程微波設備有限公司;UV-4802型紫外-可見分光光度計 美國尤尼柯儀器有限公司。
1.3 方法
1.3.1 微波提取工藝流程
紫荊花(5 g)→低溫烘干,粉碎→紫荊花粗粉→以體積分數90%、60%乙醇溶液分別超聲提取3~4 次→抽濾,棄去濾液,殘渣加水以微波浸提→濃縮→離心→Sevag法除蛋白→紫荊花粗多糖→測定含量
1.3.2 微波提取工藝優化
1.3.2.1 單因素試驗
設定水與紫荊花液料比30∶1(mL/g)、微波功率3 kW,考察不同提取時間(4、8、12、16、20、24 min)對多糖提取量的影響;固定水與紫荊花液料比30∶1(mL/g)、提取時間12 min,研究不同微波功率(0.5、1、2、3、4、5 kW)對多糖提取量的影響;固定提取時間12 min、微波功率3 kW,研究不同液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1)對多糖提取量的影響。
1.3.2.2 響應面試驗
在單因素試驗基礎上,以Box-Behnken試驗設計進行提取,以響應面分析最佳工藝。
1.3.3 多糖含量測定
精密稱取葡萄糖標準品1 g,以水溶解定容于50 mL容量瓶中。精密移取 0.2、0.4、0.6、0.8、1.2、1.4 mL的葡萄糖標準液于25 mL具塞試管中,加蒸餾水至2.0 mL,加入1.0 mL 5%苯酚溶液,加入濃硫酸 5 mL,室溫靜置5 min,再于沸水浴中恒溫15 min。取出,迅速置于冰水中維持10 min。取蒸餾水2.0 mL為參比,如上操作,于490 nm波長處測定吸光度。以吸光度為縱坐標、葡萄糖質量濃度為橫坐標繪制標準曲線,計算含量[12]。多糖提取量計算公式如式(1)所示:
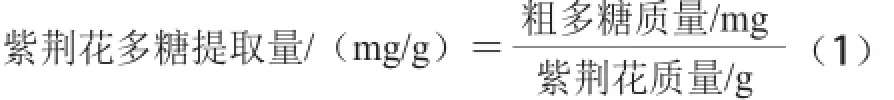
1.3.4 微波與煮沸提取比較
精密稱取紫荊花5 g兩份,一份以提取時間16 min、液料比40∶1、微波功率2 kW為參數,重復提取3次(第1次16 min,第2次8 min,第3次8 min);另一份加入40 倍水煮沸提取3次(第1次2 h,第2次1 h,第3次0.5 h),將不同提取液分別減壓濃縮至約200 mL,按照1.3.1節和
1.3.3 節方法進行純化和含量測定。
1.3.5 紫荊花多糖清除DPPH自由基能力
精密稱定DPPH化合物0.019 2 g,以甲醇溶解,移入250 mL容量瓶,得到濃度為0.2 mmol/mL的溶液,冰箱冷藏,備用。
分別精密稱定紫荊花多糖和VC各0.05 g,以90%乙醇溶解,定容25 mL,再稀釋至5 組不同質量濃度的溶液,分別取1 mL稀釋液,加入1 mL上述濃度為0.2 mmol/mL的DPPH溶液,以90%乙醇溶液為空白,避光反應30 min,于波長517 nm波長處測定吸光度,以式(2)計算自由基清除率[13]。
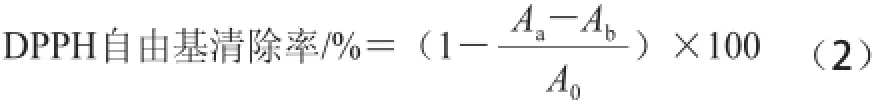
式中:Aa表示樣品溶液吸光度;Ab表示空白溶液吸光度;A0表示VC溶液吸光度。
1.3.6 紫荊花多糖還原Fe3+能力
采用普魯士蘭法測定樣品還原Fe3+能力。取10 mL具塞比色管,依次加入不同質量濃度的紫荊花多糖和VC溶液各2.0 mL、磷酸鹽緩沖液(0.2 mol/L,pH 6.6)2 mL和1 g/100 mL的鐵氰化鉀2 mL,搖勻,于50 ℃水浴中反應20 min,加入10%三氯乙酸2.0 mL,搖勻,離心10 min(2 500 r/min),取上清液2.0 mL,加入2.0 mL蒸餾水和1 g/100 mL的三氯化鐵1.0 mL,以相應試劑為參比,在700 nm波長處測定吸光度[14]。
1.3.7 紫荊花多糖清除羥自由基能力
利用H2O2與Fe2+產生?OH,?OH進一步與水楊酸反應,產生有色產物,該有色成分在510 nm波長處有吸收。
固定反應時間,取相同體積的反應體系溶液(8.8 mmol/L H2O21 mL、9 mmol/L Fe2+1 mL、9 mmol/L水楊酸乙醇溶液1 mL),加入不同質量濃度的紫荊花多糖和VC溶液,以蒸餾水為參比,于510 nm波長處測定吸光度[14],以式(3)計算羥自由基清除率。
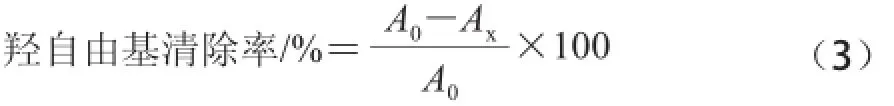
式中:Ax表示樣品溶液吸光度;A0表示VC溶液吸光度。
1.4 數據分析
以Design-Expert 8.0.6統計軟件進行Box-Behnken試驗設計和分析。
2 結果與分析
2.1 單因素試驗結果
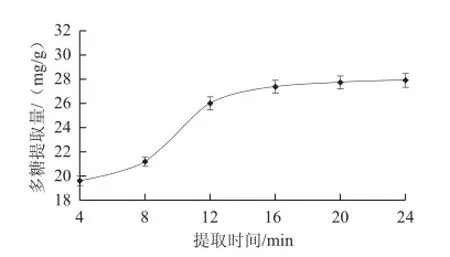
圖1 提取時間對多糖提取量的影響Fig.1 Effect of extraction time on the extraction rate of polysaccharides
2.1.1 提取時間對多糖提取量的影響如圖1所示,隨著提取時間的延長,紫荊花多糖提取量逐步增加。以4~12 min增加較快,16 min后增加緩慢。其原因可能是提取時間延長可明顯提高微波的反射、吸收和穿透效果,提高提取量。當達到提取峰值時,一次提取產生的細胞內外濃度差達到平衡時,提取量不再增加。考慮時間和成本因素,提取時間選擇12~20 min較好。
2.1.2 微波功率對多糖提取量的影響
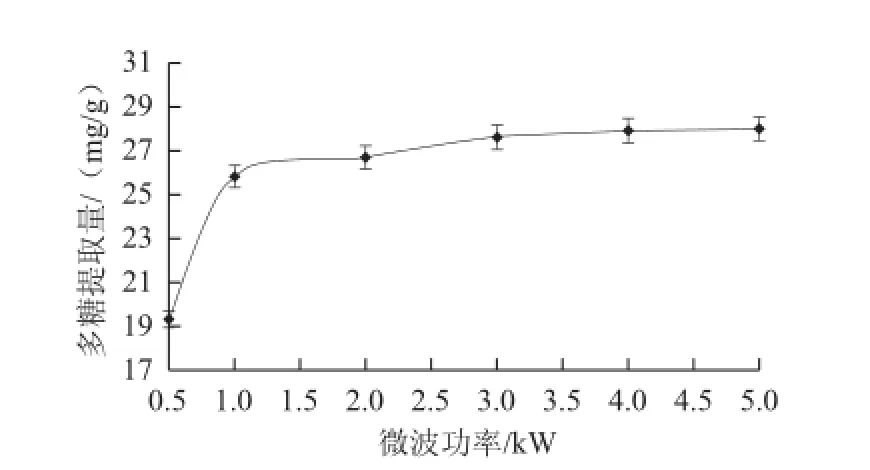
圖2 微波功率對多糖提取量的影響Fig.2 Effect of microwave power on the extraction rate of polysaccharides
如圖2所示,隨著微波功率的增強,紫荊花多糖的提取量逐步增加。在0.5~1.0 kW范圍內多糖提取量增加快速,在1.0~5.0 kW范圍內多糖提取量增加緩慢。這可能是由于0.5~1.0 kW范圍內微波可輻射植物維管束和腺細胞,使細胞內部快速升溫,達到產生膨脹破裂的臨界內壓,在此范圍內破壁能力逐步增強。但大于3 kW后破壁能力達到極限,溶劑揮發加快,反而不利于細胞內含物外溢。考慮成本因素,微波功率選擇1~3 kW較好。
2.1.3 液料比對多糖提取量的影響
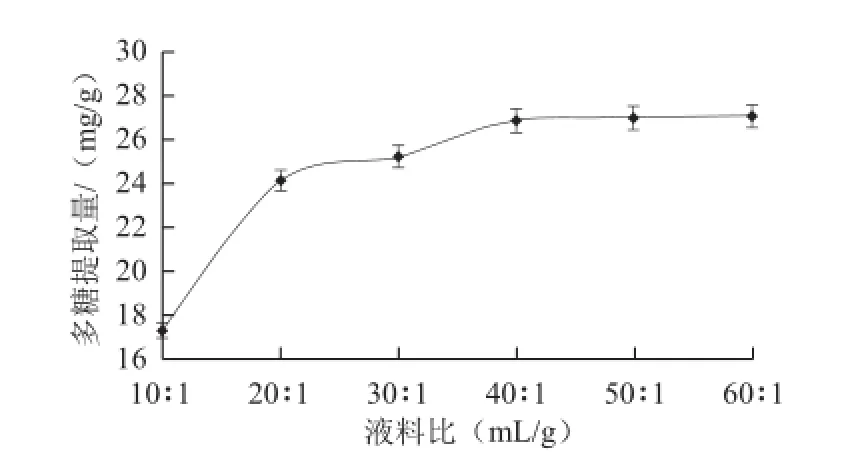
圖3 液料比對多糖提取量的影響Fig.3 Effect of solvent-to-solid ratio on the extraction rate of polysaccharides
如圖3所示,在液料比10∶1~40∶1范圍內,紫荊花多糖提取量快速增加;在液料比40∶1~60∶1范圍內,紫荊花多糖提取量增加緩慢。其原因是液料比增加有利于提高細胞內外的濃度差,提高細胞壁內外物質交換容量,增加提取量。當單次提取接近細胞內外濃度平衡時,提取量增加緩慢。考慮成本因素,液料比選擇30∶1~50∶1較好。
2.2 響應面試驗結果
2.2.1 Box-Behnken試驗設計與結果
由Box-Behnken試驗設計,在單因素試驗基礎上選取提取時間、液料比、微波功率3 個因素考察進行響應面分析,以紫荊花多糖含量為響應值,試驗結果見表1、2。

表1 響應面試驗設計與結果Table1 Experimental deesign and results for respponse surface methodology
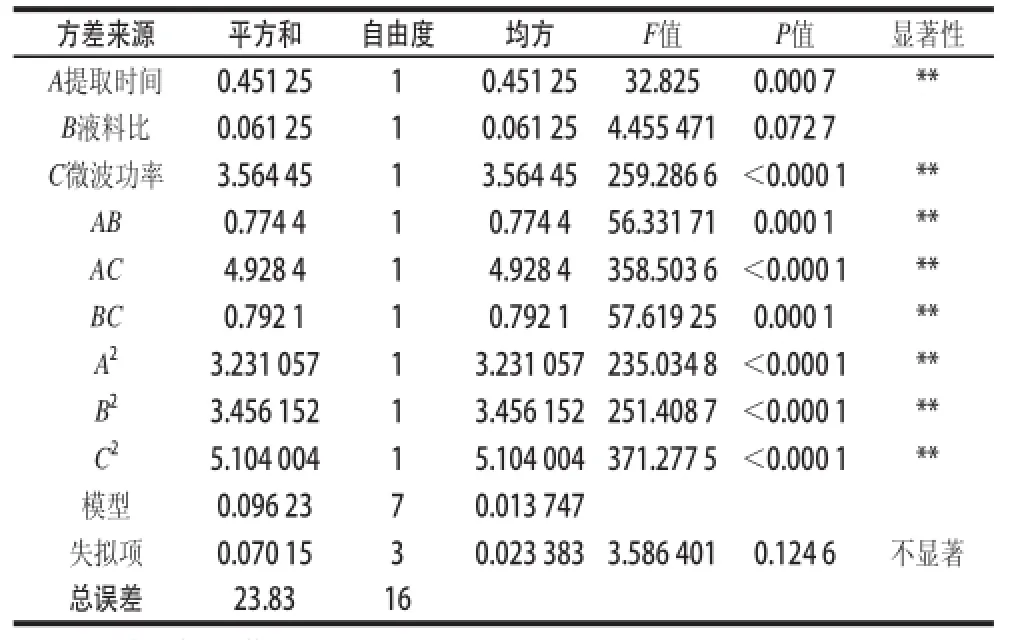
表2 方差分析和顯著性檢驗結果Table 2 Analysis of variaance and significance tess
由表2可知,提取時間、微波功率一次項及提取時間、液料比和微波功率二次項,提取時間與液料比、提取時間與微波功率、液料比與微波功率的交互項P值均小于0.01,說明對提取量的影響極顯著。失擬項檢驗P值顯示不顯著,表明模型充分擬合,受其他因素影響小。經顯著性檢驗,該模型的相關系數R2=0.996 0,說明該模型與實際試驗擬合較好,自變量與響應值線性關系顯著。得到回歸方程如下:
Y=30.08—0.24A+0.087B+0.67C—0.44AB+ 1.11AC—0.44BC—0.88A2—0.91B2—1.10C2
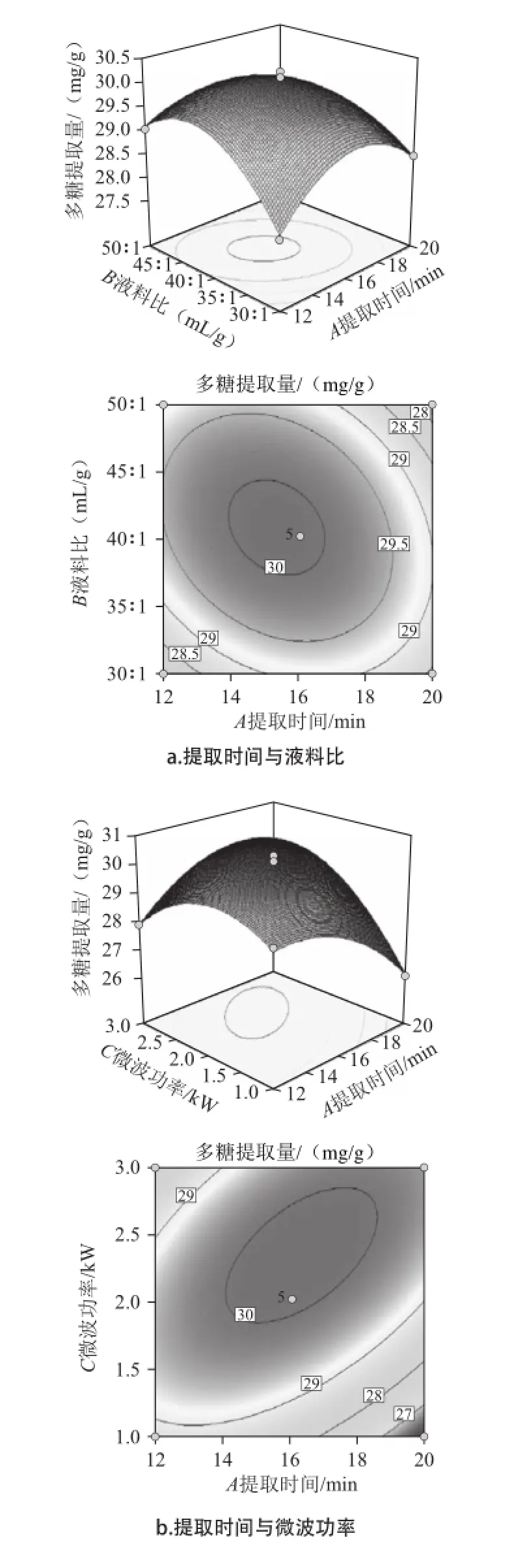
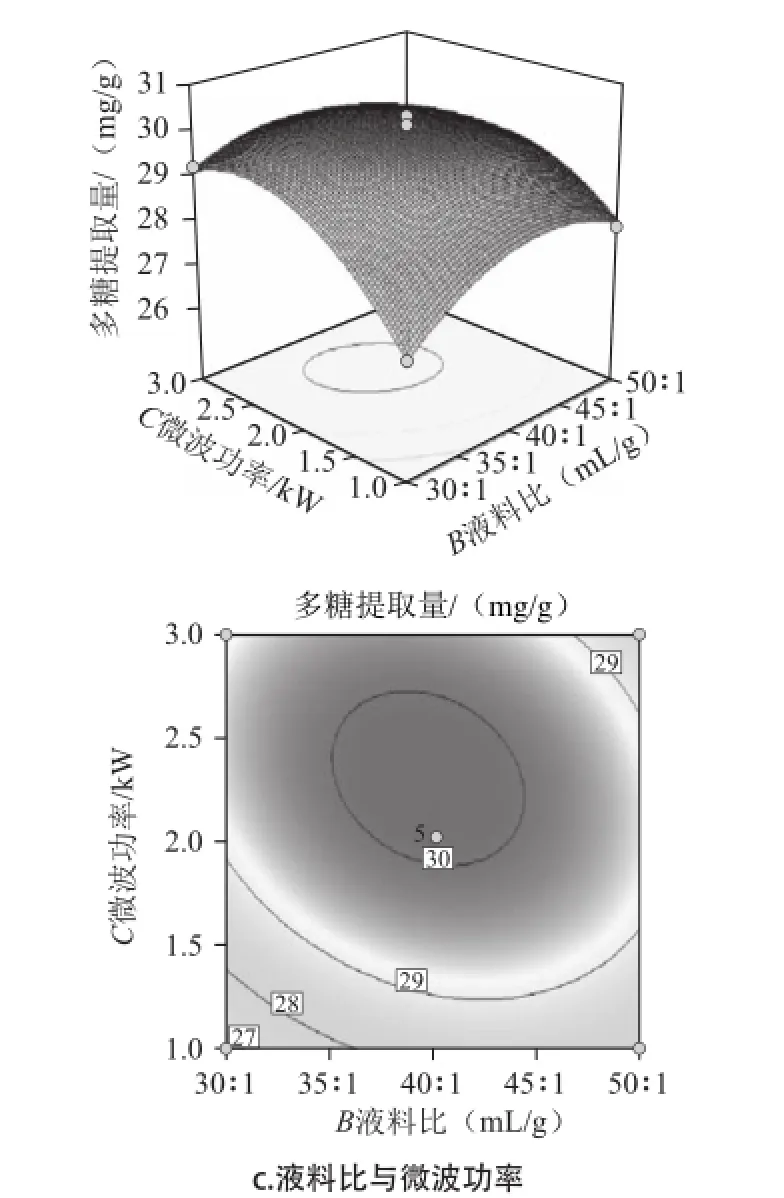
圖4 各因素交互作用對紫荊花中多糖提取的響應面和等高線圖Fig.4 Response surface and contour plots for the interaction effects of extraction parameters on the extraction rate of polysaccharides from Cercis chinensis Bunge
根據回歸分析結果,作出響應面圖,如圖4所示。三組圖直觀地反映了各因素對響應值的影響。響應面圖是響應值Y對應于試驗因素A、B、C所構成的三維空間曲面圖及其在二維平面上的等高線圖,響應面可直觀反映3個因素之間及兩者之間的交互作用對響應值的影響[15]。等高線的形狀可反映出交互效應的強弱,橢圓形表示兩因素交互作用顯著,而圓形則與之相反[16]。結合表2的P值,由圖4a可知,液料比和提取時間交互作用為極顯著水平(P<0.001),等高線呈橢圓形;當微波功率固定,隨著液料比增加和提取時間的延長,多糖提取量呈現先快速提高后緩慢減小的趨勢。從等高線上看,提取時間16 min、液料比40∶1附近值對提高含量有重要影響。由圖4b可知,微波功率和提取時間交互作用為極顯著水平(P<0.000 1),等高線橢圓形;當液料比固定,隨著微波功率增加和提取時間的延長,多糖提取量呈現先快速提高后快速減小的趨勢,提取時間對多糖含量影響較大。從等高線上看,微波功率2 kW、提取時間16 min附近值對提高含量有重要影響。由圖4c可知,微波功率和液料比交互作用為極顯著水平(P<0.001),等高線橢圓形;當提取時間固定,隨著微波功率和液料比兩個因素的增加,多糖提取量呈現先快速提高后緩慢減小的趨勢,表明當達到微波功率2 kW、液料比40∶1后,對多糖提取量影響相對較小。
2.2.2 驗證性實驗及提取次數考察
對試驗模型進行分析,得出紫荊花多糖提取最優工藝參數為提取時間16 min、液料比40∶1、微波功率2 kW,此最優工藝條件下紫荊花粗多糖提取量理論值為30.80 mg/g。采用優化提取條件進行多糖的工藝驗證實驗,測得紫荊花多糖平均提取量為30.81 mg/g(n=3,相對標準偏差1.28%),與理論預測值相比,相對偏差較小。以上述優化條件提取5 次(第1次16 min,后面均為8 min),提取量分別為30.77、26.32、19.10、6.01、2.36、1.06 mg/g,考慮到提取成本,3次提取可滿足工藝要求。
2.3 微波與煮沸提取比較
經過3 次提取,分別得到煮沸法提取多糖(polysaccharide of Cercis chinensis bunge-boiling extraction,PCCB-BE)和微波提取多糖(polysaccharide of Cercis chinensis bunge-microwave extraction,PCCBME),測定含量,分別為52.17、76.16 mg/g,可見微波提取多糖含量較煮沸法高出23.99 mg/g,而時間上較煮沸法提取節省近3 h。
2.4 紫荊花多糖清除DPPH自由基能力

圖5 紫荊花多糖對DPPH自由基的清除能力Fig.5 DPPH radical-scavenging activity of polysaccharides from Cercis chinensis Bunge
由圖5可知,隨著紫荊花多糖和VC質量濃度的增加,對DPPH自由基清除能力逐步增強。當達到50%清除率時,PCCB-ME、PCCB-BE和VC的質量濃度分別為0.468、0.568、0.647 mg/mL,對DPPH自由基清除能力大小依次為PCCB-ME>PCCB-BE>VC。
2.5 紫荊花多糖還原Fe3+能力
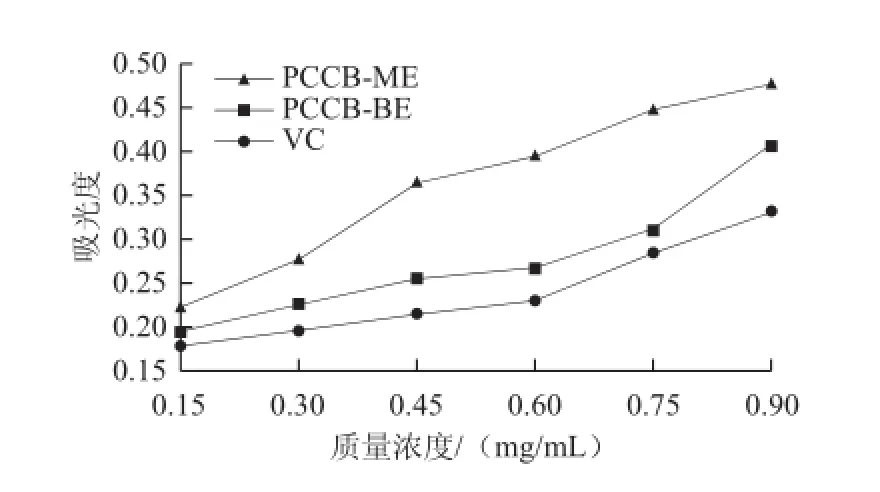
圖6 紫荊花多糖還原Fig.6 Fe3+reducing power of polysaccharides from Cercis chinensis Bunge
由圖6可知,當吸光度為0.3時,PCCB-ME、PCCB-BE和VC的質量濃度分別為0.339、0.618、0.830 mg/mL,可見還原Fe3+能力大小依次為PCCB-ME>PCCB-BE>VC。
2.6 紫荊花多糖清除羥自由基能力
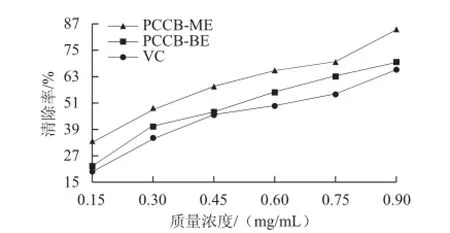
圖7 紫荊花中多糖清除羥自由基能力Fig.7 ?OH radical-scavenging activity of polysaccharides from Cercis chinensis Bunge
由圖7可知,當羥自由基達到50%清除率時,PCCBME、PCCB-BE和VC的質量濃度分別為0.355、0.531、0.608 mg/mL,對羥自由基清除能力大小依次為PCCBME>PCCB-BE>VC。
3 結 論
微波根據所遇介質性質不同會產生反射、吸收和穿透現象[17]。微波輻射植物維管束和腺細胞,使細胞內部快速升溫,內壓提高,細胞壁膨脹破裂,提高溶劑活性細胞,內含物流出而溶解在溶劑中[18-21]。本實驗以微波輔助提取紫荊花中多糖,瞬間破壁作用快速提出多糖成分,以Box-Behnken試驗設計和響應面分析法優選最佳工藝條件為:提取時間16 min、液料比40∶1、微波功率2 kW。以此工藝單次提取得到的紫荊花多糖提取量為30.81 mg/g,3 次提取量為76.16 mg/g。而煮沸法3 次提取的紫荊花多糖平均含量為52.17 mg/g,且提取時間較微波提取長3 h。
目前,合成抗氧化劑(如丁基羥基茴香醚)有致毒和致癌性[22-23]。天然多糖能平衡機體氧化反應,可通過直接清除活性氧,絡合產生活性氧所必須的金屬離子等途徑實現抗氧化作用[24-26],且無毒副作用。本實驗考察了微波提取紫荊花多糖清除DPPH自由基、清除羥自由基和還原Fe3+能力3個方面的作用,當清除DPPH自由基和羥自由基達到50%清除率時,PCCB-ME質量濃度最低(分別為0.468、0.355 mg/mL),當還原Fe3+吸光度為0.3時,PCCB-ME質量濃度最低(0.339 mg/mL),證實微波提取的紫荊花多糖具有明顯的抗氧化活性優勢。這可能是由于微波為高效、瞬時提取,而煮沸法由于長期高溫氧化破壞多糖結構的完整性,進而影響到其活性。
[1] 謝宗萬. 全國中草藥匯編: 下冊[M]. 2版. 北京: 人民衛生出版社, 1996: 617.
[2] 李尚德, 關雄泰, 徐美亦. 紫荊花微量元素含量測定[J]. 廣東醫學院學報, 1994, 12(2): 142-143.
[3] 康四和, 鄧海英. 湖北紫荊皮植物學及生藥鑒定研究[J]. 時珍國醫國藥, 2010, 21(1): 185-187.
[4] 袁云香. 紫荊的應用價值與栽培研究[J]. 林業實用技術, 2012(4): 49-51.
[5] 張穎, 張立木, 李同德, 等. 紫荊葉對模型小鼠的消炎鎮痛及耐缺氧抗疲勞作用研究[J]. 中國藥房, 2009, 20(36): 2817-2818.
[6] 鄧薏. 近五年國內中藥抗氧化作用研究進展: 上[J]. 中藥藥理與臨床, 2012, 28(6): 155-162.
[7] NYSTROM T. The free-radical hypothesis of aging goes prokaryotic[J]. Cellular and Molecular Life Science, 2003, 60(7): 1333-1341.
[8] 劉潔, 李文香, 王文亮, 等. 生物多糖研究進展[J]. 山東農業科學, 2011(5): 98-101.
[9] 羅祖友, 吳季勤, 吳謀成. 植物多糖的抗氧化與抗病毒活性[J]. 湖北民族學院學報: 自然科學版, 2007, 25(1): 77-81.
[10] KOH J H, KIM K M, KIM J M, et al. Antifatigue and antistress effects of the hot-water extract from mycelia of Cordyceps sinensis[J]. Biological and Pharmaceutical Bulletin, 2003, 26(5): 691-694.
[11] 陳志紅, 徐美奕, 龔先玲. 紫荊花黃酮類化合物體外抗氧化活性研究[J]. 化學世界, 2010(7): 401-403.
[12] 湯彬, 薛平, 李祥, 等. 南方紅豆杉多糖的含量測定及體外降血糖活性研究[J]. 食品工業科技, 2013, 34(9): 128-131; 136.
[13] 宋海璐, 周瓊花, 嚴婷婷, 等. 夏枯草色素的抗氧化活性研究[J]. 中國野生植物資源, 2013, 32(3): 33-34.
[14] 王冬梅, 呂振江, 王永紅, 等. 不同炮制方法對玉竹提取物得率及體外抗氧化作用的影響[J]. 植物研究, 2012, 32(5): 621-626.
[15] 喬孟, 屈曉清, 丁之恩. 響應面法優化超聲波輔助提取湖北海棠葉中總黃酮工藝[J]. 食品科學, 2013, 34(2): 143-147.
[16] 杜玉蘭, 黎慶濤, 王遠輝. 響應曲面法優化鼠尾藻中脂質的提取工藝[J]. 天然產物研究與開發, 2008, 20(6): 1091-1094.
[17] 鄧湘慶, 龔盛昭. 微波輔助萃取中藥有效成分的研究進展[J]. 廣東化工, 2006, 33(12): 89-92.
[18] JOCELYN PAR? J R, MICHEL S, JACQUES L. Microwave-assisted natural products extraction: US, 5002784[P]. 1991-03-26.
[19] JACOB J, CHIA L H L, BOEY F Y C. Review-thermal and nonthermal interaction of microwave radiation with materials[J]. Journal of Materials Science, 1995, 30: 5321-5327.
[20] 郝金玉, 韓偉, 鄧修. 新鮮銀杏葉經微波輔助提取后微觀結構的變化[J]. 中草藥, 2002, 33(8): 739-741.
[21] GAO Shan, HAN Wei, DENG Xiu. Study of the mechanism of microwave-assisted extraction of Mahonia bealei (Fort.) leaves and Chrysanthemum morifolium (Ramat.) petals[J]. Flavour and Fragrant Journal, 2004, 19(3): 244-250.
[22] SAITO M, SAKAGAMI H, FUJISAWA S. Cytotoxicity and apoptosis induction by butylated hydroxyanisole (BHA) and butylated hydroxytoluene (BHT)[J]. Anticancer Research, 2003, 23(6C): 4693-4701.
[23] ZHANG Hao, JIANG Lu, YE Shu, et al. Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube from China[J]. Food and Chemical Toxicology, 2010, 48(6): 1461-1465.
[24] 鄭德勇, 安鑫南. 植物抗氧化劑研究展望[J]. 福建林學院學報, 2004, 24(1): 88-91.
[25] 楊玉紅, 郝慧敏. 藥用植物多糖的生物學功能及應用研究進展[J].生物學教學, 2013, 38(1): 6-8.
[26] TSUDA T, SHIGA K, OHSHIMA K. Inhibition of lipid peroxidation and active oxygen radical scavenging effect of anthocyanin pigments isolated from Phaselous vulgaris L.[J]. Biochemical Pharmacology, 1996, 52: 1033-1039.
Microwave-Assisted Extraction and Antioxidant Activities in vitro of Polysaccharides from Cercis chinensis Bunge Flowers
WEI Qiang, GUI Qin, QIU Zhen, XU Fei, JI Xiaoying
(College of Pharmacology, Anhui Xinhua University, Hefei 230088, China)
The microwave-assisted extraction of polysaccharides from Cercis chinensis Bunge flowers was optimized with the combined use of single-factor method and response surface methodology based on Box-Behnken design. A regression surface model was developed indicating the effects of three operating parameters on extraction efficiency. The antioxidant activity of the extracted polysaccharides was evaluated by DPPH, hydroxyl radical scavenging and Fe3+reducing power assays. The optimal extraction conditions were determined as a solvent to flower ratio of 40:1 (mL/g), 16 min extraction time and 2 kW microwave power, resulting in an extraction yield of 30.81 mg/g. Antioxidant tests indicated that the polysaccharides obtained by microwave-assisted extraction had antioxidant activity higher than that of those extracted by boiling. Moreover, the former method gave a higher yield of polysaccharides.
Cercis chinensis Bunge; microwave-assisted extraction; polysaccharides; response surface analysis; antioxidant activity
TS201.1
A
1002-6630(2015)04-0039-06
10.7506/spkx1002-6630-201504008
2014-07-09
國家大學生創新創業訓練項目(201312216028;201312216029);安徽省質量工程項目(2013gxk105);安徽新華學院質量工程項目(2013gxkcx01)
衛強(1977—),男,副教授,碩士,主要從事藥學教學與科研。E-mail:weiqiang509@sina.com

