神經酰胺在非酒精性脂肪性肝病中的作用研究進展
劉浩雷綜述,陽學風審校
(南華大學附屬南華醫院消化內科,湖南衡陽421002)
神經酰胺在非酒精性脂肪性肝病中的作用研究進展
劉浩雷綜述,陽學風審校
(南華大學附屬南華醫院消化內科,湖南衡陽421002)
肝病;乙醇;脂肪類/代謝;神經酰胺類;胰島素;細胞凋亡;綜述
非酒精性脂肪性肝病(NAFLD)在歐美國家已取代病毒性肝炎,成為最主要的肝病[1]。近年來研究表明,神經酰胺能阻斷胰島素信號轉導,誘發胰島素抵抗(IR)和炎性反應,提示神經酰胺可能對NAFLD的發病起著重要的作用[2-3]。因此,本文就近年來神經酰胺與NAFLD的研究作一綜述。
1 神經酰胺生理功能與合成
神經酰胺由長鏈脂肪酸和鞘氨醇鏈接而成,是細胞膜的組成成分,同時,其作為重要的第二信使參與了細胞增殖、分化和凋亡活動。神經酰胺主要由3種途徑產生:從頭合成途徑、鞘磷脂循環途徑和鞘氨醇合成途徑(圖1)。從頭合成途徑主要發生在內質網或線粒體中,首先是絲氨酸與棕櫚酰輔酶A在絲氨酸棕櫚酰轉移酶(SPT)催化下形成3-酮-二氫鞘氨醇,再依次轉化為二氫鞘氨醇、二氫神經酰胺,最后形成神經酰胺。其中SPT是從頭合成的限速酶[4-5]。鞘磷脂循環途徑是鞘磷脂(SM)在鞘磷脂酶(SMase)作用下分解為神經酰胺和磷酸膽堿;而神經酰胺和磷酸膽堿又可在鞘磷脂合成酶作用下合成為SM,因此稱為鞘磷脂循環。另外,鞘氨醇在神經酰胺合成酶作用下形成神經酰胺,同時,神經酰胺也可分解為鞘氨醇,鞘氨醇進一步磷酸化成鞘氨醇-1-磷酸(S1P),S1P能促進細胞生長和增殖,與神經酰胺主要促細胞凋亡的作用相反[6]。
神經酰胺與氧化應激和炎性反應密切相關。谷胱甘肽等抗氧化劑通過抑制二氫神經酰胺還原酶阻止神經酰胺的生成[7]。脂多糖、炎癥因子(如TNF-α、IL-1)和氧化應激則通過增加SPT的表達和活性,促進神經酰胺的生成[8]。TNF-α還能激活ASMase或NSMase刺激神經酰胺的合成,使炎癥細胞聚集于肝臟導致炎性反應加重[9]。其他促炎性細胞因子(如IL-1、IL-6)也能誘導神經酰胺生成,引起炎性反應[10]。而抗炎性細胞因子脂聯素能激活神經酰胺酶,使神經酰胺分解為鞘氨醇,繼而磷酸化為S1P,降低神經酰胺的含量,使肝臟的炎性反應減輕[11]。
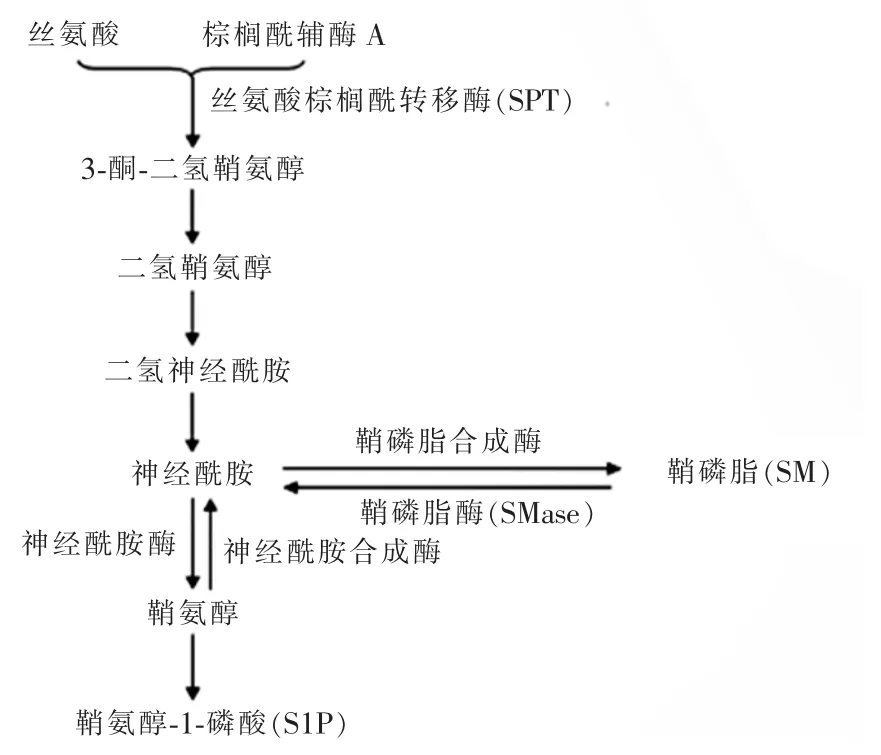
圖1 神經酰胺合成途徑
2 神經酰胺與脂毒性
肝細胞脂肪變的主要機制是外周脂肪組織的脂肪分解加速,導致回流至肝臟中的游離脂肪酸(FFA)增加。FFA在肝臟轉化為不同的脂類如三酰甘油(TG)等,然后TG以極低密度脂蛋白(VLDL)的形式從肝臟輸出。然而,當FFA輸入肝臟的量遠超過VLDL的輸出量時,則會導致肝內脂類(包括TG和神經酰胺)堆積,這些在肝臟堆積的脂類能引起肝細胞功能障礙甚至死亡即脂毒性。研究發現,NAFLD患者肝內飽和脂肪酸(如軟脂酸)和不飽和脂肪酸(如油酸)的含量明顯高于健康人[12-13]。有文獻報道,H4IIE大鼠肝癌細胞經飽和脂肪酸(軟脂酸或硬脂酸)處理后其細胞內的神經酰胺明顯增加[14]。Chocian等[15]采用高脂飼料喂養大鼠,發現其肝細胞內神經酰胺和SM的含量明顯增加。相反,應用多球殼菌素阻斷神經酰胺的從頭合成途徑,能減輕高脂喂養老鼠肝內的脂肪沉積[16]。另外,不同類型的脂肪酸也影響神經酰胺的生成。Hollang等[17]分別采用豬油(飽和脂肪酸)和大豆油(主要是不飽和脂肪酸)喂養大鼠,發現豬油喂養的大鼠肝內神經酰胺含量明顯高于大豆油喂養的大鼠。除了高脂肪飲食能引起神經酰胺生成外,神經酰胺也可由細胞因子如TNF-α誘導產生,TNF-α參與了細胞凋亡死亡受體信號通路,同時能激活炎性反應的信號通路[18]。上述研究表明,FFA回流肝臟與神經酰胺的生成可能存在一定的聯系,但目前還不清楚是肝脂肪變導致了神經酰胺的增加,還是神經酰胺的增加誘導了脂肪組織的IR,從而引起FFA沉積和脂毒性。
3 神經酰胺與IR
IR是外周組織和靶器官(主要是肝臟)對胰島素的敏感性和反應性降低的一種代謝狀態。生理情況下胰島素主要是通過Akt/PKB途徑發揮生理效應,胰島素與細胞膜上的胰島素受體結合,通過胰島素受體底物蛋白(IRS)激活磷脂酰肌醇3-激酶(PI3K),后者再激活Akt,活化的Akt主要有以下生物效應:(1)促進葡萄糖轉運體囊泡(主要是GLUT4)易位至細胞膜并與細胞膜融合,從而有利于葡萄糖轉運至細胞內;(2)激活糖原合成酶激酶-3(GSK-3)促進糖原的合成;(3)激活磷酸二酯酶3B(PDE3B),抑制脂肪分解(圖2)。研究表明,神經酰胺能抑制骨骼肌和肝臟的胰島素信號轉導,還能抑制GLUT4的易位,使GLUT4不能固定至細胞膜上影響骨骼肌細胞對葡萄糖的攝取[19]。另外,神經酰胺能增加使Akt失活的蛋白磷酸酶2A(PP2A)的活性[20]。有研究發現,將肝細胞經短鏈神經酰胺處理后Akt和葡萄糖激酶活性均降低,而葡萄糖激酶是己糖激酶的同工酶,其能使葡萄糖磷酸化,從而有利于葡萄糖的攝取和糖原的合成[21]。反之,采用多球殼菌素抑制神經酰胺合成則能促進AKt的磷酸化[16]。Hollad等[17]發現,地塞米松除了能誘導大鼠肝內神經酰胺含量增加外,還能抑制Akt信號通路,而該抑制作用能用多球殼菌素逆轉。因此,上述研究表明,神經酰胺可能是通過抑制Akt的活性參與了IR的形成,該抑制作用可能是神經酰胺上調IκBk和JNK基因的表達所致,因為IκBk和JNK能阻止胰島素信號轉導,是促進IR的細胞因子[21]。
4 神經酰胺與線粒體活性氧(ROS)生成
生物體內絕大多數的氧分子在線粒體中被消耗,線粒體也是產生ROS的一個重要部位。研究發現,氧化應激會引起非酒精性脂肪性肝炎(NASH)患者線粒體的結構和功能異常,其中呼吸鏈電子漏途徑產生的超氧陰離子自由基和過氫氧化合物是ROS的重要來源。Colombini等[22]發現,短鏈神經酰胺對線粒體具有毒性作用,神經酰胺能在線粒體外膜形成穩定的跨膜通道,導致線粒體膜的通透性增加和細胞色素C釋放。也有研究發現,TNF-α能誘導神經酰胺的生成增加,而加入抗氧化劑GSH后能減少神經酰胺的形成,同時減輕神經酰胺對線粒體的損傷作用[23]。通過建立ASMase-/-小鼠模型,增加TNF-α濃度并不能使小鼠肝臟內的ROS生成增加,說明TNF-α通過激活ASMase刺激神經酰胺的生成,繼而引起線粒體中ROS生成增加,同時也說明ASMase在ROS的形成過程中發揮了重要作用[24]。
5 神經酰胺與肝細胞凋亡
肝細胞凋亡有死亡受體途徑、線粒體途徑和內質網應激3種途徑,其中死亡受體途徑是肝細胞凋亡的主要途徑[25]。神經酰胺在電離輻射、紫外線、化學試劑、自由基、TNF-α和FAS配體等誘導的細胞凋亡過程中充當第二信使[26]。肝細胞凋亡后,肝星狀細胞通過吞噬凋亡細胞而發生表型改變,成為活化的肝星狀細胞,釋放大量細胞因子如TGF-β、TNF-α、PDGF、IL-1、IL-6導致炎癥和纖維化,其炎癥和纖維化程度與凋亡呈正相關[27]。另外,TNF-α能激活溶酶體型ASMase,使細胞內神經酰胺增加,后者激活組織蛋白酶D,進一步導致線粒體的滲透性增加,釋放出細胞色素C,繼而引起caspase級聯反應誘導細胞凋亡[28]。NAFLD還可因增多的游離脂肪酸誘導轉谷氨酰胺酶2(TGase2)的表達,啟動內質網應激PERK通路引起細胞凋亡[29]。由此可見,神經酰胺通過不同的途徑誘導肝細胞凋亡。
6 神經酰胺的臨床研究
目前對NAFLD相關的神經酰胺的臨床研究較少,大部分是肥胖與神經酰胺的研究。研究表明,肥胖患者肝內神經酰胺含量明顯升高;脂肪肝患者肝內神經酰胺含量也高于健康人[29]。相反,肥胖患者通過有氧鍛煉減肥或手術減肥后肝內神經酰胺的含量較減肥前明顯減少[30]。也有研究發現,肥胖合并2型糖尿病患者的血清神經酰胺水平較健康人明顯升高,并且神經酰胺含量與IR程度和TNF-α含量呈正相關,這可能與TNF-α能誘導IR,從而引起FFA回流肝臟增加有關,而且神經酰胺通過正反饋機制導致體內TNF-α進一步增加[31]。以上臨床研究均表明,神經酰胺在肥胖、2型糖尿病和代謝綜合征發病過程中發揮了重要作用,提示神經酰胺在NAFLD的發病過程可能也起著相似的作用。
7 展望
神經酰胺作為第二信使參與了IR、氧化應激、炎性反應和細胞凋亡過程,而IR、氧化應激、炎性反應和細胞凋亡與NAFLD的發病密切相關。另外,在NAFLD發病過程中,促炎性細胞因子TNF-α和IL-6水平增加和抗炎性細胞因子脂褐素水平下降的同時伴隨著神經酰胺水平的升高,這些細胞因子水平的變化可能導致神經酰胺生成增加,而神經酰胺則可能通過正反饋作用進一步加重NAFLD患者的炎性反應、IR、線粒體功能障礙和氧化應激而導致惡性循環,從而促使單純性脂肪肝發展至NASH;當損傷作用超過肝臟修復能力時,細胞壞死或凋亡則不可避免,肝星狀細胞在活化吞噬凋亡細胞的同時分泌細胞外基質,最終促使肝纖維化的形成。因此,將血清神經酰胺水平作為NAFLD特別是NASH的無創性診斷指標,選擇性神經酰胺抑制劑作為NAFLD新的治療藥物,是進一步的研究目標。
[1]沈峰,范建高.2013年非酒精性脂肪性肝病新進展[J].中華肝臟病雜志,2014,22(3):178-180.
[2]Boon J,Hoy AJ,Stark R,et al.Ceramides contained in LDL are elevated in type 2 diabetes and promote inflammation and skeletal muscle insulin resistance[J].Diabetes,2013,62(2):401-410.
[3]Birkenfeld AL,Shulman GI.Nonalcoholic fatty liver disease,hepatic insulin resistance,and type 2 diabetes[J].Hepatology,2014,59(2):713-723.
[4]Vinodh R,Hannun YA.Sphingolipid metabolism and signaling as a target for cancer treatment[J].Cell Death Dis,2013,28(4):205-229.
[5]Venable ME.Elevation of Ceramide in Senescence:Role of Sphingolipid Metabolism[J].Tumor Dormancy,2014,32(2):81-88.
[6]Go?i FM,Sot J,Alonso A.Biophysical properties of sphingosine,ceramides and other simple sphingolipids[J].Biochem Soc Trans,2014,42(5):1401-1408.
[7]Airola MV,Hannun YA.Sphingolipid metabolism and neutral sphingomyelinases[J].Handb Exp Pharmacol,2013(215):57-76.
[8]Chang ZQ,Lee SY,Kim HJ,et al.Endotoxin activates de novo sphingolipid biosynthesis via nuclear factor kappa B-mediated upregulation of Sptlc2[J].Prostaglandins Other Lipid Mediat,2011,94(1/2):44-52.
[9]Schwabe RF,Brenner DA.Mechanisms of liver injury.I.TNF-α-induced liver injury:role of IKK,JNK,and ROS pathways[J].Am J Physiol Gastrointest Liver Physiol,2006,290(4):G583-589.
[10]Holland WL,Summers SA.Sphingolipids,insulin resistance,and metabolic disease:new insights from in vivo manipulation of sphingolipid metabolism[J].Endocr Rev,2008,29(4):381-402.
[11]Holland WL,Miller RA,Wang ZV,et al.Receptor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin[J].Nat Med,2011,17(1):55-63.
[12]Lake AD,Novak P,Hardwick RN,et al.The adaptive endoplasmic reticulum stress response to lipotoxicity in progressive human nonalcoholic fatty liver disease[J].Toxicol Sci,2014,137(1):26-35.
[13]Puri P,Baillie RA,Wiest MM,et al.A lipidomic analysis of nonalcoholic fatty liver disease[J].Hepatology,2007,46(4):1081-1090.
[14]Wei Y,Wang D,Topczewski F,et al.Saturated fatty acids induce endoplasmic reticulum stress and apoptosis independently of ceramide in liver cells[J].2006,291(2):E275-281.
[15]Chocian G,Chabowski A,endzian-Piotrowska M,et al.High fat diet induces ceramide and sphingomyelin formation in rat′s liver nuclei[J].Mol Cell Biochem,2010,340(1/2):125-131.
[16]Yang G,Badeanlou L,Bielawski J,et al.Central role of ceramide biosynthesis in body weight regulation,energy metabolism,and the metabolic syndrome[J].Am J Physiol Endocrinol Metab,2009,297(1):E211-224. [17]Holland WL,Brozinick JT,Wang LP,et al.Inhibition of ceramide synthesis ameliorates glucocorticoid-,saturated-fat-,and obesity-induced insulin resistance[J].Cell Metabol,2007,5(3):167-179.
[18]Comi C.Fas-mediated T-cell apoptosis in chronic inflammatory demyelinating polyneuropathy[J].J Peripher Nerv Syst,2011,Suppl 1:45-47.
[19]Chiu TT,Sun Y,Koshkina A,et al.Rac-1 superactivation triggers insulinindependent glucose transporter 4(GLUT4)translocation that bypassessignaling defects exerted by c-Jun N-terminal kinase(JNK)-and ceramideinduced insulin resistance[J].J Biol Chem,2013,288(24):17520-17531.
[20]Bikman BT,Summers SA.Ceramides as modulators of cellular and wholebody metabolism[J].J Clin Invest,2011,121(11):4222-4230.
[21]Ribaux PG,Iynedjian PB.Analysis of the role of protein kinase B(cAKT)in insulin-dependent induction of glucokinase and sterol regulatory elementbinding protein 1(SREBP1)mRNAs in hepatocytes[J].Biochem J,2003,376(Pt 3):697-705.
[22]Colombini M.Ceramide channels and their role in mitochondria-mediated apoptosis[J].Biochem Biophys Acta,2010,1797(6/7):1239-1244.
[23]Marí M,Caballero F,Colell A,et al.Mitochondrial free cholesterol loading sensitizes to TNF-and Fas-mediated steatohepatitis[J].Cell Metab,2006,4(3):185-198.
[24]Marí M,Colell A,Morales A,et al.Mechanism of mitochondrial glutathionedependent hepatocellular susceptibility to TNF despite NF-κB activation[J]. Gastroenterology,2008,134(5):1507-1520.
[25]Feldstein AE,Wieckowska A,Lopez AR,et al.Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis:A multicenter validation study[J].Hepatology,2009,50(4):1072-1078.
[26]Castro BM,Prieto M,Silva LC.A simple sphingolipid with unique biophysical properties[J].Prog Lipid Res,2014(54):53-67.
[27]Guicciardi ME,Gores GJ.Apoptosis as a mechanism for liver disease progression[J].Semin Liver Dis,2010,30(4):402-410.
[28]Edelmann B,Bertsch U,Tchikov V,et al.Caspase-8 and caspase-7 sequentially mediate proteolytic activation of acid sphingomyelinase in TNFR1 receptosomes[J].EMBO J,2011,30(2):379-394.
[29]Kuo TF,Tatsukawa H,Matsuura T,et al.Free fatty acids induce transglutaminase 2-dependent apoptosis in hepatocytes via ER stress-stimulated PERK pathways[J].J Cell Physiol,2012,227(3):1130-1137.
[30]Promrat K,Longato L,Wands JR,et al.Weight loss amelioration of nonalcoholic steatohepatitis linked to shifts in hepatic ceramide expression and serum ceramide levels[J].Hepatol Res,2011,41(8):754-762.
[31]Haus JM,Kashyap SR,Kasumov T,et al.Plasma ceramides are elevated in obese subjects with type 2 diabetes and correlate with the severity of insulin resistance[J].Diabetes,2009,58(2):337-343.
10.3969/j.issn.1009-5519.2015.02.021
A
1009-5519(2015)02-0217-04
2014-10-29)
劉浩雷(1978-),男,湖南攸縣人,碩士研究生,主治醫師,主要從事肝硬化防治研究;E-mail:417125944@qq.com。
陽學風(E-mail:yxf9988@126.com)。

