不同齲敏感青少年口腔細菌多樣性分析
張洋洋 何金枝 徐欣 周學東
1.新疆醫科大學附屬口腔醫院牙體牙髓科,烏魯木齊 830054;2.口腔疾病研究國家重點實驗室 華西口腔醫院(四川大學),成都 610041
齲病是口腔細菌、可發酵的碳水化合物和易感牙齒經長時間復雜的相互作用而發生局部破壞的感染性疾病[1]。近年來多個國家的流行病學數據表明齲病患病率正顯著增加,人們面臨一場嚴峻的公共健康危機[2],因此齲病的防治應引起全世界更多的重視。目前關于口腔健康研究中的對象多數是兒童,而關于青少年口腔健康的數據非常少[3]。我國第二次全國口腔健康流行病學抽樣調查報告顯示,12歲青少年的患齲率為48.32%;15歲青少年的患齲率為55.70%;18歲青少年的患齲率男性為55.32%,女性為60.11%[4]。我國第三次全國口腔健康調查報告顯示,12歲青少年的患齲率為28.90%,與前次調查結果相比,雖然情況有所好轉,但口腔健康狀況并沒有從根本上得到改善。因此,關注青少年口腔健康、了解青少年齲病狀態下口腔細菌多樣性的變化對于青少年這一特定群體齲病的防治是非常必要的。
齲病發生的環境因素非常復雜,目前已經達成的醫學共識就是微生物因素:口腔微生物代謝碳水化合物產酸,導致釉質表面的脫礦和再礦化過程失衡[5]。研究口腔內定植細菌種類及其致病潛能是防治齲病的基礎[6]。對不同疾病狀態下口腔微生物組成多樣性的認識,能夠更好地揭示疾病的發病機制[7]。唾液細菌可作為口腔微生物的“指紋”,指示口腔生境內微生物菌群結構的變化[8],且唾液易于采集、保存和運送,并可減少患者的焦慮和不適。
環境樣本中超過99%的細菌無法在實驗室進行培養[9]。變性梯度凝膠電泳(denaturing gradient gel electrophoresis,DGGE)結合聚合酶鏈反應(polymerase chain reaction,PCR)不僅能夠檢測可培養細菌,還能夠檢測出一些稀有的、難培養的細菌,進而更有效地評估微生物多樣性和比較不同環境微生物群落結構的差別。近年來,DGGE技術廣泛應用于微生物多樣性研究中,涉及濕地[10]、草地[11]和食品[12]等各個領域,在口腔微生物多樣性研究中的應用也日趨增多,如齲病[13-14]、牙髓及根尖周病[15-17]和牙周病[18]患者的口腔微生物多樣性研究等。本實驗以唾液為樣本,采用PCR-DGGE指紋圖譜技術對不同齲狀況青少年的唾液樣本進行研究,通過分析不同齲狀況青少年的唾液細菌多樣性差異,初步了解青少年齲病狀態下口腔微生物組成的群體性改變,為針對齲病特定人群進行有效防治提供理論依據。
1 材料和方法
1.1 研究對象的選擇
2011年12月—2012年6月從四川大學華西口腔醫院初診人群中隨機選取20名12~18歲青少年,分為兩組:無齲組和高齲組。無齲組:女孩6名,男孩4名,平均年齡15歲;納入標準:診斷為無齲的青少年(診斷標準:DMFT=0[19])。高齲組:女孩6名,男孩4名,平均年齡15歲;納入標準:診斷為高齲的初診青少年(診斷標準:DMFT≥6[19]);排除標準:有全身性疾病或除齲病以外的任何口腔疾病,或近6個月內使用過抗生素等藥物。本研究經過四川大學華西口腔醫院倫理委員會批準。研究對象或其監護人在取樣前均簽署知情同意書。
1.2 唾液樣本的采集
使用1.5 mL無菌離心管直接收集1 mL非刺激性唾液。指導受試者停止吞咽動作1 min后讓唾液自行流入1.5 mL無菌離心管,重復這一操作過程直至收集到1 mL唾液。樣本冰浴下2 h內轉送至實驗室,-80 ℃冰箱保存備用。
1.3 細菌全基因組DNA提取和PCR擴增
所有樣本室溫解凍,渦旋3 min使樣品充分分散至TE 緩沖液內,棄棉簽留菌懸液備用。使用QIAamp DNA Micro Kit(Qiagen公司,美國)提取細菌全基因組DNA作為模板,使用通用細菌16S rRNA引物Bac1和Bac2為引物[20],引物序列如下。Bac1:5'-ACTACGTGCCAGCAGCC-3',Bac2:5'-GGACTACCAGGGTATCTAATCC-3'。為了防止DNA雙鏈完全解離,需要在Bac1 5'端連接40 bp的“GC夾[21]”,序列如下。Bac1:5'-CGCCCGCCGCGCCCCGCGCCCGTCCCGCCGCCCCCGCCCGACTACGTGCCAGCAGCC-3',Bac2:5'-GGACTACCAGGGTATCTAATCC-3',擴增產物長度為300 bp。每50 μlPCR反應體系包含:純化基因組 DNA(10 ng·μL-1)2 μL、上游及下游PCR引物(25 μmol·L-1)各1 μL、無酶水21 μL、DreamTaqTMPCR Master Mix(2×)(Fermentas公司,立陶宛)25 μL。使用Gradient PCR Thermal Cycle (Eppendorf公司,德國)進行聚合。循環條件為:94 ℃預變性3 min;94 ℃變性1 min,56 ℃退火1 min,72 ℃延伸2 min,30個循環;最后72 ℃延伸5 min。取PCR擴增產物5 μL進行1%瓊脂糖凝膠電泳驗證,Goldview Ⅰ型核酸燃料染色后置長波紫外光下觀察,采用凝膠成像系統(Bio-Rad公司,美國)采集圖像。
1.4 DGGE分析
使用Bio-Rad D-Code系統(Bio-Rad公司,美國)對PCR擴增產物進行DGGE。丙烯酰胺凝膠質量分數為8%,變性劑濃度梯度質量分數為40%~60%(100 %變性劑包含體積分數為40%的甲酰胺與7 mol·L-1的尿素),變性膠上表面加入5 mL無變性作用的積層凝膠。60 V恒定電壓、58 ℃條件下,在1×TAE緩沖液(pH=8.5)中電泳16 h。電泳完成后,0.5 μg·mL-1溴化乙錠染色15 min,1×TAE緩沖液漂洗去除多余染料,凝膠成像系統采集并記錄DGGE 凝膠的數碼圖像。
1.5 DGGE凝膠微生物圖譜分析
使用Quantity One軟件(Bio-Rad公司,美國)標準化DGGE凝膠圖像用于分析條帶模式,得到的最終參數包括檢測到的條帶數、條帶分布的頻率等。
1.5.1 Shannon-Wiener's指數 Shannon-Wiener's指數(H')代表微生物群落多樣性。H'的計算是基于DGGE膠條帶的位置和條帶的強度,計算公式為:H'=-∑PilnPi,條帶的強度(Pi)由凝膠分析軟件Quantity One分析后得到的波峰面積來表示,即Pi=ni/N,其中ni為峰面積,N為所有峰的總面積。
1.5.2 非加權組平均法(unweighted pair-group method with arithmetic mean,UPGMA)聚類分析 使用UPGMA進行聚類分析構建系統進化樹。
1.6 統計學分析
采用SPSS 19.0軟件分析數據,組間條帶數和Shannon-Wiener's指數的比較采用獨立樣本Mann-WhitneyU檢驗,檢驗效能α=0.05。
2 結果
2.1 PCR擴增結果
PCR擴增唾液菌群的16S rDNA,所有樣本均得到預期長度約為300 bp的擴增產物(圖1);擴增產物無明顯拖尾及引物二聚體形成。
圖1 PCR產物瓊脂糖電泳Fig 1 Agarose gel electrophoresis of PCR products
2.2 DGGE圖譜總體特征
圖2為高齲和無齲青少年組唾液菌群的PCRDGGE圖譜。圖中每一泳道代表一個研究對象唾液菌群,不同位置的條帶代表不同的優勢細菌,泳道的條帶數代表該樣本中的優勢菌種的數量。圖2表明:1)個體間唾液細菌中共享的優勢菌群數量較多,圖譜表現為相同位置的條帶在各個體中均有出現;2)唾液細菌的組成同時也具有個體的差異性,圖譜表現為未見到完全相同的泳道出現。
2.3 條帶數比較
10個高齲青少年及10個無齲青少年唾液樣本基因組DNA的DGGE圖譜經過標準化后,共得到76個不同的條帶,各泳道條帶數目介于22~38之間,平均條帶數為29.9±4.3。高齲組和無齲組的條帶數分別為27.3±3.4和32.5±3.7,差異具有統計學意義(P=0.008)。
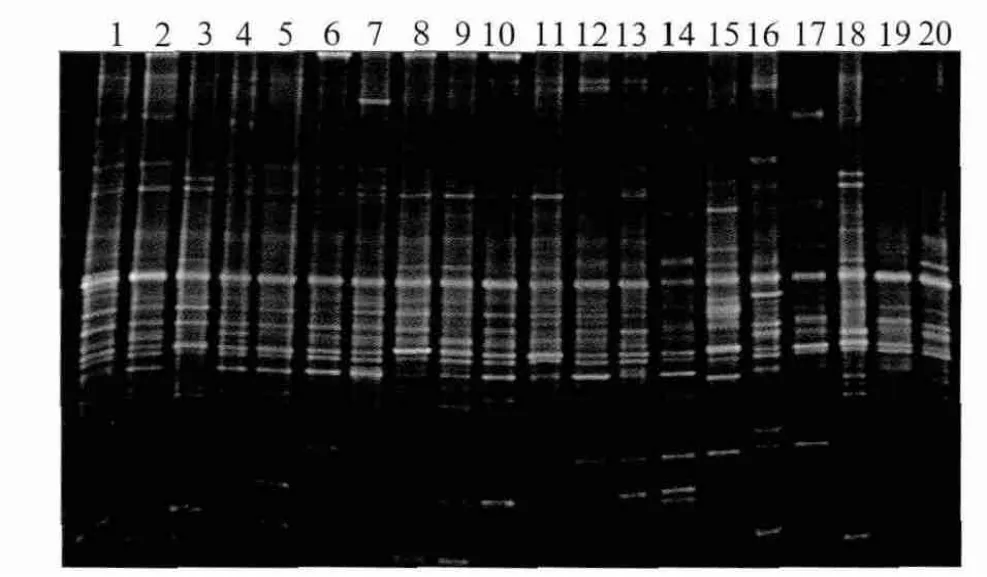
圖2 唾液菌群PCR-DGGE圖譜Fig 2 PCR-DGGE patterns from salivary microbial
2.4 Shannon-Wiener's指數比較
高齲組和無齲組的Shannon-Wiener's指數分別為2.5±0.2和2.6±0.2,二者之間的差異無統計學意義(P=0.405)。
2.5 UPGMA聚類分析
UAPGM聚類分析結果(圖3)表明:3、6、8、9和10號樣本在樹圖中聚成一簇,1、2、4和5號樣本在樹圖中聚成一簇,樣本都來自無齲組;16和18號樣本在樹圖中聚成一簇,11、15和17號樣本在樹圖中聚成一簇,19和20號樣本在樹圖中聚成一簇,7、12和13號樣本在樹圖中聚成一簇,除了7號樣本屬于無齲組以外,其余樣本均來自高齲組。同組內大部分樣本聚類位置相近,群落結構表現出較高的相似性;不同組的大部分樣本未聚類在一起,群落結構呈現出一定的差異。該結果提示唾液細菌的群落結構隨著齲病嚴重程度的增加發生群體性變化,但是每個節點處代表相似性的數字并不是很大,這對聚類分析結果的可信度有一定的影響。
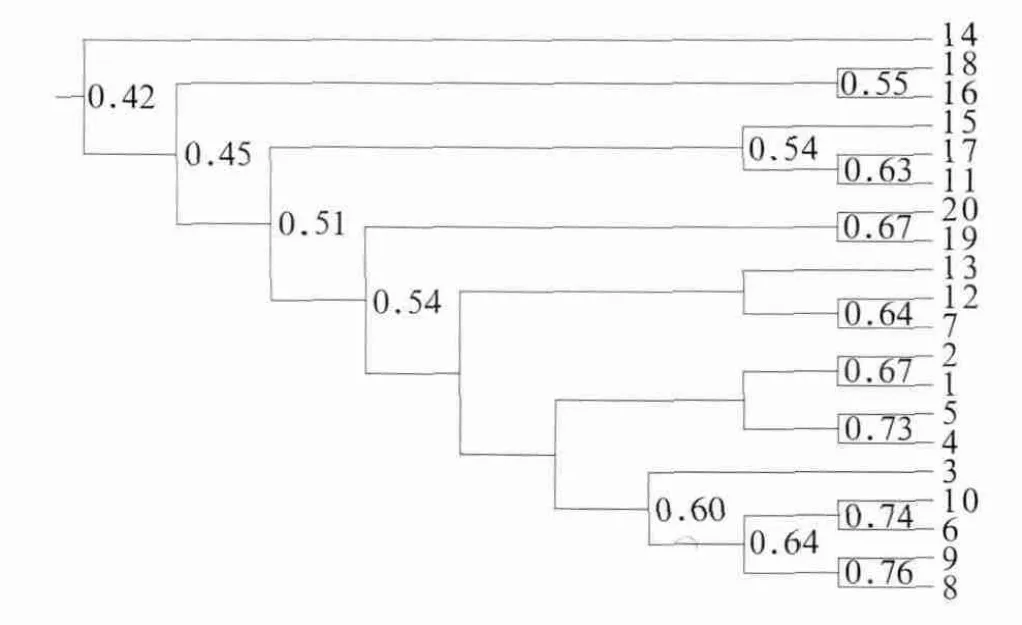
圖3 UPGAM聚類分析Fig 3 Cluster analysis with UPGAM
3 討論
本研究選擇12~18歲青少年為研究對象可以更好地了解恒牙齲對青少年的影響。本研究結果表明:1)頰黏膜菌群的組成具有個體差異性;2)高齲青少年唾液樣本中檢測到的條帶數為27.3±3.4,無齲青少年唾液樣本中檢測到的條帶數為32.5±3.7,高齲青少年唾液中的優勢菌群數量少于無齲青少年唾液中的優勢菌群數量,差異具有統計學意義(P=0.008)。3)高齲青少年唾液細菌多樣性的Shannon-Wiener's指數為2.5±0.2,無齲青少年唾液細菌多樣性的Shannon-Wiener's指數為2.6±0.2,二者之間無統計學差異(P=0.405)。4)群落結構聚類分析表明,同組內大部分樣本聚類位置相近,群落結構表現出較高的相似性;不同組的大部分樣本未聚類在一起,群落結構呈現出一定的差異。
從本研究結果可以看出,高齲青少年唾液細菌的多樣性低于無齲青少年,唾液細菌的多樣性在齲病發展過程中有減少的趨勢。產生這一結果的原因可能是[22-23]:1)在齲病發展過程中,某些細菌被淘汰,導致患齲者菌種數降低;2)患齲者擁有更多的產酸和耐酸菌,抑制了其他菌種;3)齲損部位更有利于齲相關菌的繁殖,導致齲相關菌種類數量上升,而其他菌種類數量降低。
為了探索齲病發生、發展過程中微生物群落結構發生的變化,學者們使用不同的方法對不同的口腔微生物樣本進行了研究。Li等[24]于2005年首次將PCR-DGGE技術應用于齲病相關微生物研究,發現無齲者唾液細菌種類多于齲活躍者唾液細菌種類,這與本研究的結果相同。一些學者[25-26]也得出了相同的結論。但是也有學者[14,19]得出了不同的結論,認為無齲個體的口腔微生物多樣性與有齲個體差異不大。
本研究對不同齲狀況唾液細菌群落的差異進行了分析,確認了在齲病發展過程中齲病相關微生物群落多樣性減少,為青少年齲病相關的微生物學研究提供了參考。由于本研究樣本量不夠大,其結果只能作為齲病發生、發展過程中微生物群體變化的初步探索,今后還需要擴大樣本量、采用更先進的技術對微生物群體的變化過程進行深入研究。
[1]Selwitz RH, Ismail AI, Pitts NB. Dental caries[J]. Lancet,2007, 369(9555):51-59.
[2]Bagramian RA, Garcia-Godoy F, Volpe AR. The global increase in dental caries. A pending public health crisis[J].Am J Dent, 2009, 22(1):3-8.
[3]Pontigo-Loyola AP, Medina-Solis CE, Borges-Ya?ez SA,et al. Prevalence and severity of dental caries in adolescents aged 12 and 15 living in communities with various fluoride concentrations[J]. J Public Health Dent, 2007, 67(1):8-13.
[4]全國牙病防治指導組. 第二次全國口腔健康流行病學抽樣調查[M]. 北京: 人民衛生出版社, 1999:417-424.
[5]Russell RR. Changing concepts in caries microbiology[J].Am J Dent, 2009, 22(5):304-310.
[6]Paster BJ, Olsen I, Aas JA, et al. The breadth of bacterial diversity in the human periodontal pocket and other oral sites[J]. Periodontol 2000, 2006, 42:80-87.
[7]Siqueira JF Jr, R??as IN. Community as the unit of pathogenicity: an emerging concept as to the microbial pathogenesis of apical periodontitis[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009, 107(6):870-878.
[8]Fábián TK, Fejérdy P, Csermely P. Salivary genomics, transcriptomics and proteomics: the emerging concept of the oral ecosystem and their use in the early diagnosis of cancer and other diseases[J]. Curr Genomics, 2008, 9(1):11-21.
[9]Sharma R, Ranjan R, Kapardar RK, et al. Unculturable bacterial diversity: an untapped resource[J]. Curr Sci, 2005,89(1):72-77.
[10]Faulwetter JL, Gagnon V, Sundberg C, et al. Microbial processes influencing performance of treatment wetlands:a review[J]. Ecol Eng, 2009, 35(6):987-1004.
[11]Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environ Sci Technol, 2010, 44(1):15-23.
[12]Ercolini D. PCR-DGGE fingerprinting: novel strategies for detection of microbes in food[J]. J Microbiol Methods, 2004,56(3):297-314.
[13]Li Y, Ge Y, Saxena D, et al. Genetic profiling of the oral microbiota associated with severe early-childhood caries[J].J Clin Microbiol, 2007, 45(1):81-87.
[14]Ling Z, Kong J, Jia P, et al. Analysis of oral microbiota in children with dental caries by PCR-DGGE and barcoded pyrosequencing[J]. Microb Ecol, 2010, 60(3):677-690.
[15]Siqueira JF Jr, R??as IN, Rosado AS. Application of denaturing gradient gel electrophoresis (DGGE) to the analysis of endodontic infections[J]. J Endod, 2005, 31(11):775-782.
[16]Siqueira JF Jr, R??as IN, Debelian GJ, et al. Profiling of root canal bacterial communities associated with chronic apical periodontitis from Brazilian and Norwegian subjects[J]. J Endod, 2008, 34(12):1457-1461.
[17]Zoletti GO, Carmo FL, Pereira EM, et al. Comparison of endodontic bacterial community structures in root-canaltreated teeth with or without apical periodontitis[J]. J Med Microbiol, 2010, 59(Pt 11):1360-1364.
[18]Ledder RG, Gilbert P, Huws SA, et al. Molecular analysis of the subgingival microbiota in health and disease[J]. Appl Environ Microbiol, 2007, 73(2):516-523.
[19]Yang F, Zeng X, Ning K, et al. Saliva microbiomes distinguish caries-active from healthy human populations[J]. ISME J, 2012, 6(1):1-10.
[20]Rupf S, Merte K, Eschrich K. Quantification of bacteria in oral samples by competitive polymerase chain reaction[J].J Dent Res, 1999, 78(4):850-856.
[21]Sheffield VC, Cox DR, Lerman LS, et al. Attachment of a 40-base-pair G + C-rich sequence (GC-clamp) to genomic DNA fragments by the polymerase chain reaction results in improved detection of single-base changes[J]. Proc Natl Acad Sci USA, 1989, 86(1):232-236.
[22]Beighton D. The complex oral microflora of high-risk individuals and groups and its role in the caries process[J].Community Dent Oral Epidemiol, 2005, 33(4):248-255.
[23]Becker MR, Paster BJ, Leys EJ, et al. Molecular analysis of bacterial species associated with childhood caries[J]. J Clin Microbiol, 2002, 40(3):1001-1009.
[24]Li Y, Ku CY, Xu J, et al. Survey of oral microbial diversity using PCR-based denaturing gradient gel electrophoresis[J].J Dent Res, 2005, 84(6):559-564.
[25]Jiang W, Jiang Y, Li C, et al. Investigation of supragingival plaque microbiota in different caries status of Chinese preschool children by denaturing gradient gel electrophoresis[J]. Microb Ecol, 2011, 61(2):342-352.
[26]劉怡然, 王偉健, 沈家平, 等. PCR-DGGE檢測早期兒童齲治療前后口腔菌群多樣性的初步研究[J]. 口腔生物醫學, 2012, 3(4):201-204.

