糖基化終末產物對人牙周膜干細胞骨向分化過程中的Wnt經典信號通路研究
伍燕 鄧超 楊琨 崔曉霞 劉琪 金巖
1.遵義醫學院附屬口腔醫院,遵義 563003;2.貴陽市口腔醫院牙周科,貴陽 550002;3.第四軍醫大學組織工程中心,西安 710032
糖基化終末產物(advanced glycation end products,AGEs)與糖尿病多種并發癥的發生密切相關[1]。近年來,有研究[2]表明糖尿病患者晚期AGEs的大量積聚可促進糖尿病的發展,并且可誘導牙周病的發生和發展。人牙周膜干細胞(human periodontal ligament stem cells,hPDLSCs)具有自我更新和多向分化潛能,在維持牙周結構穩態方面起著重要的作用,其功能數量的變化會導致牙周膜的破壞[3]。研究[4]表明AGEs能使hPDLSCs增殖過程中的Wnt經典通路受到抑制,最終導致該細胞增殖能力有所減弱,AGEs又可以抑制該細胞的成骨分化能力,并在一定范圍內呈濃度依賴性[5]。但AGEs是否影響了hPDLSCs骨向分化過程中的Wnt經典信號通路,目前尚無定論,故本實驗旨在研究AGEs介導下的hPDLSCs骨向分化過程中的Wnt經典通路,并與正常細胞進行比較,從而探討糖尿病牙周炎的發病機制。
1 材料和方法
1.1 主要試劑和儀器
α-MEM培養基、胰蛋白酶(Gibco公司,美國),膠原酶、胎牛血清(杭州四季青生物工程材料有限公司),AGEs-BSA(Bio Vision公司,美國),細胞總RNA提取試劑盒、一步法逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RTPCR)試劑盒(Takara公司,日本),茜素紅(上海化學試劑采購供應站),β-鏈蛋白(β-catenin)兔抗人單克隆抗體(Abcam公司,美國),體式顯微鏡、倒置相差顯微鏡以及照相系統(Olympus公司,日本),流式細胞儀(Beckmen Coulter公司,美國),實時聚合酶鏈反應(real time polymerase chain reaction,real time PCR)儀器(Applied biosystems公司,美國)。
1.2 取材和細胞培養
收集12~18歲因正畸需要而拔除的牙周健康、無齲壞的年輕前磨牙,PBS沖洗后刮取根中1/3牙周膜組織,移入無菌培養皿內,加入少許α-MEN培養液,將牙周膜組織銳性分離,離心后棄上清,加入膠原酶至37 ℃、CO2孵箱中消化15 min,加入正常培養液終止其消化作用,離心后取上清,將分離的組織塊均勻平鋪于6孔板中,以無菌蓋玻片覆蓋組織塊,加入含10%胎牛血清的α-MEM培養液,置37 ℃、5%CO2孵箱中培養,待組織塊周圍有細胞爬出時去除蓋玻片,每3 d換液,待細胞生長達80%時進行傳代。
1.3 有限稀釋法克隆化培養純化hPDLSCs
參照以往文獻報道采用有限稀釋法對hPDLSCs進行克隆分離。首先獲取第一代牙周膜細胞,將第一代牙周膜細胞懸液有限稀釋至密度為每毫升10個,用加樣器向96孔培養板每孔內加0.15 mL,使每孔細胞懸液中約1個細胞,經過37 ℃、5%CO2培養箱中培養,細胞貼壁后在倒置顯微鏡下檢查,挑選含單細胞孔,做標記并補加0.1 mL培養基,待孔中細胞增至占孔底面積l/3~l/2時,常規培養傳代。
1.4 hPDLSCs初步鑒定
取克隆純化的hPDLSCs,棄培養液,PBS洗2次,胰蛋白酶消化3 min,α-MEM培養基終止,800 r·min-1離心5 min,棄上清;再以含3%胎牛血清的PBS重懸細胞,使細胞密度達到每升3.0×109個,分裝到Eppendof管中,每管200 μL的細胞懸液,室溫下每個管加入2 μL的STRO-1、CD14、CD105、CD29小鼠抗人單克隆抗體,避光4 ℃冰箱孵育1 h;再用含3%胎牛血清的PBS清洗3次,1 000 r·min-1離心5 min,最后再以含3%胎牛血清的PBS重懸。使用同型對照單克隆抗體確定背景標記,用流式細胞儀分析熒光細胞,專用的配套軟件計算細胞表面抗原陽性表達率,單位用百分比表示。
1.5 分組成骨誘導后堿性磷酸酶(alkaline phosphatase,ALP)和茜素紅染色
實驗分為正常hPDLSCs組(N-hPDLSCs組)和AGEs刺激的正常hPDLSCs組(A-hPDLSCs組)。N-hPDLSCs組用含10%血清的正常α-MEM培養基培養;A-hPDLSCs組加入含10 μg·mL-1AGEs,10%血清的α-MEM培養基培養。分別取第3代克隆形成細胞以每毫升5×104個的密度接種于6孔板中,待細胞增殖到70%時,按以上分組加成骨誘導液(10 mmol·L-1β-甘油磷酸鈉、10-8mol·L-1地塞米松、50 μg·mL-1維生素C)分別誘導7 d和21 d,每3 d換液一次;對照組細胞不加誘導液,常規培養,7 d后行ALP染色,21 d后行茜素紅染色。
1.6 real time PCR檢測
分別取第3代克隆形成細胞以每毫升5×104個的密度接種于小瓶中,待細胞增殖到70%時,分4組:N-hPDLSCs組(用含10%血清的正常α-MEM培養基培養);Os N-hPDLSCs組(用含有成骨誘導液的10%血清的α-MEM培養基培養);A-hPDLSCs組(用含10 μg·mL-1AGEs,10%血清的α-MEM培養基培養);Os A-hPDLSCs組(用含10 μg·mL-1AGEs,且含成骨誘導液的10%血清的α-MEM培養基培養)。每3 d換液一次,7 d后分別提取RNA,RT-PCR檢測成骨相關基因骨涎蛋白(bone sialoprotein,BSP)、ALP、runt相關轉錄因子2(runt related transcription factor 2,Runx-2)及Dickkopf-1蛋白(DKK-1)、β-catenin表達。用細胞總RNA提取試劑盒一步法提取培養細胞總RNA,β-actin為內參照。參照GenBank數據庫,采用Primer primer 5.0計算機軟件設計引物,由Takara公司(日本)合成,反應條件參考產品說明書,引物序列如下。β-actin上游引物序列:5'-TGGCACCCAGCACAATGAA-3',下游引物序列:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3';Runx-2上游引物序列:5'-CACTGGCGCTGCAACAAGA-3',下游引物序列:5'-CATTCCGGAGCTCAGCAGAATAA-3';ALP上游引物序列:5'-GGACCATTCCCACGTCTTCAC-3',下游引物序列:5'-CCTTGTAGCCAGGCCCATTG-3';BSP上游引物序列:5'-CTGGCACAGGGTATACAGGGTTAG-3',下游引物序列:5'-ACTGGTGCCGTTTATGCCTTG-3';β-catenin上游引物序列:5'-AGGAAGCTTCCAGACACGC-3',下游引物序列:5'-CGCACTGCCATTTTAGCTCC-3';DKK-1上游引物序列:5'-CACTGCATTTGGATAGCTGGTT-3',下游引物序列:5'-GAAGGTCTGTCTTGCCGGATAC-3'。
1.7 Western blot檢測
采用Western blot檢測各組總蛋白中成骨蛋白BSP、Runx-2的表達及核蛋白中β-catenin的表達,采用細胞核蛋白與細胞漿蛋白抽提試劑盒進行核蛋白提取,蛋白含量測定采用Bradeford蛋白濃度測定試劑盒。十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)電泳,轉膜,封閉,免疫反應,最后進行化學發光反應,對2組間相關蛋白表達進行分析。
1.8 統計學分析
采用SPSS 17.0軟件進行統計分析,兩獨立樣本均數比較采用t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1 hPDLSCs的分離與培養
本實驗采用酶解組織塊法培養原代細胞,一般3~10 d組織塊周圍有細胞爬出(圖1),再通過有限稀釋法得到正常的hPDLSCs,該細胞形態呈長梭形,胞核聚集在中心,胞體豐滿,2周左右可達80%匯合。
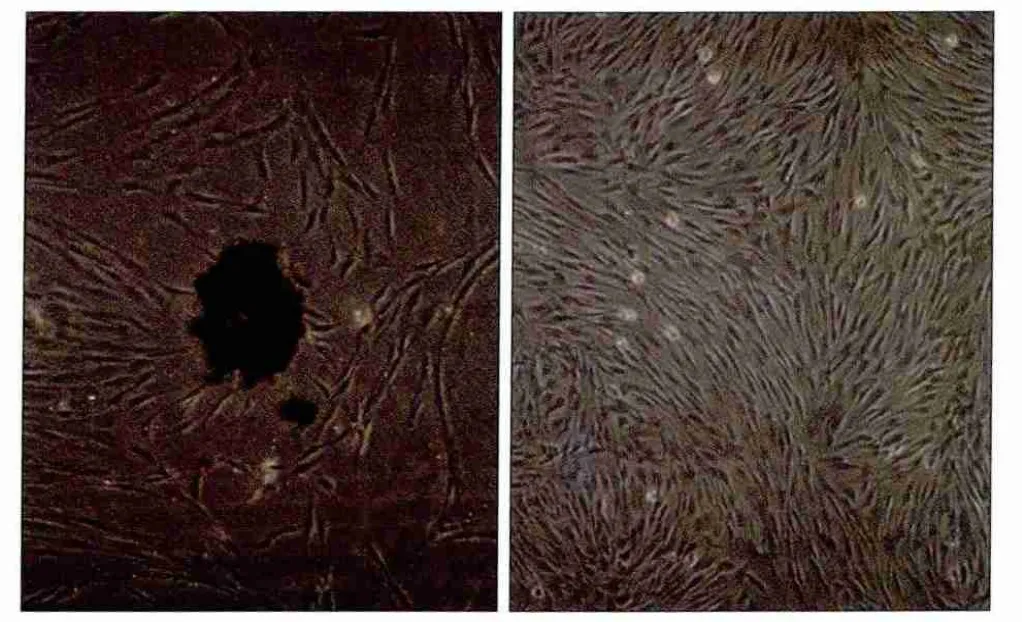
圖1 原代細胞(左)和第一代牙周膜細胞(右)的形態觀察倒置顯微鏡 × 20Fig 1 Morphology of primary cells (left) and the first generation of periodontal ligament cells (right) inverted microscope × 20
2.2 流式細胞儀對干細胞初步鑒定
采用流式細胞儀對表型分子進行鑒定,表面抗原STRO-1、CD14、CD105、CD29陽性率分別為10.4%、0.6%、96.0%、98.4%。
2.3 分組成骨誘導后ALP和茜素紅染色比較
誘導7 d后,進行ALP染色,A-hPDLSCs組明顯淺于N-hPDLSCs組(圖2)。誘導21 d后,比較2組成骨誘導形成的鈣化結節:發現在相同視野下,A-hPDLSCs組形成的鈣化結節明顯少于N-hPDLSCs組(圖3)。
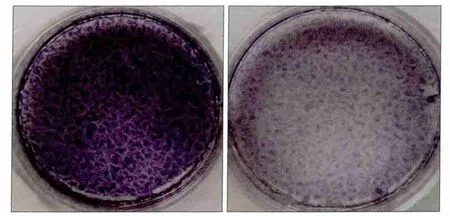
圖2 ALP染色結果Fig 2 ALP staining
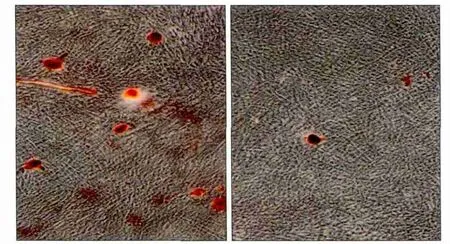
圖3 成骨誘導21 d后,鈣化結節形成 茜素紅染色 × 10Fig 3 After 21 days, the formation of calcified nodules alizarin red staining × 10
定量分析得到,A-hPDLSCs組和N-hPDLSCs組OD值分別為0.145 75±0.036 29、0.538 50±0.033 04,二者間差異有統計學意義(P<0.05)。
2.4 RT-PCR檢測成骨相關基因及Wnt經典通路相關基因表達
通過RT-PCR檢測誘導7 d后的成骨基因,發現A-hPDLSCs組ALP、BSP、Runx-2基因表達均低于N-hPDLSCs組(P<0.05),差異有統計學意義(圖4)。誘導7 d后Wnt經典通路相關基因:N-hPDLSCs組DKK-1明顯上調,β-catenin表達下調,而A-hPDLSCs組DKK-1表達低于N-hPDLSCs組,β-catenin表達高于N-PDLSCs組(P<0.05),差異具有統計學意義(圖4)。

圖4 成骨誘導前后N-hPDLSCs組和A-hPDLSCs組ALP、BSP、Runx-2、DKK-1、β-catenin基因的比較Fig 4 The expression levels of ALP, BSP, Runx-2, β-catenin and DKK-1 between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
2.5 Western blot比較成骨相關蛋白以及細胞核中βcatenin蛋白表達
成骨誘導前后N-hPDLSCs組和A-hPDLSCs組BSP、Runx-2和β-catenin的表達見圖5。
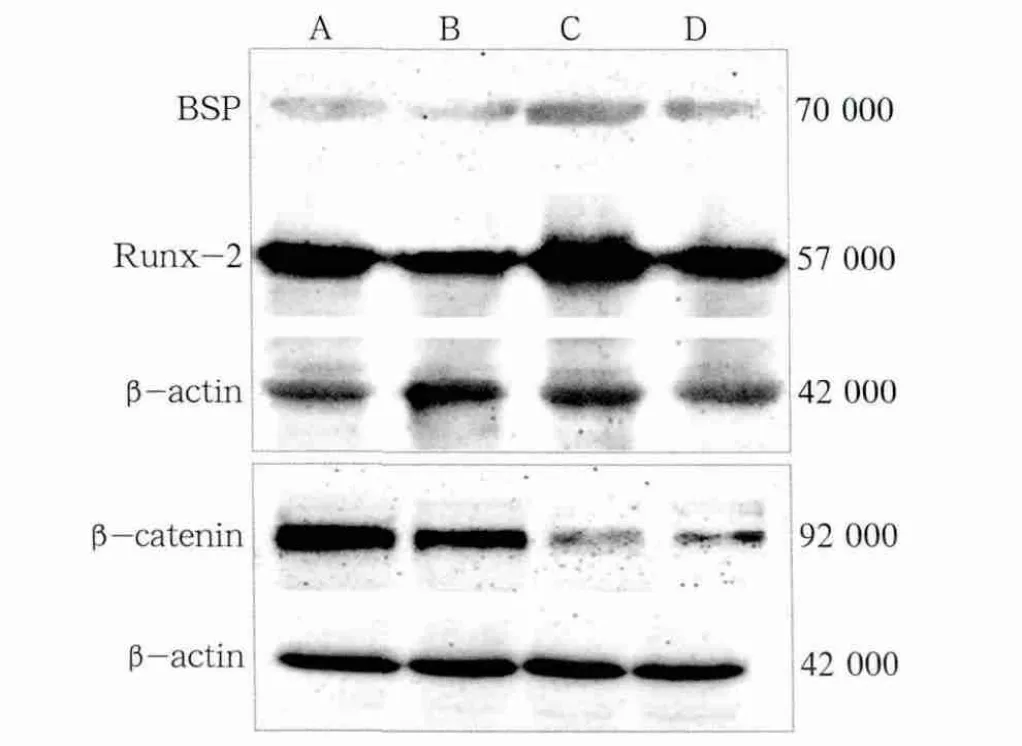
圖5 成骨誘導前后N-hPDLSCs組和A-hPDLSCs組BSP、Runx-2和β-catenin的表達Fig 5 Expression of BSP, Runx-2, β-catenin between N-hPDLSCs and A-hPDLSCs before and after the osteogenic induction
圖5結果顯示,A-hPDLSCs組骨相關蛋白表達都弱于N-hPDLSCs組,N-hPDLSCs組在成骨誘導后細胞核中的β-catenin表達明顯地減弱,成骨誘導后A-hPDLSCs組β-catenin的表達明顯高于N-hPDLSCs組。
3 討論
hPDLSCs是具有自我更新和多向分化潛能,在維持牙周結構穩態方面起著重要的作用,牙周組織再生中最直接、最可靠、最不可缺少的干細胞,具備向其他類型組織細胞分化的潛能,當牙周組織受到損傷后,牙槽骨缺失,hPDLSCs會遷移并且分化為成骨細胞修復牙槽骨的缺損[6]。研究[7-9]顯示,在體外成骨誘導培養的條件下,hPDLSCs能分化為成骨樣細胞,形成鈣化結節,表達一些成骨相關蛋白:骨鈣素、骨橋素、膠原等。
對于糖尿病患者,其AGEs是不斷積累的,在前期的研究結果中表明AGEs能夠在一定濃度上抑制hPDLSCs的成骨分化,并且100 μg·mL-1AGEs刺激該細胞能使該細胞增殖過程中的Wnt經典信號通路受到抑制,為了研究骨分化過程中的信號通路不受到細胞增殖方面的干擾,本實驗選擇10 μg·mL-1AGEs濃度刺激該細胞,首先確認10 μg·mL-1AGEs對該細胞成骨能力的影響,實驗結果顯示體外成骨誘導1周后的ALP染色,A-hPDLSCs組的染色明顯淺于N-hPDLSCs組,并且在誘導3周后,對細胞進行礦化結節染色,鏡下觀察可見,礦化結節在同一個視野下,N-hPDLSCs組礦化結節形成較多且很明顯,而A-hPDLSCs組形成的結節偏少。最后進行定量分析,得到的結果也是A-hPDLSCs組形成的礦化結節少于N-hPDLSCs組細胞;其次,本實驗在成骨誘導7 d后檢測成骨基因ALP、Runx-2、BSP結果顯示,2組細胞在加了成骨誘導液后,成骨基因表達都有所上升,但A-hPDLSCs組成骨基因表達上調不明顯,與N-hPDLSCs組相比較明顯偏低,差異有統計學意義。這種趨勢與成骨能力表象的比較相一致。故在10 μg·mL-1AGEs刺激下,hPDLSCs成骨的能力下調。
各信號通路之間的相互作用決定著干細胞的命運和組織再生,其中的Wnt經典信號通路研究較成熟,該通路由分泌型的Wnt蛋白與卷軸受體結合而起始,最終導致β-catenin在胞漿中穩定積累并大量進入細胞核內激活淋巴增強因子(lymphoidenchancer factor,LEF)/ T細胞因子(T-cell factor,TCF)轉錄因子,激活了該通路,啟動靶基因轉錄[10]。故本實驗主要檢查該通路里細胞核中的β-catenin以確定該信號通路的狀態。
Wnt信號通路在不同類型、不同分化階段中的干細胞作用是不相同的,該信號通路中相關因子的相互作用調控著該條通路的開啟和關閉,最終以達到調節干細胞中相關的基因,從而調控細胞的形態及決定其分化的能力。有研究發現Wnt經典信號通路的激活可以促進成骨:LRP5(是Wnt經典通路通路中主要相關因子)的功能喪失性突變,造成Wnt經典信號通路的抑制,最終導致骨質密度降低,而功能獲得性突變使得Wnt經典信號通路激活則會導致骨質密度增高癥[11];sFRP1基因缺陷的小鼠表現為Wnt信號通路的激活和骨量增多,在其骨骼中,TCF1、Runx-2和骨鈣素表達明顯增多[12]。相反也有研究[13]表明Wnt經典通路的激活也可以抑制成骨:通過在含有Wnt3a無血清條件培養基中培養或表達Wnt1的慢病毒載體轉染,激活了通路,最終人骨髓間充質細胞(human mesenchymal stem cells,hMSCs)的骨向分化受到抑制、細胞增殖能力增強;Derfoul等[14]通過基因轉染使鼠胚胎間充質系C3HIOTl/2表達Wnt3a,結果發現Wnt3a能顯著抑制其他成骨的標志基因如BSP、骨橋蛋白基因的表達。本實驗主要檢測該通路中的主要抑制因子DKK-1基因表達和βcatenin(其中包括β-catenin基因表達及單獨提取細胞核中的β-catenin蛋白的表達),通過比較該2個因子在正常hPDLSCs成骨誘導前后的變化以及誘導后N-hPDLSCs組與A-hPDLSCs組的區別,來探討AGEs刺激下,hPDLSCs骨分化過程中的Wnt經典通路是否受到影響。本實驗研究結果顯示對于正常hPDLSCs而言,成骨誘導后DKK-1基因表達明顯上調,βcatenin基因表達下調,并且核蛋白里的β-catenin蛋白表達下調,可以確定Wnt通路處于抑制狀態,故可以推斷正常牙周膜干細胞在向成骨分化的過程中Wnt經典通路是受到了一定程度的抑制。通過對誘導后的正常組與AGEs刺激組比較,由于AGEs的刺激,抑制因子DKK-1基因表達降低,β-catenin基因表達明顯升高,并且細胞核中的β-catenin蛋白表達升高,得到AGEs激活了的Wnt經典通路,這與正常的hPDLSCs骨分化過程中Wnt經典通路的抑制狀態相反。
綜上所述,AGEs能改變正常hPDLSCs骨分化過程中的Wnt經典通路,使該通路處于激活狀態;AGEs抑制了hPDLSCs成骨分化。而AGEs是否通過激活Wnt經典通路影響hPDLSCs的骨分化能力,還需要大量的實驗研究。
[1]Stitt AW, Jenkins AJ, Cooper ME. Advanced glycation end products and diabetic complications[J]. Expert Opin Investig Drugs, 2002, 11(9):1205-1223.
[2]Tan KC, Chow WS, Ai VH, et al. Advanced glycation end products and endothelial dysfunction in type 2 diabetes[J].Diabetes Care, 2002, 25(6):1055-1059.
[3]Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[4]伍燕, 鄧超, 楊琨, 等. 糖基化終末產物對牙周膜干細胞增殖及其wnt經典通路相關基因表達的影響[J]. 牙體牙髓牙周病學雜志, 2012, 22(5):255-259.
[5]鄧超, 伍燕, 楊琨, 等. 糖基化終末產物對人牙周膜干細胞骨向分化能力影響的研究[J]. 牙體牙髓牙周病學雜志,2012, 22(5):249-254.
[6]Ohta S, Yamada S, Matuzaka K, et al. The behavior of stem cells and progenitor cells in the periodontal ligament during wound healing as observed using immunohistochemical methods[J]. J Periodont Res, 2008, 43(6):595-603.
[7]Seo BM, Miura M, Gronthos S, et al. Investigation of mul-tipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364(9429):149-155.
[8]Techawattanawisal W, Nakahama K, Komaki M, et al. Isolation of multipotent stem cells from adult rat periodontal ligament by neurosphere-forming culture system[J]. Biochem Biophys Res Commun, 2007, 357(4):917-923.
[9]賀慧霞, 劉洪臣, 王東勝, 等. 礦化液促進犬牙周膜細胞異位成骨實驗[J]. 中華老年口腔醫學雜志, 2008, 6(3):203-207.
[10]Mulholland DJ, Dedhar S, Coetzee GA, et al. Interaction of nuclear receptors with the Wnt/beta-catenin/Tcf signaling axis: Wnt you like to know[J]. Endocr Rev, 2005, 26(7):898-915.
[11]Little RD, Carulli JP, Del Mastro RG, et al. A mutation in the LDL receptor-related protein 5 gene results in the autosomal dominant high-bone-mass trait[J]. Am J Hum Genet,2002, 70(1):11-19.
[12]Gaur T, Lengner CJ, Hovhannisyan H, et al. Canonical WNT signaling promotes osteogenesis by directly stimulating Runx2 gene expression[J]. J Biol Chem, 2005, 280(39):33132-33140.
[13]Liu G, Vijayakumar S, Grumolato L, et al. Canonical Wnts function as potent regulators of osteogenesis by human mesenchymal stem cells[J]. J Cell Biol, 2009, 185(1):67-75.
[14]Derfoul A, Carlberg AL, Tuan RS, et al. Differential regulation of osteogenic marker gene expression by Wnt-3a in embryonic mesenchymal multipotential progenitor cells[J].Differentiation, 2004, 72(5):209-223.

