結直腸癌肝轉移外科治療策略
徐達 邢寶才
·專家論壇·
結直腸癌肝轉移外科治療策略
徐達 邢寶才
邢寶才,教授,主任醫師,博士研究生導師。現任北京大學腫瘤醫院外科教研室主任,北京大學腫瘤醫院肝膽胰外一科主任。從事腫瘤外科臨床近30年,在肝膽胰腺外科領域積累了豐富的臨床與實踐經驗。完成了1 000余例肝切除手術,能夠完成包括全尾狀葉在內的各個肝段腫瘤的切除,近5年無圍手術期死亡與手術后肝功能衰竭的發生。在結直腸癌肝轉移的治療上經驗豐富,積極倡導綜合治療的理念,開展結直腸癌肝轉移的新輔助化療與轉化性治療,在國內率先開展了結直腸癌肝轉移的“liver first”手術、PVE聯合二期切除的手術和復發后再切除的手術。兼任中國抗癌協會肝癌專業委員會常委、中華外科學會肝臟外科學組委員、中華腫瘤學會肝癌學組委員、中國抗癌協會大腸癌肝轉移學組委員、中國抗癌協會膽道腫瘤委員會常委、中國抗癌協會胰腺癌專業委員會委員、衛生部腫瘤規范化治療專家委員會委員、北京抗癌協會理事、北京抗癌協會肝膽胰腫瘤委員會主任委員、北京腫瘤學會委員、北京大學肝癌中心副主任、北方肝癌專家委員會副主任,擔任多種雜志的編委和審稿專家。承擔國家重大科學研究計劃中國人類蛋白質草圖項目的子課題,國家自然科學基金和北京市自然科學基金等多項科研課題。培養博士與碩士研究生10余名,發表文章50余篇。

目前手術切除是結直腸癌肝轉移(CRLM)唯一具有治愈可能的治療方式。近年來隨著全身化療及靶向藥物的發展、肝動脈灌注化療的應用,對于CRLM治療的有效率明顯升高,通過手術獲益的患者逐漸增多;而如射頻消融、二步切除等外科技術的進步,也為更多CRLM患者提供了治愈的機會。多學科診療模式(MDT)也為更多CRLM患者的個體化診治創造了機會,使未來CRLM的治療向更加精準的方向發展。
結直腸癌肝轉移 外科手術 治療
結直腸癌是我國常見的消化系統惡性腫瘤,發病率逐年增加,位居所有惡性腫瘤中第3位[1]。肝臟是結直腸癌轉移最主要的靶器官,超過50%的結直腸癌患者會在其病程中出現肝臟轉移,其中20%~25%是同時性的,2/3的結直腸癌患者因為肝臟轉移而死亡[2]。目前肝切除是治療結直腸癌肝轉移(colorectal liver metastasis,CRLM)安全有效且唯一有治愈可能的方法,5年生存率大于50%,且有超過20%的患者存活超過10年;而單純全身化療中位生存期僅20個月左右[3]。因此,肝轉移治療的有效性直接決定結直腸癌患者生存。近15年來,隨著全身化療和靶向藥物的發展,肝切除技術進步,腫瘤局部治療(regional he?patic therapies,RHT)方法的應用,以及多學科綜合團隊(multidisciplinary team,MDT)模式的完善,越來越多的患者通過綜合治療獲益。本文主要從以下幾個方面對CRLM的外科治療策略進行了探討。
1 可切除肝轉移的治療
1.1 可切除的定義
既往可切除肝轉移對于腫瘤大小數目分布、手術切緣、轉移時間、甚至CEA水平都有嚴格的限定,在這種條件下只有不到10%的患者存在手術切除的機會。由于圍手術期綜合治療的進步,目前對于CRLM可切除的定義,已經由轉變為滿足下面三個條件即可認為是可切除:1)完全切除肝轉移灶;2)完全切除所有的肝外轉移;3)殘余肝體積大于30%,且殘余的肝臟有很好的入肝與出肝血流和膽汁引流[4]。即便是這樣,也只有大約20%的CRLM患者有手術切除的機會,并且依賴于外科醫生的經驗以及肝切除技術的差異。因此在目前的條件下,肝轉移可切除的范疇能否擴大,使更多患者獲益,是討論的熱點。2014年Mise等[5]的一項回顧性研究發現肝轉移灶切除、肺轉移未切除組預后明顯優于肝肺轉移均沒有切除組。研究表明結直腸癌同時伴有肝轉移及小的肺轉移灶時,肝轉移是影響患者生存的主要因素,因此單純進行肝轉移灶切除可行的[6],這對既往觀點造成了極大的沖擊。
對肝切緣認識的發展也在推動可切除概念的發展。早期認為肝轉移切緣大于1 cm局部復發率最低[7]。但在某些情況下一味追求大于1 cm的切緣,須聯合大血管切除,導致大范圍的肝切除而使殘余肝臟體積不足,故使一部分患者進入不可切除的范疇。近期一項多中心回顧性研究發現,切緣在1~4 mm、5~9 mm、以及大于1 cm 3組CRLM患者,無進展生存(diseasefree survival,DFS)和總生存(overall survival,OS)無顯著性差異,認為只要保證切緣陰性即可(切緣≥1mm)[8]。Johns Hopkins醫院的報道表明[9],對于R0、R1、R1→R0(術中初始切緣R1,然后補充切緣后為R0),3組不論是局部復發率還是遠期生存情況,均無顯著性差異(P=0.93)。Ayez等[10]亦發現在如今全身化療的時代,R0和R1切除的差異越來越小。綜上,可切除肝轉移的范疇正在逐漸擴大,大量的中心進行了這方面的實踐,但仍然需要更大規模的臨床研究來進行證實。
1.2 新輔助化療
術前新輔助治療的優勢在于消除微小轉移灶,幫助判斷腫瘤對治療藥物的敏感性并為術后藥物治療選擇提供依據,但目前是否應該應用尚無定論。EPOC研究首先報道了對于可切除CRLM給予新輔助化療(FOLFOX方案)可提高無疾病進展生存(pro?gression free survival,PFS),但對總生存(overall sur?vival,OS)雖有改善但無統計學意義;而增加了靶向藥物的New EPOC研究顯示西妥昔單抗聯合化療的新輔助治療同樣未使可切除肝轉移的患者獲益。目前并無前瞻性的研究結果支持對可切除的CRLM進行新輔助化療,但新輔助化療對于這部分患者一定無意義嗎?實際上,肝轉移切除術后的復發與患者手術前的臨床危險因素評分[11](clinical risk score,CRS)有著密切的關系。一般來講,CRS<3分為術后復發的低危險組,CRS≥3分的是高危險組。在EPOC研究中新輔助組及單純手術組的中位生存時間分別達到了61.3個月和54.3個月,遠遠高于既往研究的生存結果,對EPOC研究入組患者進行分析后發現其中80%屬于低危險復發組(CRS<3)。所以,認為新輔助化療只是不能使低危復發組患者獲益,而對于高危復發病患者的生存獲益目前尚缺乏定論。最近的研究表明[12],對于切除難度大或者復發風險高可切除CRLM患者應該進行新輔助化療。而來自荷蘭的一項回顧性研究亦證實,對于高危復發人群進行新輔助化療,患者有生存獲益,并且已經有針對高危復發人群(CRS≥3)的患者實施新輔助治療的Ⅲ期臨床研究[13]。因此,對于可切除的患者行新輔助化療需因人而異,應該在治療前經過MDT查房分析后再做出決策(圖1)。
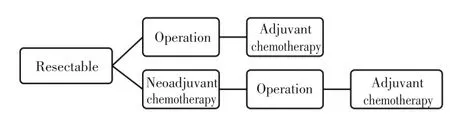
圖1 可切除CRLM治療流程Figure 1 Treatment process for resectable colorectal carcinoma liver me?tastasis
2 初始不可切除肝轉移的治療
2.1 轉化治療
對于初始不可切除的CRLM,非手術的治療中位生存只有不到24個月,如果可以轉化為可切除并進行手術,患者5年生存率可以達到33%[14]。因此如何能夠獲取更高的反應率,使更多患者獲得手術機會,是提高初始不可切除CRLM患者治療效果的關鍵。而在轉化治療方案選擇上需要考慮以下四個因素:1)方案的有效性應該足夠強;2)達到可切除的速度應足夠快;3)化療方案安全性應足夠高,不良反應可耐受;4)方案能夠帶給患者的生存獲益最大。早期在5-Fu時代,只有不到10%的初始不可切除患者可以通過化療轉化為可切除[15]。后期隨著化療藥物(奧沙利鉑和伊立替康)及靶向藥物(西妥昔單抗和貝伐單抗)的臨床應用,通過使用mFOLFOX6(奧沙利鉑+氟尿嘧啶+亞葉酸鈣)或FOLFIRI(伊立替康+氟尿嘧啶+亞葉酸鈣)聯合西妥昔單抗/貝伐單抗,可以將反應率提高到60%~70%[16-17]。近來FOLFOXIRI方案(奧沙利鉑+伊立替康+氟尿嘧啶+亞葉酸鈣)聯合靶向藥物進行轉化治療成為新的研究熱點,通過強有力的化療可以獲得更高的反應率及轉化率。2014年發表在新英格蘭醫學雜志(NEJM)的一項Ⅲ期的RCT臨床研究證實,對比FOLFIRI聯合貝伐,FOLFOXIRI聯合貝伐組的ORR顯著提高,PFS、OS顯著延長[18]。另一項關于三藥轉化性治療的研究于2015年將FOLFOXIRI聯合貝伐與mFOLFOX6聯合貝伐治療不可切除的CRLM進行了對比[19],研究結果發現FOLFOXIRI聯合貝伐組的ORR為81%,而mFOLFOX6聯合貝伐組的ORR僅為62%。基于上述研究可以看出,三藥(FOLFOXIRI)聯合貝伐單抗與兩藥(FOLFOX/FOLFIRI)聯合貝伐單抗相比,有效率、轉化率明顯提高。盡管三藥組白細胞減少、腹瀉、末梢神經炎等不良反應有所增加,但Ⅲ級以上不良事件發生率并無差異。因此,在身體狀況允許的條件下,對于一些潛在可切除的患者,可以選擇有效率更高的三藥方案,并每4周期對肝轉移進行評價。2012年結直腸癌肝轉移外科治療共識中指出,術前化療后應根據腫瘤的不同反應情況分類處理:1)腫瘤部分緩解(PR)且可切除:及時手術;2)腫瘤部分緩解(PR)但仍然不可切除:繼續原方案化療;3)腫瘤維持穩定(SD):繼續原方案化療,4個月后如仍然維持SD,應考慮二線方案;4)腫瘤進展(PD):可考慮二線方案。
2.2 肝動脈灌注化療
由于較高的肝內藥物濃度以及相比于全身化療更高的反應率[20],肝動脈灌注化療(hepatic artery in?fusion,HAI)逐漸成為治療初始不可切除CRLM的一項有效治療手段。早期的Ⅰ期、Ⅱ期臨床研究顯示,HAI與全身化療的聯合應用治療CRLM的有效率大約為52%~75%;轉化率可達到47%[21]。近期來自斯隆凱瑟琳癌癥紀念醫院的一項Ⅱ期臨床研究顯示,入組患者中的65%屬于二線或三線治療,通過肝動脈灌注5-Fu及全身化療聯合或不聯合貝伐單抗,總的反應率達到76%,約47%的初始不可切除的患者轉化為可切除,中位生存期達到了38個月[22]。因此HAI應該作為不可切除CRLM的重要選擇,尤其是對于肝轉移負荷大且未無肝外轉移,或者一線轉化治療失敗的患者。未來仍需要大規模的RCT研究,來為HAI提供更加有力的證據。
2.3 肝切除聯合射頻消融治療
射頻消融技術已經在越來越多肝膽外科中心熟練開展。與手術切除相比,肝切除聯合射頻消融治療(radiofrequency ablation,RFA)的優點有:微創、安全性高、患者痛苦小;但缺點亦顯而易見,即沒有病理結果證明腫瘤消除的完全性,而這會直接影響腫瘤的局部復發率。既往結果顯示,RFA治療CRLM的5年生存率為15%~48%,局部復發率已下降到5.2~8.8%[23-24]。2015年ASCO公布了CLOCC研究的長期隨訪結果,RFA聯合手術與單純全身化療的中位OS分別為45.6、40.5個月(P=0.01);中位PFS分別為16.8、9.9個月(P=0.005);證實了RFA聯合手術較單純姑息化療能夠提高患者的生存[25],盡管如此,學者們對于其局部復發率仍存在爭議。Tanis等[26]將CLOCC研究中進行RFA的患者與EPOC研究中進行手術的患者進行了比較,局部復發率分別為7.4%、14.5%;中位DFS分別為356天、412.5天,具有顯著性差異。另外一項薈萃分析總結,盡管多項研究存在一定的偏倚,但在局部復發率方面手術切除顯著優于RFA[27]。也就是說,RFA治療在CRLM中應有一定的地位,但不應盲目選擇,也無法取代手術的作用。對于不可單純切除的患者,可以考慮通過切除聯合射頻達到根治效果。
2.4 分期肝切除方法
分期肝切除手術的出現和發展極大地推進了CRLM外科理念的進步。PVE/PVL的方法使許多沒有手術機會的患者獲得了根治的機會,5年和10年的總生存分別可以達到32.1%和24.1%,中位生存達43個月[28]。最近Schnitzbauer等人報道了一項新的二次肝切除的技術,即聯合肝臟離斷及門脈結扎的分次肝切除術(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS),該技術的優點有幾個:1)降低術后肝衰發生率;2)提供了與其他技術相比最大程度上的肝臟增生;3)可以最大程度上縮短二次肝切除間隔,降低了腫瘤進展的機會。國際上許多中心對這種方法進行了實踐和研究,其中中位二次手術間隔為9~14天,左外葉體積增加74~87.2%,患者1、2年的生存率為73%、59%。但是,術后并發癥發生率為53%~68%,死亡率為0~28%[29-30]。這種高并發癥率及死亡率,引發了學者們對此技術臨床安全性的思考。此外,一個來自國際ALPPS協作組的報告,對于CRLM進行ALPPS手術的患者,近80%患者首先接受了術前的化療,如果經過術前的化療仍然無進行常規切除的機會,才考慮行ALPPS。因此,對ALPPS的方法應該理性看待,除了是一種腫瘤切除的手段,還應充分考慮結直腸癌的特點及生物學行為,合理科學地應用這一技術。
綜上所述,對于初始不可切除的肝轉移,足夠強、足夠快、足夠安全的轉化治療是首選,可以使大部分患者腫瘤降期獲得R0切除機會。而對那些經過轉化還是無法切除的患者,可以選擇針對肝臟局部治療效果更強的HAI繼續轉化,或者評估是否可以通過手術切除聯合RFA以達到R0的效果。ALPPS為一些不可切除肝轉移患者的長期生存提供了可能,但由于這一術式的高風險、高并發癥以及長期生存效果的不確定性,可以作為一種補救方法慎重進行(見圖2)。
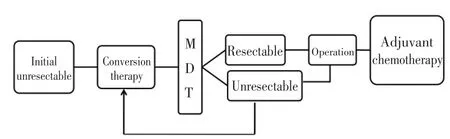
圖2 初始不可切除CRLM治療流程Table 2 Treatment process for initially non-resectable colorectal carci?noma liver metastasis
3 CRLM中的多學科查房
CRLM中的MDT查房模式在惡性腫瘤治療過程中對臨床決策的重要作用已經在世界范圍內得到共識。而由于CRLM發病情況的復雜性,MDT的作用更加凸顯。本科作為牽頭科室組建了國內較早的CRLM團隊,近年來取得了良好的效果。標準的MDT團隊由肝膽外科、結直腸外科、腫瘤內科、影像科、放療科、病理科、內鏡科的醫生共同參與,對于肝臟可切除狀態的評估需要2名以上經驗豐富的肝臟外科醫師共同決定。研究表明,MDT查房可以為CRLM患者提供最佳的個體化治療,進行MDT的中心對CRLM可切除性的評價更加準確,其治療的遠期預后也顯著優于未進行MDT的中心[31]。
4 總結
總之,手術切除是CRLM的首選治療,R0切除是CRLM治療的目標。對于可切除CRLM是否進行新輔助治療,需要進一步的研究以篩選出從中獲益的人群;不可切除的CRLM應首選最高效的轉化方案(三藥聯合/靶向),進行全身的系統性治療以獲取切除可能。RFA、HAI、PVE/ALPPS這些方法,可以為更多初始不可切除的CRLM患者創造R0的機會。而MDT是提高CRLM切除率,延長生存的關鍵因素,高水平的MDT團隊能使患者生存獲益最大化。
[1] He J,Zhao P,Chen WQ.Chinese cancer registries[M].Beijing: Military Medical Science Press,2012:1-2.[赫 捷,趙 平,陳萬青.主編.中國腫瘤登記年報[M].北京:軍事醫學科學出版社,2012: 1-2.]
[2] Kopetz S,Chang GJ,Overman MJ,et al.Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy[J].J Clin Oncol,2009,27 (22):3677-3683.
[3] Adam R,Hoti E,BredtL.Evolution of neoadjuvant therapy for extended hepatic metastases--have we reached our(non-resect?able)limit[J]?J Surg Oncol,2010,102(8):922-931.
[4] Adam R,Hoti E,FolprechtG&Benson,A.B.Accomplishments in 2008 in the management of curable metastatic colorectal cancer [J].Gastrointest Cancer Res,2009,3(Suppl 2):S15-S22.
[5] Mise Y,Kopetz S,Mehran R,et al.Is complete liver resection without resection of synchronous lung metastases justified[J]? Ann Surg Oncol,2015,22(5):1585-1592.
[6] Nordholm-Carstensen A,Krarup P,Jorgensen L,et al.Occur?rence and survival of synchronous pulmonary metastases in colorectal cancer:a nationwide cohort study[J].Eur J Cancer, 2014,50(2):447-456.
[7] Hughes K,Simon R,Songhorabodi S,et al.Resection of the liver for colorectal carcinoma metastases:a multi-institutional study of patterns of recurrence[J].Surgery,1986,100(2):278-284.
[8] Pawlik T,Scoggins C,Zorzi D,et al.Effect of surgical margin sta?tus on survival and site of recurrence after hepatic resection for colorectal metastases[J].Ann Surg,2005,241(5):715-722..
[9] Margonis G,SpolveratoG,KimY,et al.Intraoperative Surgical Margin Re-resection for Colorectal Liver Metastasis:Is It Worth the Effort[J]?J Gastrointest Surg,2015,19(4):699-707.
[10]Ayez N,Lalmahomed Z,Eggermont A,et al.Outcome of micro?scopic incomplete resection(R1)of colorectal liver metastases in the era of neoadjuvant chemotherapy[J].Ann Surg Oncol,2012, 19(5):1618-1627.
[11]Fong Y,Fortner J,Sun R,et al.Clinical score for predicting recur?rence after hepatic resection for metastatic colorectal cancer:analysis of 1001 consecutive cases[J].Ann Surg,1999,230(3):309-318.
[12]Jones R,Malik H,Fenwick S,et al.Perioperative chemotherapy for resectable colorectal liver metastases:where now[J]?Eur J Surg Oncol,2013,39(8):807-811.
[13]Ayez N,van der Stok E,de Wilt H,et al.Neo-adjuvant chemo?therapy followed by surgery versus surgery alone in high-risk pa?tients with resectable colorectal liver metastases:the CHARISMArandomized multicenter clinical trial[J].BMC cancer,2015,15:180.
[14]Adam R,Delvart V,Pascal G,et al.Rescue surgery for unresect?able colorectal liver metastases downstaged by chemotherapy:a model to predict long-term survival[J].Ann Surg,2004,240(4): 644-657.
[15]Bismuth H,Adam R,Levi F,et al.Resection of nonresectable liv?er metastases from colorectal cancer after neoadjuvant chemother?apy[J].Ann Surg,1996,224(4):509-520.
[16]Folprecht G,Gruenberger T,Bechstein W,et al.Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab:the CELIM randomised phase 2 trial[J].Lancet Oncol,2010,11(1):38-47.
[17]Maughan T,Adams R,Smith C,et al.Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treat?ment of advanced colorectal cancer:results of the randomised phase 3 MRC COIN trial[J].Lancet,2011,377(9783):2103-2114.
[18]Loupakis F,Cremolini C,Masi G,et al.Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer[J]. N Engl J Med,2014,371(17):1609-1618.
[19]Gruenberger T,Bridgewater J,Chau I,et al.Bevacizumab plus mFOLFOX-6 or FOLFOXIRI in patients with initially unresect?able liver metastases from colorectal cancer:the OLIVIA multina?tional randomised phaseⅡtrial[J].Ann Oncol,2015,26(4):702-708.
[20]Kemeny N,Niedzwiecki D,Hollis D,et al.Hepatic arterial infu?sion versus systemic therapy for hepatic metastases from colorec?tal cancer:a randomized trial of efficacy,quality of life,and mo?lecular markers(CALGB 9481)[J].J Clin Oncol,2006,24(9): 1395-1403.
[21]Kemeny N,Conti J,Cohen A,et al.PhaseⅡstudy of hepatic arte?rial floxuridine,leucovorin,and dexamethasone for unresectable liver metastases from colorectal carcinoma[J].J Clin Oncol,1994, 12(11):2288-2295.
[22]D'Angelica M,Correa-Gallego C,Paty P,et al.PhaseⅡtrial of hepatic artery infusional and systemic chemotherapy for patients with unresectable hepatic metastases from colorectal cancer:con?version to resection and long-term outcomes[J].Ann Surg,2015, 261(2):353-360.
[23]Gillams A,Lees W.Five-year survival in 309 patients with colorectal liver metastases treated with radiofrequency ablation[J]. Eur Radiol,2009,19(5):1206-1213.
[24]Abitabile P,Hartl U,Lange J,et al.Radiofrequency ablation per? mits an effective treatment for colorectal liver metastasis[J].Eur J Surg Oncol,2007,33(1):67-71.
[25]Ruers T,Punt C,Van Coevorden F,et al.Radiofrequency abla?tion combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phaseⅡ study(EORTC 40004)[J].Ann Oncol,2012,23(10):2619-2626.
[26]Tanis E,Nordlinger B,Mauer M,et al.Local recurrence rates af?ter radiofrequency ablation or resection of colorectal liver metasta?ses.Analysis of the European Organisation for Research and Treatment of Cancer#40004 and#40983[J].Eur J Cancer,2014, 50(5):912-919.
[27]Weng M,Zhang Y,Zhou D,et al.Radiofrequency ablation ver?sus resection for colorectal cancer liver metastases:a meta-analy?sis[J].PloS One,2012,7(9):e45493.
[28]Giuliante F,Ardito F,Ferrero A,et al.Tumor progression during preoperative chemotherapy predicts failure to complete 2-stage hepatectomy for colorectal liver metastases:results of an Italian multicenter analysis of 130 patients[J].J Am Coll Surg,2014,219 (2):285-294.
[29]Alvarez F,Ardiles V,Sanchez Claria R,et al.Associating liver partition and portal vein ligation for staged hepatectomy(ALPPS): tips and tricks[J].J Gastrointest Surg,2013,17(4):814-821.
[30]Schnitzbauer A,Lang S,Goessmann H,et al.Right portal vein li?gation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings[J].Ann Surg,2012,255(3):405-414.
[31]Lordan J,Karanjia N,Quiney N,et al.A 10-year study of out?come following hepatic resection for colorectal liver metastases-The effect of evaluation in a multidisciplinary team setting[J].Eur J Surg Oncol,2009,35(3):302-306.
(2015-07-15收稿)
(2015-08-05修回)
(編輯:周曉穎)
Surgical treatment of colorectal cancer liver metastasis
Da XU,Baocai XING
Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Hepatobiliary Pancreatic Surgery Ward I, Peking University Cancer Hospital&Institute,Beijing 100142,China.
Surgical resection is currently the only cure treatment for colorectal carcinoma liver metastasis(CRLM).The efficiency of surgical resection has improved with the development of systemic chemotherapy and targeted drugs and the application of hepatic arterial infusion chemotherapy in recent years.The number of patients benefiting from surgery has gradually increased.The progression of surgical techniques such as radiofrequency ablation and staged hepatectomy provides chances of cure for patients with CRLM.Multidisciplinary team creates the opportunity of individual diagnosis and treatment for growing number of patients with CRLM,which,in turn,promotes the treatment of CRLM to a more precise future.
colorectal cancer liver metastasis,surgical resection,therapy

10.3969/j.issn.1000-8179.2015-17.773
北京大學腫瘤醫院暨北京市腫瘤防治研究所肝膽胰外一科,惡性腫瘤發病機制及轉化研究教育部重點實驗室(北京市100142)
邢寶才 xingbaocai88@sina.com
徐達 專業方向為肝膽胰腫瘤的外科和基礎研究。
E-mail:xuda1989212@126.com

