鱈魚骨活性鈣的正交試驗優化及其生物利用度分析
王珊珊,李八方*,周德慶,侯 虎
(1.中國海洋大學食品科學與工程學院,山東 青島 266003;2.中國水產科學研究院黃海水產研究所,山東 青島 266071)
鱈魚骨活性鈣的正交試驗優化及其生物利用度分析
王珊珊1,2,李八方1,*,周德慶2,侯 虎1
(1.中國海洋大學食品科學與工程學院,山東 青島 266003;2.中國水產科學研究院黃海水產研究所,山東 青島 266071)
目的:以水產加工下腳料鱈魚骨為原料,探討鱈魚骨活性鈣的最佳制備條件,并對其生物利用度進行研究。方法:對魚骨進行基本組成分析與組織學觀察;采用正交試驗確定魚骨活性鈣的最佳提取條件;采用低鈣飲食建立大鼠缺鈣模型,檢測大鼠血清生化指標、骨鈣含量及鈣代謝指標,對魚骨活性鈣的生物利用度進行探討。結果:鱈魚骨中鈣與磷含量分別達到207.8 mg/g和100.9 mg/g,其比值接近2∶1。掃描電鏡觀察發現鱈魚骨表面具有堅固致密的扁平板狀羥基磷灰石結晶。活性鈣最佳提取條件為提取溫度100 ℃、提取時間120 min、酸混合比例(檸檬酸-蘋果酸體積比)1∶2、酸質量分數15%,在此條件下提取率達到96.15%。與空白對照組相比,活性鈣各劑量組能顯著提高大鼠骨鈣含量。鈣代謝實驗測定結果顯示,活性鈣高劑量組鈣吸收率顯著高于相同鈣水平的碳酸鈣對照組。結論:鱈魚骨可作為一種優良的天然鈣源,魚骨活性鈣能夠作為一種有效的鈣營養強化劑加以開發。
鱈魚骨;活性鈣;生物利用度;鈣營養強化劑;高值化利用
鈣是人體中含量最豐富的礦質元素之一,在人體生命維持與物質代謝方面發揮著重要作用[1-2]。大量研究發現兒童與青少年時期攝入足量的鈣有助于獲得最佳的骨密度峰值[3-6],絕經后的婦女及70 歲以上老年男性攝入足量的鈣將會減緩骨量的流失速率,從而降低罹患骨質疏松癥的風險[7-10]。在我國城市地區鈣的平均攝入量僅為439 mg/d[11],遠未達到中國營養學會推薦的每日攝入劑量(800~1 000 mg/d)[12],因此通過鈣營養強化劑合理補鈣并促進人體對鈣的吸收至關重要。使用檸檬酸和蘋果酸所提取的復合鈣鹽果酸活性鈣,是一種新型鈣營養強化劑。目前國內外對果酸活性鈣的開發和利用已有相關報道,但以鱈魚骨為原料進行提取制備與生物學評價的研究還相對較少。
鱈魚骨約占魚體質量的15%[13],是鱈魚加工業中的主要副產物。魚骨鈣大多是以羥基磷灰石結晶形式存在,導致鈣的溶出量甚微。目前,國內已有對魚骨鈣進行開發利用的報道,例如霍健聰等[14]制備魚骨鈣片并進行生物利用研究;王建中等[15]以青魚骨為鈣源制備骨粉;吳燕燕等[16]以羅非魚骨為原料制取骨鈣且探討鈣的生物利用;邵明栓等[17]以斑點叉尾鮰魚骨進行脫脂然后制備活性鈣。為了提高鈣的吸收利用率,使豐富的鱈魚骨資源能夠得到更好的利用,本實驗將對鱈魚骨活性鈣的最佳制備工藝進行探討,并研究其生物利用度,為鱈魚骨資源的綜合利用提供理論依據。
1 材料與方法
1.1 材料與試劑
冷凍狀態下的鱈魚(Gadus macrocephalus)魚排青島福生食品有限公司。
雄性Wistar大鼠45 只(體質量(110±10)g,清潔級,合格證號:0013862) 山東魯抗醫藥質檢中心實驗動物中心。
檸檬酸、蘋果酸、硝酸、高氯酸、無水乙醚等試劑均為國產分析純;血清鈣、血清磷及血清堿性磷酸酶等測定試劑盒 南京建成生物工程研究所。
1.2 儀器與設備
JouanBR4i型冷凍離心機 法國Jouan公司;Sartorius1-14型高速離心機 德國Sigma公司;722S型分光光度計 上海精密儀器有限公司;AA-6800原子吸收分光光度計 島津制作所儀器有限公司;680型酶標儀美國Bio-Rad公司。
1.3 方法
1.3.1 基本組成分析與組織結構觀察
1.3.1.1 基本組成分析
水分含量的測定參照GB 5009.3—2010《食品中水分的測定》;蛋白質含量的測定參照GB 5009.5—2010《食品中蛋白質的測定》;灰分含量的測定參照GB 5009.4— 2010《食品中灰分的測定》;粗脂肪含量的測定參照GB/T 14772—2008《食品中粗脂肪的測定》。
1.3.1.2 礦物質元素組成分析
鈣含量的測定參照GB/T 5009.92—2003《食品中鈣的測定》;磷含量的測定參照GB/T 5009.87—2003《食品中磷的測定》;鎂含量的測定參照GB/T 5009.90—2003《食品中鐵、鎂、錳的測定》;鋅含量的測定參照GB/T 5009.14—2003《食品中鋅的測定》;銅含量的測定參照GB/T 5009.13—2003《食品中銅的測定》;砷含量的測定參照GB/T 5009.11—2003《食品中總砷及無機砷的測定》;鎘含量的測定參照GB/T 5009.15—2003《食品中鎘的測定》。
1.3.1.3 微觀結構的觀察
將樣品在液氮中粉碎,固定后真空噴金,將加速電壓設為20 kV,使用JEOL JSM-840型掃描電鏡對其顯微結構進行觀察。
1.3.2 活性鈣的制備工藝優化
1.3.2.1 活性鈣制備流程
魚骨原料→酶解處理→NaOH處理→清洗→粉碎→混合酸活化處理→取上清液,冷凍干燥
1.3.2.2 預處理
將魚排切成5 cm左右,取1 kg原料,加入5 g中性蛋白酶和1 000 mL水進行酶解(55 ℃,pH 7.5)2 h。酶解結束后洗去雜質,將魚骨放入0.1 mol/L NaOH溶液(料液比1∶10(g/mL))攪拌24 h,以去除殘留的鹽溶性蛋白。將魚骨洗至中性后105 ℃烘干,使用萬能粉碎機粉碎后,再用混合酸提取(活化)。最后取上清液,冷凍干燥。
1.3.2.3 單因素試驗
單因素試驗基本條件為:提取溫度100 ℃、酸質量分數10%、酸混合比例1∶1(檸檬酸-蘋果酸,V/V)、提取時間60 min。改變其中一個條件,固定其余條件來分析提取溫度、酸質量分數、酸混合比例和提取時間對鈣提取率的影響。每個因素設4 個水平:提取溫度(60、80、100、120 ℃)、酸質量分數(1%、5%、10%、15%)、酸比例(1∶2、1∶1、3∶2、2∶1)和提取時間(30、60、90、120 min)。
1.3.2.4 正交試驗設計
根據單因素試驗結果,以鈣提取率為指標,對提取溫度、酸質量分數、酸混合比例和提取時間4個因素設計正交試驗L16(45),如表1所示。
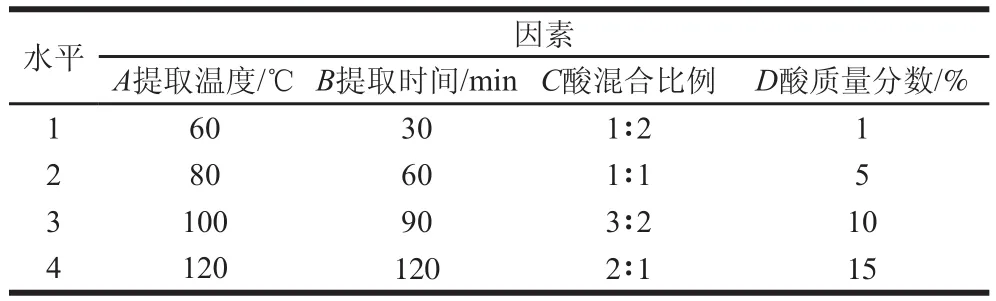
表1 正交試驗因素與水平Table1 Factors and levels used in orthogonal array experiments
1.3.2.5 鈣提取率計算
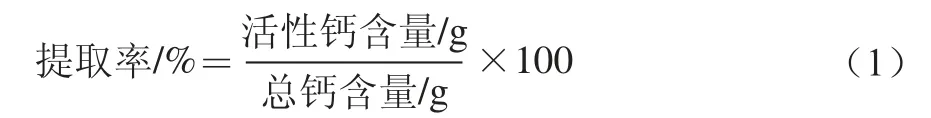
1.3.3 鈣劑量對大鼠鈣代謝影響
1.3.3.1 動物飼養
大鼠在清潔級環境中喂養,室溫保持(22±2) ℃,對室內定期進行紫外線消毒,大鼠自由飲水及攝食。低鈣飼料按AIN-93配方配制(表2),鈣含量調整為0.1%。

表2 飼料基本成分Table2 The composition of low-calcium diet
1.3.3.2 動物分組
將45 只受試動物按體質量隨機分為5 組,設活性鈣樣品低、中、高3 個劑量組,分別灌胃不同劑量水平樣品(Ca2+劑量水平分別為50、100、200 mg/kg);同時設立碳酸鈣對照組(與活性鈣高劑量組鈣水平相同),空白對照組灌胃同體積生理鹽水。所有大鼠均攝食低鈣飼料,飲用去離子水。實驗期間每周稱量體質量,記錄體質量變化及飼料攝入量,連續灌胃4 周。
1.3.3.3 鈣代謝實驗
生長實驗結束后進行3 d鈣代謝實驗,將動物移入代謝籠,分別收集每只受試動物72 h的糞便與尿液,并準確記錄每只受試動物的飼料攝食量;測定飼料、糞便與尿液中的鈣含量。按式(2)~(6)計算鈣的表觀吸收率與儲留率:

1.3.3.4 血清指標測定
腹主動脈取血后,血液室溫靜置30 min,4 000 r/min離心10 min,分離血清后于-35 ℃貯存。血鈣、血磷和堿性磷酸酶含量均按照說明書,采用相應試劑盒進行測定。
1.3.3.5 股骨指標測定
剝離大鼠股骨,剔除肌肉和筋膜后稱質量;測其長度和寬度,同時測定骨鈣含量。
1.3.3.6 鈣含量測定
飼料、糞便、尿液和股骨中鈣含量的測定均采用GB/T 5009.92—2003《食品中鈣的測定》方法。操作參數:混合酸消化液(硝酸-高氯酸混合體積比為4∶1),消化樣品至無色透明后使用去離子水定容;波長設定為422.7 nm,光源為可見光,火焰為空氣-乙炔;標準溶液系列質量濃度范圍為0.25~2 μg/mL,稀釋溶液20 g/L氧化鑭溶液。
1.4 數據分析
2 結果與分析
2.1 基本組成含量分析與組織結構觀察
2.1.1 基本組成含量分析如表3所示,魚骨中水分含量較高,粗蛋白含量低于魚肉。由于魚骨的主要無機成分是羥基磷灰石,因此魚骨中灰分的含量遠高于魚肉。Kittiphattanabawon等[18]測得大眼鯛魚骨中水分含量為62.3%,粗蛋白含量為13.3%,灰分含量為14.4%,與本實驗對鱈魚骨進行成分測定的結果較為接近。

表3 基本組成含量分析Table3 Proximate analysis of fi sh bone and meatg/100 g
2.1.2 礦物質元素組成含量分析

表4 樣品礦物質元素組成含量分析Table4 Mineral composition analysis of fish bone and meat
如表4所示,在魚骨中鈣與磷的含量較高,分別達到207.8 mg/g和100.9 mg/g。魚骨中鈣的含量高于豬腿骨(10.77%)、雞架骨(4.33%)、鵝頸骨(7.96%)和鵝架骨(7.72%),這可能與物種間骨結構的差異及生活環境的不同有關[19]。此外,魚骨中的鈣與磷含量的比值接近2∶1,與人體內的鈣磷比接近。
2.1.3 掃描電鏡觀察

圖1 掃描電鏡觀察圖片Fig.1 Scanning electron micrographs (SEM) of fi sh bone and meat
骨組織的主要無機成分為羥基磷灰石結晶和無定型磷酸鈣,鈣鹽能夠沉積在膠原原纖維上,形成堅硬的骨質。如圖1A所示,可見到堅固致密的羥基磷灰石結晶,如圖1B所示,可觀察到結晶呈扁平的板層狀,與馬的骨組織掃描電鏡觀察結果較為相似;不同物種的骨組織顯微結構有所不同,例如犬骨礦質結晶形態呈棒狀[20]。
2.2 活性鈣制備工藝優化
2.2.1 單因素試驗結果
2.2.1.1 提取溫度對提取率的影響
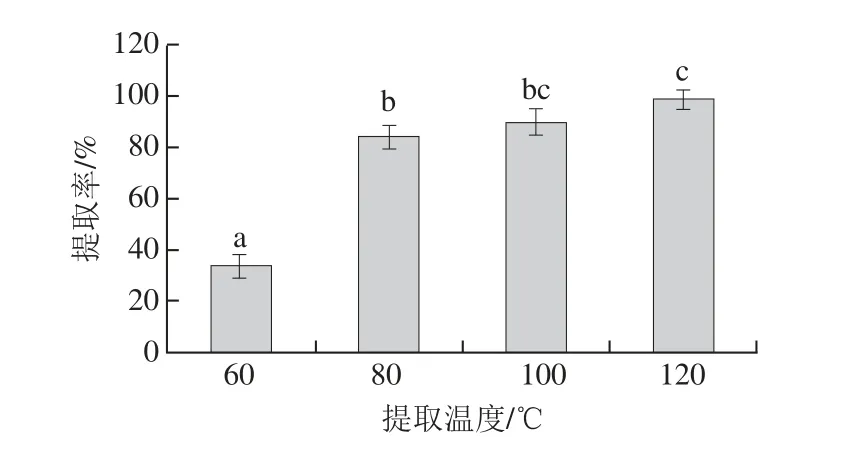
圖2 提取溫度對提取率的影響Fig.2 Effect of temperature on the extraction effi ciency of active calcium
如圖2所示,隨著提取溫度的升高,活性鈣的提取率亦隨之提高。當提取溫度為80 ℃時,提取率達到84.29%,顯著高于60 ℃時所得提取率(P<0.05)。這是由于溫度升高時,反應體系中溶液離子與骨粉微粒的運動加速,加快了整個反應的進程。當溫度繼續升高時,鈣提取率會繼續提高,但其增幅小于60~80 ℃的提取率變化,因此提取溫度設置在80~100 ℃內較為合適。
2.2.1.2 酸質量分數對提取率的影響
如圖3所示,在酸質量分數為1%時,提取率僅為28.73%,當質量分數上升至5%時,提取率迅速增至79.16%。隨著酸質量分數的繼續提高,活性鈣的溶出率仍有升高。這說明在合適的范圍內,酸質量分數的增大有利于骨粉微粒的溶解和鈣的溶出。
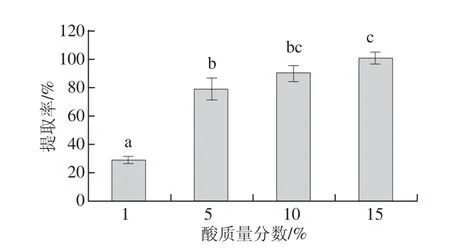
圖3 酸質量分數對提取率的影響Fig.3 Effect of acid concentration on the extraction effi ciency of active calcium
圖4 酸混合比例對提取率的影響Fig.4 Effect of acid mixing ratio on the extraction effi ciency of active calcium
2.2.1.3 酸混合比例對提取率的影響酸的混合比例對提取率的影響如圖4所示,檸檬酸與蘋果酸的體積比在1∶2~2∶1范圍內,混合比例對鈣提取率的影響并不顯著(P>0.05)。
2.2.1.4 提取時間對提取率的影響
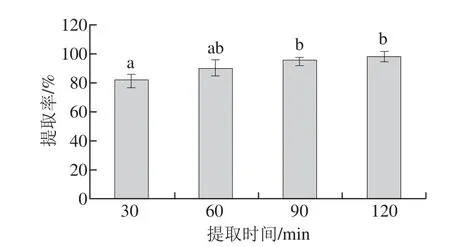
圖5 提取時間對提取率的影響Fig.5 Effect of extraction time on the extraction effi ciency of active calcium
如圖5所示,隨著提取時間的延長,鈣的提取率隨之增加,在90 min時提取率為95.01%,顯著高于30 min時的提取率81.44%(P<0.05),但90 min與100 min時的鈣提取率(分別為95.01%、98.11%)相差不大(P>0.05)。這可能是因為酸的質量分數較高(10%),能夠在較短的時間內溶出骨粉中的鈣質。
2.2.2 正交試驗結果
如表5所示,各因素對鱈魚骨中活性鈣提取率的影響大小為酸質量分數>提取溫度>提取時間>酸混合比例,鱈魚骨中活性鈣提取的最佳分析組合為A3B4C1D4,即提取溫度100℃、提取時間120min、酸混合比例1∶2、酸質量分數15%,在此條件下鈣提取率達到96.15%。
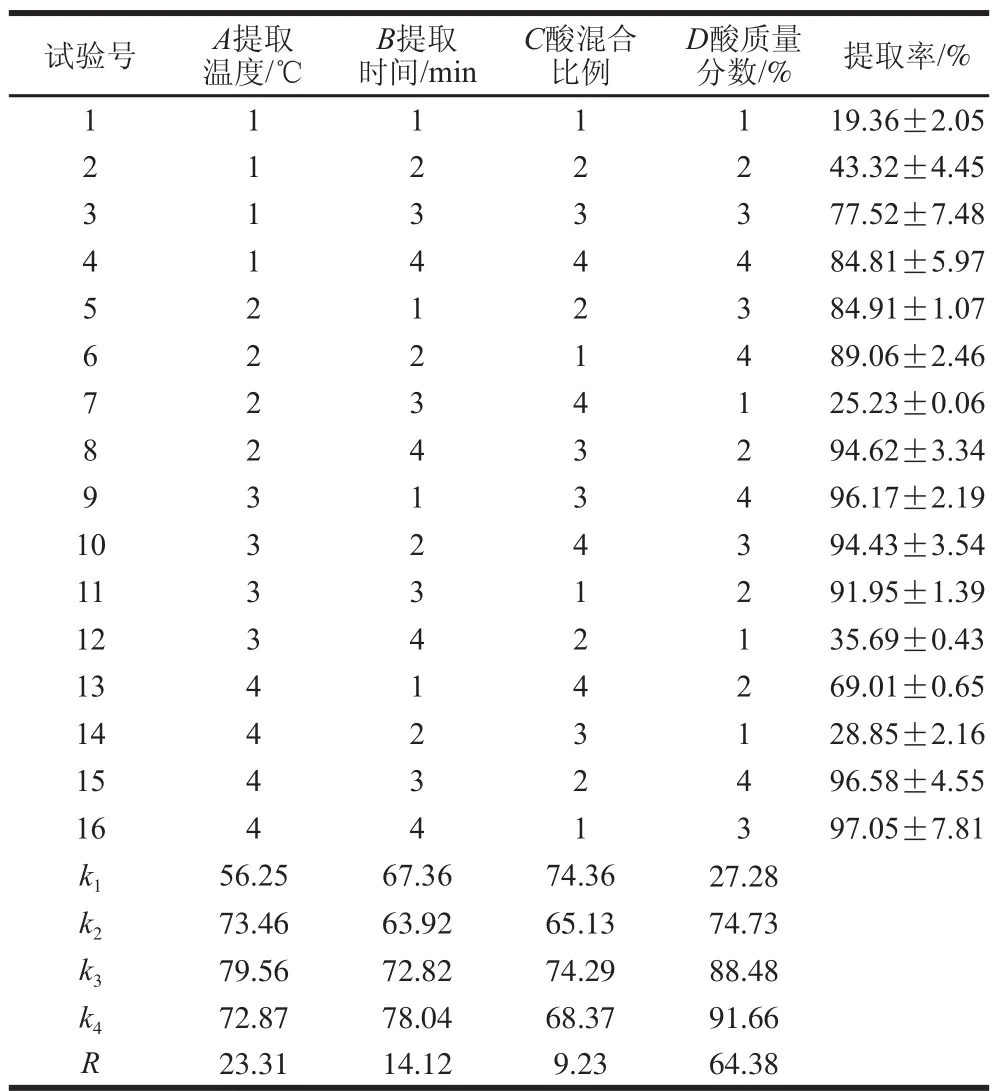
表5 正交試驗設計與結果Table5 Orthogonal experimental design and results
2.3 鈣劑量對大鼠體征指標影響
2.3.1 鈣劑量對大鼠體質量和臟器指數的影響
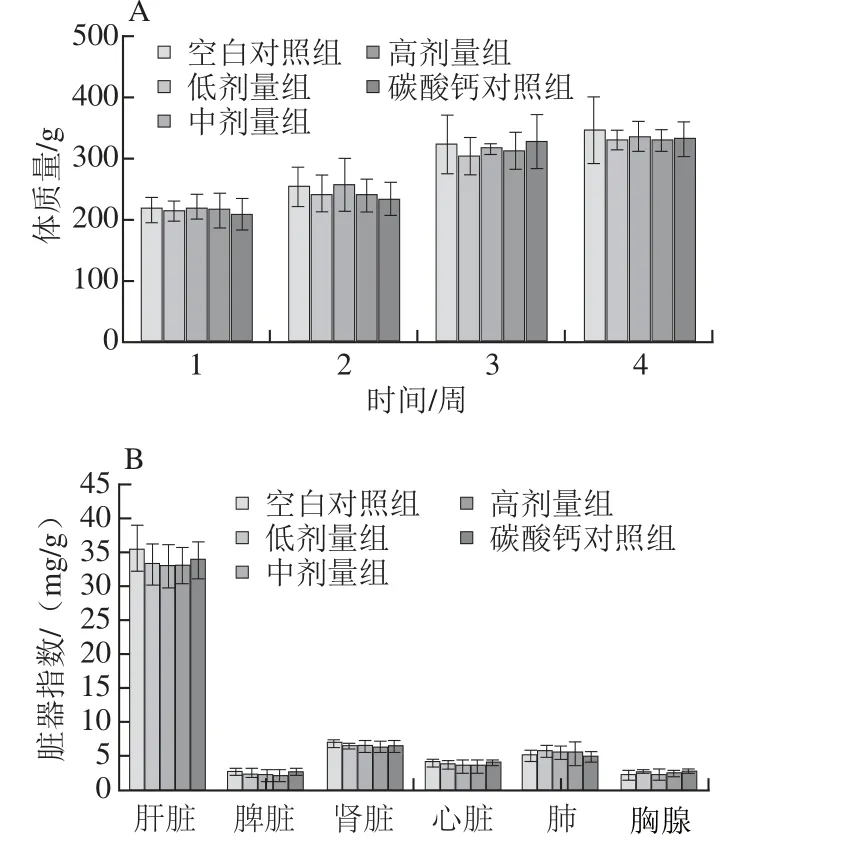
圖6 鈣劑量對大鼠體質量(A)和臟器系數(B)的影響Fig.6 Effects of calcium concentration on body weight and viscera indexes of rats
體質量是生物體健康的表觀指標之一,體質量的異常增加與減少均說明大鼠健康情況可能出現異常。在實驗期內大鼠的飲食、排便與活動情況均正常。如圖6A所示,各組大鼠的體質量相差均不顯著(P>0.05)。在連續灌胃28 d后,各組大鼠的臟器指數差異并不顯著(P>0.05)(圖6B);在解剖過程中觀察各臟器均未見明顯異常,初步說明活性鈣對大鼠沒有明顯的副作用,具有較好的安全性。
2.3.2 鈣劑量對大鼠股骨指標的影響
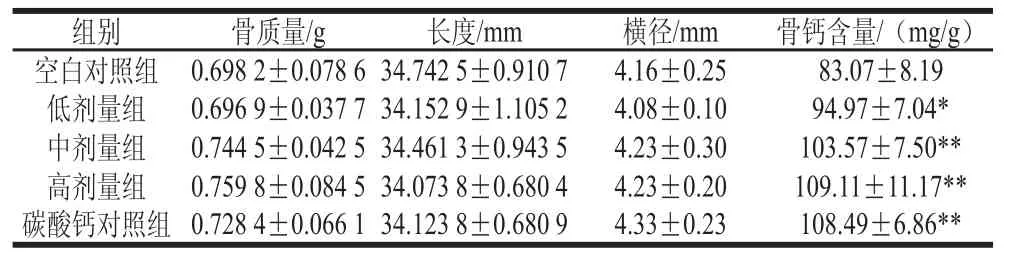
表6 鈣劑量對股骨指標的影響Table6 Effects of calcium concentration on femur physical parameters and calcium content of rats
如表6所示,測定結果表明各組大鼠股骨的質量有提高的趨勢,但并無顯著性差異(P>0.05)。股骨長度、直徑等指標亦無顯著性差異。與空白對照組相比,樣品低劑量組大鼠骨鈣含量明顯增加(P<0.05),中劑量、高劑量與碳酸鈣對照組的骨鈣含量增加極為顯著(P<0.01),顯示鈣攝入量的提高與股骨鈣含量的增加呈劑量依賴性關系。
2.4 活性鈣生物利用度
2.4.1 鈣劑量對大鼠血清生化指標的影響

表7 鈣劑量對大鼠血清生化指標的影響Table7 Effects of calcium concentration on biochemical parameters in serum of raattss
如表7所示,與空白對照組相比,樣品高劑量組與碳酸鈣對照組血清鈣含量顯著增加(P<0.05);樣品低劑量組與碳酸鈣對照組血清磷結果與空白對照組有顯著差異(P<0.05),樣品高劑量組有極顯著性差異(P<0.01)。與空白對照組相比,各樣品組血清堿性磷酸酶含量的變化并不顯著(P>0.05)。
2.4.2 鈣劑量對大鼠鈣代謝的影響
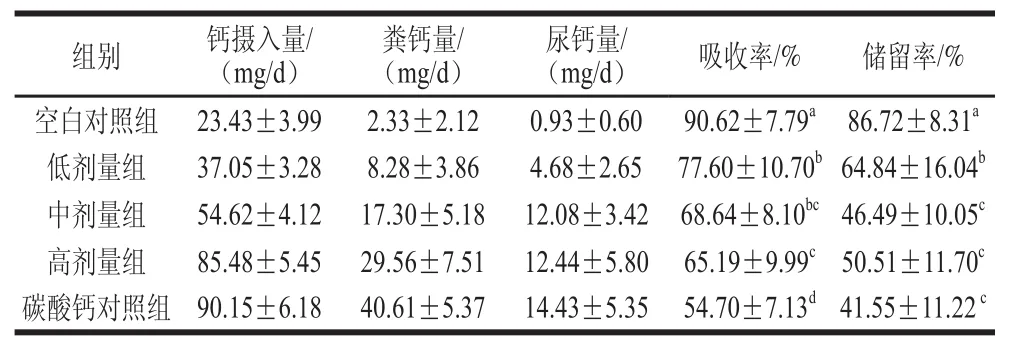
表8 大鼠鈣代謝指標Table8 Effects of calcium concentration on calcium absorption and retention of raattss
鈣的吸收率與儲留率反映了鈣在胃腸道的吸收情況,以及被吸收的鈣被機體儲備和用于維持正常生理功能的程度[21]。鈣在生物體中的吸收利用通常包括攝入、吸收和排泄3 個過程[22]。如表8所示,由于空白對照組的鈣攝入高度缺乏,處于“鈣饑餓”狀態[23-24],因此其鈣吸收率與儲留率顯著高于其余樣品組(P<0.05)。而隨著鈣攝入量的逐漸提高,樣品低、中、高劑量組鈣的吸收率和儲留率逐漸降低。與碳酸鈣對照組相比,樣品高劑量組的鈣吸收率明顯提高(P<0.05),儲留率無顯著差異(P>0.05)。
按照現有的保健食品評價原則和方法,對含鈣產品評判標準:骨鈣含量或骨密度值顯著高于鈣低劑量組,而且不低于相應劑量的碳酸鈣對照組,同時鈣的吸收率不低于碳酸鈣對照組,即可判斷該受試樣品具有提高骨密度的作用[25]。與空白對照組相比,魚骨活性鈣低劑量組大鼠骨鈣含量明顯增加(P<0.05),中、高劑量組與碳酸鈣對照組骨鈣含量增加極顯著(P<0.01),且樣品高劑量組大鼠的骨鈣含量與相同鈣水平的碳酸鈣對照組無明顯差異(P>0.05)(表6)。鈣吸收率測定結果顯示活性鈣高劑量組的鈣吸收率顯著高于相同鈣水平的碳酸鈣對照組(P<0.05)(表8)。因此判斷魚骨活性鈣可作為一種有效的鈣營養強化劑。
3 結 論
綜上所述,鱈魚骨可作為一種優良的天然鈣源。使用鱈魚骨活性鈣樣品對大鼠進行鈣吸收功效研究,結果表明魚骨活性鈣具有較好的安全性;與空白對照組相比,活性鈣低劑量組大鼠骨鈣含量明顯增加(P<0.05),中劑量、高劑量骨鈣含量增加極顯著(P<0.01)。鈣代謝實驗測定結果顯示魚骨活性鈣高劑量組鈣吸收率顯著高于相同鈣水平的碳酸鈣對照組(P<0.05)。
[1] TEEGARDEN D. Calcium intake and reduction in weight or fat mass[J]. The Journal of Nutrition, 2003, 133(Suppl 1): 249-251.
[2] LIU S, SONG Y, FORD E S, et al. Dietary calcium, vitamin D, and the prevalence of metabolic syndrome in middle-aged and older US women[J]. Diabetes Care, 2005, 28(12): 2926-2932.
[3] CADOGAN J, EASTELL R, JONES N, et al. Milk intake and bone mineral acquisition in adolescent girls: randomised, controlled intervention trial[J]. BMJ-British Medical Journal, 1997, 315(7118): 1255-1260.
[4] Jr JOHNSTON C C, MILLER J Z, SLEMENDA C W, et al. Calcium supplementation and increases in bone mineral density in children[J]. New England Journal of Medicine, 1992, 327(2): 82-87.
[5] ITO S, ISHIDA H, UENISHI K, et al. The relationship between habitual dietary phosphorus and calcium intake, and bone mineral density in young Japanese women: a cross-sectional study[J]. Asia Pacifi c Journal of Clinical Nutrition, 2011, 20(3): 411.
[6] 孫曉紅, 詹國瑛. 補鈣對大鼠峰值骨量形成和預防骨質疏松的作用[J].營養學報, 2001, 23(1): 40-43.
[7] CHEVALLEY T, RIZZOLI R, NYDEGGER V, et al. Effects of calcium supplements on femoral bone mineral density and vertebral fracture rate in vitamin-D-replete elderly patients[J]. Osteoporosis International, 1994, 4(5): 245-252.
[8] PRINCE R, DEVINE A, DICK I, et al. The effects of calcium supplementation (milk powder or tablets) and exercise on bone density in postmenopausal women[J]. Journal of Bone and Mineral Research, 1995, 10(7): 1068-1075.
[9] RIGGS B L, O’FALLON W M, MUHS J, et al. Long-term effects of calcium supplementation on serum parathyroid hormone level, bone turnover, and bone loss in elderly women[J]. Journal of Bone and Mineral Research, 1998, 13(2): 168-174.
[10] SHEA B, WELLS G, CRANNEY A, et al. Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis[J]. Endocrine Reviews, 2002, 23(4): 552-559.
[11] 中國居民營養與健康狀況調查報告之三: 2002居民體質與營養狀況[M]. 北京: 人民衛生出版社, 2006.
[12] 中國營養學會. 中國居民膳食營養素參考攝入量[M]. 北京: 中國輕工業出版社, 2001.
[13] GILDBERG A, ARNESEN J A, CARLEH?G M. Utilisation of cod backbone by biochemical fractionation[J]. Process Biochemistry, 2002, 38(4): 475-480.
[14] 霍健聰, 鄧尚貴, 童國忠. 鱈魚骨鈣片的制備及其生物利用[J]. 水產學報, 2010, 3(4): 382-388.
[15] 王建中, 鄧仁芳, 朱瑞龍. 淡水魚魚頭與魚骨的利用[J]. 食品科學, 1994, 15(2): 47-50.
[16] 吳燕燕, 李來好, 林洪. 羅非魚骨制備CMC 活性鈣的工藝及生物利用的研究[J]. 食品科學, 2005, 26(2): 114-117.
[17] 邵明栓, 陶敏, 向蔚, 等. 斑點叉尾鮰魚骨脫脂及其制備CMC活性鈣的工藝優化[J]. 食品科學, 2010, 31(20): 111-115.
[18] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005, 89(3): 363-372.
[19] 薛長湖, 李兆杰. 由鱈魚排制備活性鈣[J]. 青島海洋大學學報: 自然科學版, 1995, 25(2): 173-179.
[20] OLSZTA M J, CHENG X, JEE S S, et al. Bone structure and formation: a new perspective[J]. Materials Science and Engineering: R: Reports, 2007, 58(3): 77-116.
[21] JACKSON M J. The assessment of bioavailability of micronutrients: introduction[J]. European Journal of Clinical Nutrition, 1997, 51(1): 1-2.
[22] GUéGUEN L, POINTILLART A. The bioavailability of dietary calcium[J]. Journal of the American College of Nutrition, 2000, 19(Suppl 2): 119-136.
[23] 何麗, 薛安娜, 付萍. 多種鈣劑不同鈣含量對大鼠鈣吸收及骨密度的影響[J]. 衛生研究, 2002, 31(4): 258-260.
[24] 呂瑩. 大豆肽結合鈣的機制及其促進機體鈣吸收和增強骨質量的生物學效應[D]. 北京: 中國農業大學, 2010.
[25] 衛生部. 衛法監發[2003]42號 保健食品檢驗與評價技術規范[S]. 2003版.
Optimization of Preparation Process for Active Calcium from Cod Bone by Orthogonal Array Experiments and Its Oral Bioavailability in Vivo
WANG Shanshan1,2, LI Bafang1,*, ZHOU Deqing2, HOU Hu1
(1. College of Food Science and Technology, Ocean University of China, Qingdao 266003, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
Objective: To determine the optimum conditions for the preparation of active calcium from cod bone through orthogonal array experiments and to investigate its bioavailability. Methods: Compositional analyses and histological observation of cod bone were performed. The optimum parameters for preparng active calcium from cod bone were obtained by orthogonal array experiments. The calcium defi ciency model in rats induced by low-calcium diet was used to investigate the calcium bioavailability by detecting the contents of serum calcium and bone calcium and the indicators of calcium metabolism. Results: The contents of calcium and phosphorous in cod bone were 207.8 mg/g and 100.9 mg/g, respectively, indicating a ratio of approximately 2:1 between the two elements. Tightly and firmly combined hydroxyapatite crystals characterized by the fl at tabular shape were found under scanning electron microscopy (SEM) observation. The optimum acid extraction conditions for active calcium from cod bone were determined as follows: extraction temperature, 100 ℃; extraction time, 120 min; ratio of citric to malic acid, 1:2; and acid concentration, 15% leading to a calcium yield of 96.15%. Compared with the blank control group, the active calcium at all doses investigated exhibited signifi cantly higher contents of femur calcium. The results of calcium metabolism experiments suggested that the calcium absorption of high dose group was signifi cantly higher than that of calcium carbonate group. Conclusions: These results demonstrate that cod bone is a good calcium resource and the active calcium extracted from cod bone possesses excellent bioavailability and could be used as a natural calcium supplement.
cod bone; active calcium; biological availability; calcium supplement; high-value utilization
R336
A
1002-6630(2015)20-0013-06
10.7506/spkx1002-6630-201520003
2015-01-21
國家高技術研究發展計劃(863計劃)項目(2014AA093508);國家自然科學基金面上項目(31471606);青島市博士后研究人員應用研究項目(ZQ51201415031)
王珊珊(1984—),女,博士,研究方向為海洋生物活性物質。E-mail:wsstougao@126.com
*通信作者:李八方(1953—),男,教授,博士,研究方向為海洋生物活性物質、功能食品與制品。E-mail:bfl i@ouc.edu.cn

