TFF1在肺癌中的表達及作用研究
劉開泰 陸妙珍 褚宇東
TFF1在肺癌中的表達及作用研究
劉開泰 陸妙珍 褚宇東
目的 研究三葉因子1(TFF1)在肺癌組織及肺癌細胞株中的表達、甲基化狀態及其功能。方法選取98例非小細胞肺癌患者手術切除的肺癌組織,采用RT-PCR、MSP檢測TFF1在肺癌組織中的表達與甲基化狀態,分析其與患者臨床特點的相關性,以及檢測肺癌細胞株H23、H1299、L78、H446、H157及95D中TFF1的表達和甲基化狀態以及5-aza-2'-deoxycytidine(DAC)處理后細胞株中TFF1表達的變化。TFF1轉染H23細胞株,MTT法及克隆形成實驗檢測其增殖能力和克隆能力的變化,細胞凋亡實驗及Western blot檢測凋亡相關蛋白Caspase3表達水平。結果TFF1在肺癌組織中的甲基化率為56.1%(55/98)。TFF1甲基化與肺癌患者的TNM分期和淋巴結轉移顯著相關(P<0.001)。TFF1在H23和H157中無表達,在H1299、H446及95D中表達較低,在L78中表達較高。DAC處理后,細胞株TFF1表達的變化分別為表達恢復(H23、H157),表達增強(H1299,H446,95D)和無明顯改變(L78)。恢復表達TFF1后,H23細胞株的增殖及克隆形成能力明顯減弱(P<0.05),細胞凋亡率和凋亡相關蛋白Caspase3活性片段的表達明顯增加。結論TFF1在肺癌組織中的甲基化狀態與肺癌的TNM分期和轉移密切相關。TFF1在肺癌細胞中的表達受DNA甲基化的調控。肺癌細胞株H23中恢復表達TFF1可以抑制其增殖和克隆能力,促進其凋亡。
TFF1 肺癌 DNA甲基化 表觀遺傳學
1 材料和方法
1.1 人組織標本及細胞系 98例肺癌及癌旁組織來自寧波李惠利醫院胸外科手術切除的肺癌患者,其中Ⅰ~Ⅱ期38例,Ⅲ~Ⅳ期60例。癌旁標本為距離腫瘤5cm遠的肺組織,標本獲取后立即放置到液氮中保存。肺癌細胞系H23、H1299、L78、H446、H157及95D,均購自ATCC,37℃,5%CO2孵箱中復蘇、培養及傳代。
1.2 DAC(5-aza-2′-deoxycytidine)處理 肺癌細胞系(H23、H1299、L78、H446、H157、95D)在處理前12h以低濃度(30%融合度)重鋪于培養皿中,之后細胞用DAC(美國Sigma公司)處理,DAC終濃度為2 μmol/L,每24h換液,加藥滿96h收集細胞RNA。
1.3 提取RNA及 RT-PCR 采用Trizol(美國Life Technologies公司)法提取細胞總RNA,1%瓊脂糖凝膠電泳及紫外分光光度計鑒定RNA的質量及濃度。提取的RNA在-80℃保存。5μg總RNA用來逆轉錄合成cDNA并稀釋到100μl,取2.5μl稀釋后cDNA進行PCR反應(25μl體系)。TFF1基因PCR引物序列如下:上游引物5′-CTGTTTCGACGACACCGTTC-3′,下游引物5′-TCTGGGACTAATCACCGTGC-3(華大基因),產物長度155bp,35個循環,GAPDH作為內參:上游引物:5′-GACCACAGTCCATGCCATCAC-3′,下游引物5′-GTCCACCACCCTGTTGCTGTA-3′(華大基因),25個循環。
1.4 DNA提取及硫化 冷凍標本迅速研磨后于加有蛋白酶K的DNA提取液TES中消化過夜,用酚氯仿法抽提,100%乙醇沉淀,75%乙醇洗2遍,TE稀釋后分光光度計測定DNA濃度,-20℃保存備用。2μg DNA溶于50μl水中,50℃金屬浴中重亞硫酸鹽處理16h,DNA樣本應用Wizard DNA Clean-Up系統純化回收,氫氧化鈉脫磺酸處理,乙醇洗滌后溶于20μl水中,-20℃保存備用。
1.5 MSP(methylation-specific PCR) MSP引物:U(非甲基化引物):上游引物5′-TGGGTTTTGGTTAGGGTGTT-3′,下游引物5′-CTCATCCCTAACTCAAAATCA-3′,產物長度123bp,35個循環;M(甲基化引物)上游引物5′-TGGGTTTCGGTTAGGGTGTC-3′,下游引物5′-CTCATCCCTAACTCGAAATCG-3′,產物長度123bp,35個循環。每個MSP分析都包括一個陽性對照[體外甲基化DNA(IVD)]和一個陰性對照(正常人循環中淋巴細胞DNA)。MSP結果在2%瓊脂糖凝膠電泳中分析。
1.6 TFF1和Vector轉染H23細胞 胰酶消化H23細胞并計數,細胞鋪6孔板,使其在轉染日密度為90%。混合稀釋的DNA和稀釋的Lipofectamine2000(美國Invitrogen公司)來轉染細胞,混合比例(1∶2/脂質體體積:DNA質量),室溫下保溫20min。將復合物加入到每孔中,輕輕混勻。37℃,5%的CO2中保溫24h后將細胞傳代至新鮮培養基中,2d后加入篩選抗生素G418,進行穩定表達,檢測轉染效率。
1.7 MTT增殖實驗 轉染TFF1和轉染Vector滿48h的H23細胞消化后以2 000個/孔鋪在96孔板中,分別在0、24、48、72h通過MTT分析方法測定細胞增殖,每個時間段包括5個復孔,用酶標儀492nm波長處所測定OD值表示。
1.8 克隆形成實驗 轉染TFF1和轉染Vector滿48h的H23細胞消化后以500個/孔鋪在6孔板中,同時用G418篩選陽性細胞,每3d換1次液,14d后采用75%冷乙醇固定細胞并用結晶紫染色,計數細胞所形成克隆數,統計分析。
1.9 細胞凋亡實驗 轉染TFF1和轉染Vector滿48h的H23細胞消化后用PI及Annexin V染色后于流式細胞儀中測定,分析早凋亡、晚期凋亡細胞所占細胞比例,統計分析其差異。
1.10 Western blot檢測 收集轉染TFF1和空載Vector 48h后的H23細胞,用預冷PBS洗滌后,立刻加入含有10%蛋白酶抑制劑PMSF的RIPA裂解液并置于冰上裂解15min,4℃離心20min收集上清液,加入適量5×蛋白上樣緩沖液,沸水煮5min后,SDS-PAG膠電泳后電轉到PVDF膜上,牛奶封閉2h,一抗(cleaved caspase-3、βactin)室溫孵育2h或4℃過夜后,辣根過氧化物酶(HRP)標記的二抗孵育1~2h,用增強發光液檢測目的蛋白。
1.11 統計學處理 應用SPSS 13.0統計軟件。采用Kendall相關系數分析相關性,計數資料的比較采用χ2檢驗。
2 結果
2.1 TFF1在肺癌細胞系中的表達與DNA甲基化的關系 RT-PCR檢測顯示TFF1在H23和H157中無表達,在H1299、H446及95D中表達較低,在L78中表達較高。DAC處理肺癌細胞系后,H23和H157中TFF1表達恢復,而H1299、H446及95D中TFF1表達增強,在L78細胞中TFF1的表達無明顯改變。TFF1在肺癌細胞系H23和H157中呈完全甲基化,在H1299、H446及95D中呈半甲基化,在L78中為非甲基化狀態(圖1),說明TFF1在肺癌細胞系中的表達缺失或減低與DNA甲基化相關。
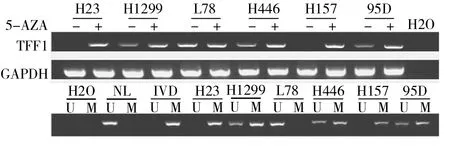
圖1 TFF1在肺癌細胞系中的表達與DNA甲基化的關系(U:非甲基化;M:甲基化;NL:陰性對照;IVD:陽性對照)
2.2 TFF1在肺癌組織中發生甲基化的頻率 應用MSP測定5例正常肺組織及98例肺癌組織中TFF1的甲基化狀態,發現TFF1在5例正常組織中均為非甲基化狀態,排除組織特異性,而TFF1在98例肺癌組織中的甲基化率為56.1%(55/98)(圖2)。

圖2 TFF1在肺癌組織中的甲基化狀態(U:非甲基化;M:甲基化;NL:陰性對照;IVD:陽性對照)
2.3 TFF1甲基化與肺癌患者的TNM分期及淋巴結轉移的關系 TFF1甲基化與肺癌患者的TNM分期顯著相關(P<0.001),同時TFF1甲基化與肺癌患者的淋巴結轉移顯著相關(P<0.001),而與肺癌患者的性別、年齡以及腫瘤分化程度未見顯著相關性,詳見表1。
2.4 TFF1去甲基化后恢復表達與H23細胞的增殖及克隆形成能力的關系 TFF1去甲基化后可以明顯的抑制H23細胞的增殖(P<0.05)(圖3A),H23細胞的克隆形成數在TFF1去甲基化后明顯減少(P<0.05)(圖3B),說明TFF1的去甲基化可以抑制H23細胞的增殖及克隆形成能力。
2.5 TFF1去甲基化后恢復表達與H23細胞凋亡的關系 細胞凋亡實驗結果顯示TFF1去甲基化后H23細胞的凋亡率顯著增加(圖4A),Western blot結果顯示凋亡相關蛋白Caspase3的活性片段的表達在TFF1去甲基化后恢復表達明顯增加(圖4B),說明TFF1去甲基化可以激活凋亡通路進而引起細胞凋亡的增加。

表1 TFF1甲基化與肺癌患者臨床特點相關性分析

圖3 TFF1去甲基化后的恢復表達可以抑制H23細胞的增殖及克隆形成(A:MTT增殖實驗;B:克隆形成實驗)

圖4 TFF1去甲基化后恢復表達可以促進H23細胞的凋亡[(A:TFF1轉染組細胞凋亡率顯著高于空載(Vector)轉染組(P<0.05);B:Western blot檢測各轉染組蛋白表達;D1:死亡細胞;D2:晚期凋亡細胞;D3:活細胞;D4:早期凋亡細胞]
3 討論
肺癌是全球癌癥相關死亡的最主要原因之一,其早期診斷率低、病死率高,嚴重威脅著人類的健康[1]。近年來越來越多的研究顯示,DNA甲基化是腫瘤中抑癌基因表達缺失或降低的主要原因之一,在多種腫瘤的發生、發展中起到了重要作用[8-9]。也有研究顯示表觀遺傳學的改變,尤其是抑癌基因的啟動子區甲基化與肺癌的發生、發展有著密切的關系[10-11]。研究顯示TFF1在多種腫瘤中如前列腺癌、乳腺癌、胰腺癌及上消化道癌的腫瘤形成及其轉移相關[12-15],而在胃癌中TFF1的表達受DNA甲基化的調控[16]。已有文章報道TFF1在肺癌中的表達及功能[17-19],但是TFF1在肺癌中的表觀遺傳學改變及調控尚未見報道。本研究結果顯示,TFF1在肺癌細胞中存在表達缺失及表達降低,經過DAC(去甲基化藥物)處理后TFF1在肺癌細胞中的表達得到了恢復,與肺癌細胞中TFF1的甲基化狀態相一致,表明TFF1在肺癌中的表達受DNA甲基化調控。在98例肺癌組織中,TFF1的甲基化率高達56.1%,TFF1在肺癌中呈現高甲基化,并且TFF1的甲基化狀態與肺癌的TNM分期顯著相關,提示TFF1的甲基化可作為早期肺癌診斷的潛在標志物。在肺癌細胞系H23中使TFF1去甲基化而恢復表達后可以抑制癌細胞的增殖和克隆形成,同時可以激活凋亡通路引起細胞凋亡的增加,起到抑癌作用。因此,TFF1可作為肺癌治療的潛在靶標。
綜上所述,TFF1在肺癌中的表達受DNA甲基化的調控,TFF1在肺癌中高甲基化與腫瘤TNM分期及淋巴結轉移相關,使TFF1去甲基化后恢復表達可抑制H23細胞的增殖和克隆形成,并促進細胞的凋亡,起到抑癌作用。
[1]Rebecca S,Deepa N,Ahmedin J.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Liu W B,Jiang X,Han F,et al.LHX6 acts as a novel potential tumour suppressor with epigenetic inactivation in lung cancer[J].Cell Death Dis,2013,4:882.
[3]Jakopovic M,Thomas A,Balasubramaniam S,et al.Targeting the Epigenome in Lung Cancer:Expanding Approaches to Epigenetic Therapy[J].Front Oncol,2013,3:261.
[4]Tanaka T,Nakamura J,Kitajima Y,et al.Loss of trefoil factor 1 is regulated by DNA methylation and is an independent predictive factor for poor survival in advanced gastric cancer[J].Int J Oncol, 2013,42(3):894-902.
[5]Feng G,Zhang Y,Yuan H,et al.DNA methylation of trefoil factor 1(TFF1)is associated with the tumorigenesis of gastric carcinoma[J].Mol Med Rep,2014,9(1):109-117.
[6]Hoffmann W,Jagla W.Cell type specific expression of secretory TFF peptides:colocalization with mucins and synthesis in the brain[J].Int Rev Cytol,2002,213:147-181.
[7]Colombel M,Dante R,Bouvier R,et al.Differential RNA expression of the pS2 gene in the human benign and malignant prostatic tissue[J].Prostate Cancer Prostatic Dis,1999,2(S3):S11.
[8]Kaneda A.Epigenomicmarkersfortumors[J].NihonRinsho,2012, 70(5):749-753.
[9]McChesney P A,Aiyar S E,Lee O J,et al.Cofactor of BRCA1:a novel transcription factor regulator in upper gastrointestinal adenocarcinomas[J].Cancer Res,2006,66(3):1346-1353.
[10]Balgkouranidou I,Liloglou T,Lianidou E S.Lung cancer epigenetics:emerging biomarkers[J].Biomark Med,2013,7(1):49-58.
[11]Yang I V,Schwartz D A.Epigenetic control of gene expression inthelung[J].AmJRespirCritCareMed,2011,183(10):1295-1301.
[12]Tomasetto C,Masson R,Linares J L,et al.pS2/TFF1 interactsdirectly with the VWFC cysteine-rich domains of mucins[J].Gastroenterology,2000,118(1):70-80.
[13]Colombel M,Dante R,Bouvier R,et al.Differential RNA expression of the pS2 gene in the human benign and malignant prostatic tissue[J].J Urol,1999,162(3 Pt 1):927-930.
[14]Buache E,Etique N,Alpy F,et al.Deficiency in trefoil factor 1 (TFF1)increases tumorigenicity of human breast cancer cells and mammary tumor development in TFF1-knockout mice[J].Oncogene,2011,30(29):3261-3273.
[15]Arumugam T,Brandt W,Ramachandran V,et al.Trefoil factor 1 stimulates both pancreatic cancer and stellate cells and increases metastasis[J].Pancreas,2011,40(6):815-822.
[16]Tomita H,Takaishi S,Menheniott TR,et al.Inhibition of gastric carcinogenesis by the hormone gastrin is mediated by suppression of TFF1epigeneticsilencing[J].Gastroenterology,2011, 140(3):879-91.
[17]Dietrich D,Hasinger O,Liebenberg V,et al.DNA methylation of the homeobox genes PITX2 and SHOX2 predicts outcome in non-small-cell lung cancer patients[J].Diagn Mol Pathol,2012, 21(2):93-104.
[18]Qu Y Q,Yang Y,Ma D D,et al.Increased trefoil factor 3 levels in the serum of patients with three major histological subtypes of lung cancer[J].Oncol Rep,2012,27(4):1277-1283.
[19]Liu S Q,Stromberg A,Tai H H,et al.Thiamine transporter gene expression and exogenous thiamine modulate the expression of genes involved in drug and prostaglandin metabolism in breast cancer cells[J].Mol Cancer Res,2004,2(8):477-487.
(本文編輯:嚴瑋雯)
ObjectiveTo investigate the expression and methylation status of Trefoil factor 1(TFF1)in lung cancer tissues and lung cancer cell lines.MethodsExpression and methylation status of TFF1 in 98 non-small cell lung cancer(NSCLC) tissues and lung cancer cell lines(H23,H1299,L78,H446,H157 and 95D)were detected by RT-PCR and methylation specific PCR(MSP),respectively.The changes of TFF1 expression was also examined after the lung cancer cell lines treated with 5-aza-2'-deoxycytidine(DAC).After H23 cells were transfected with TFF1 gene,the variation of proliferation and cloning ability of H23 cells was examined with MTT assay and colony formation,respectively.The apoptosis H23 cells was also determined and the expression of Caspase3 was detected with Western blot after transfection.ResultsThe methylation rate of TFF1 in lung cancer tissues was 56%(55/98).TFF1 methylation was significantly correlated with TNM stage and lymph node metastasis in lung cancer patients(P<0.001).There was no expression of TFF1 in H23 and H157 cells,low expression in H1299,H446 and 95D cells,and high expression in L78 cells;after treatment of DAC,the expression of TFF1 was restored(H23 and H157),increased (H1299,H446 and 95D)or not changed(L78).Transfection of TFF1 decreased proliferation and colony formation,promoted cell apoptosis rate and enhanced expression of Caspase3 in H23 cells.ConclusionThe methylation status of TFF1 in NSCLC tissue is closely related to TNM stages and metastasis of lung cancer.The expression of TFF1 in lung cancer is associated with DNA methylation.Restoration of TFF1 expression in lung cancer cells may suppress cell proliferation and accelerate cell apoptosis.
TFF1 Lung cancerDNA methylation Epigenetic

315040 寧波市醫療中心李惠利醫院放療科(劉開泰、陸妙珍),腎內科(褚宇東)
劉開泰,E-mail:lkt1982@126.com系統上皮中[4]。研究表明,TFF1在胃癌中起抑癌作用,TFF1在胃癌細胞中的表達受啟動子區甲基化的調控[5]。TFF1與黏蛋白核心蛋白相互作用以穩定胃黏膜表面黏液凝膠層,對胃黏膜起保護和再生作用[6]。也有研究顯示,TFF1表達與多種腫瘤如前列腺癌、乳腺癌、胰腺癌及上消化道癌的形成及轉移密切相關[7]。因此,本文通過研究TFF1在肺癌中的表達和調控機制,探討其在肺癌發生、發展過程中的作用,為肺癌的臨床診治提供參考。
2014-08-15)
肺癌是全球常見惡性腫瘤并且是導致癌癥相關死亡的主要原因之一[1]。盡管傳統的細胞學和影像學檢測在肺癌的診斷中能起重要作用,但仍有67%的新診斷肺癌患者已經到了肺癌的較高階段[2]。肺癌的發生是一個多相的過程,包括遺傳學及表觀遺傳學的改變,其中DNA甲基化起到了重要的作用。抑癌基因的甲基化與表觀遺傳現象中的基因沉默密切相關[3]。尋找發生于啟動子區甲基化的新功能基因是目前肺癌研究領域的熱點之一,有助于理解肺癌發生過程中腫瘤抑制通路的分子機制,同時有助于找到肺癌的潛在診斷及治療靶標。三葉因子(trefoil factor,TFF)家族是一組蛋白酶抵抗的肽段,包括TFF1、TFF2以及TFF3,均廣泛表達于消化

