樹突狀細胞激活介導副干酪乳桿菌L9對CD4+T細胞的分化作用研究
文/楊 景 劉松玲 葛紹陽 劉 力 桑 躍 武永超 張建銘 劉治麟 趙 亮,*
(1中國農業大學食品科學與營養工程學院,北京市高等學校畜產品工程研究中心;2江西鴻燕健康科技有限公司;3北京和益源生物技術有限公司)
CD4+T細胞在機體細胞免疫系統中有重要作用,初始CD4+T細胞(Na?ve CD4+T)在機體內不同細胞因子的作用下,分化為一系列具有不同功能的細胞群。樹突狀細胞(Dendritic Cells,DCs)是目前已知的體內功能最強的抗原呈遞細胞,在機體的免疫調節中有重要功能。CD103+DCs,作為一種重要的調節性樹突狀細胞(regDCs),可通過分泌視黃酸和轉化生長因子-β(TGF-β)等細胞因子,促進na?ve CD4+T細胞向調節性T(Foxp3+Treg)細胞分化,在調節機體內的Th1/Th2免疫失衡和維持機體免疫自穩中起重要作用[1]。
益生菌可調節腸道微生態的平衡和腸黏膜免疫系統。研究表明,益生菌可以通過提高小鼠淋巴細胞中Foxp3+Treg細胞數量,調節小鼠炎癥反應中的T細胞平衡[2],而這種調節作用與其誘導DCs成熟、分化有關。已有研究表明,益生菌可以與DCs表面Toll樣受體或C型凝集素受體等結合,誘導DCs成熟及細胞因子的分泌[3],進而增加機體內Foxp3+Treg細胞數量,緩解風濕、腸炎和過敏性哮喘等免疫失衡性疾病癥狀[4,5]。
副干酪乳桿菌L9分離自健康人腸道。課題組前期研究表明,L9具有調節小鼠腸道免疫功能的生物學活性[6]。然而,L9是否通過調節DCs功能,促進CD4+T分化發揮免疫調節生物學活性尚不清楚。因此,本研究以骨髓源樹突狀細胞(BMDCs)為模型,研究L9對其細胞因子的分泌及CD103表達的影響,利用L9誘導后的BMDCs與小鼠脾CD4+T細胞聯合培養,分析Foxp3+Treg細胞比例。
1 材料與方法
1.1 菌株
副干酪乳桿菌L 9(曾用名L14)由教育部功能乳品重點實驗室提供。將實驗菌株L9接種至MRS培養基中,37 °C培養至生長穩定期(12 h),將菌液4 500 r/min離心10 min后,用滅菌的0.01 mol/L、pH值7.4 PBS緩沖液重懸,調整菌液濃度為1.0×1010CFU/mL,100 ℃水浴30 min,經檢驗無活菌存在,且菌株保持正常形態。
1.2 試驗動物
本研究動物為SPF級BALB/c小鼠,體質量18~22 g,6 周齡。飼養于中國農業大學食品學院動物房,環境溫度24 ℃,濕度40%~60%,光照12 h,試驗前靜養1 周左右。
1.3 試劑
淋巴細胞分離液為天津灝洋生物制品科技有限責任公司產品;細胞因子檢測試劑盒為R&D公司產品;RPM1640培養液購自美國Gibco公司;絲裂酶素C購自美國Sigma公司;重組小鼠粒細胞-巨噬細胞集落刺激因子(rmGM-CSF)、重組小鼠白細胞介素4(rmIL-4)購自美國Peprotech公司;流式抗體購自美國ebioscience公司。
1.4 實驗方法
1.4.1 骨髓源樹突細胞分離與培養
提取小鼠骨髓細胞,添加rmGM-CSF、rmIL-4誘導6 天后,收集細胞為BMDCs。調整細胞密度為2.0×106CFU/mL,接種于6 孔板中。設置空白組(CON),陽性對照組(LPS,1 μg/mL;Pam3C,1 μg/mL)和2 個試驗組(L9菌懸液,一組濃度為1.0×106CFU/mL,一組為1.0×107CFU/mL)。每孔總體積為3 mL,每組設置3 個重復。連續培養24 h后,將細胞懸液離心,收集上清液用于細胞因子檢測,收集細胞用于流式分析及后續實驗。
1.4.2 樹突狀細胞與小鼠脾CD4+T細胞共培養
收集各組BMDCs,經絲裂霉素C滅活處理30 min,然后與小鼠脾淋巴細胞分離的CD4+T細胞(2.0×106CFU/mL)共培養(BMDCs︰CD4+T cell=1︰10),60 h后收集細胞,用于流式分析。
1.4.3 樹突狀細胞中CD103表達及CD4+CD25+Foxp3+Treg 細胞比例檢測
收集各組BMDCs,添加單抗標記CD11c(FITC)、CD103(PE)和MHCII(PerCP-eFluor710),4 ℃下避光30 min,PBS緩沖液清洗,然后細胞懸浮于PBS緩沖液中,通過流式細胞儀檢測CD103表達情況。
收集與樹突狀細胞共培養后的小鼠脾CD4+T細胞,添加單抗標記CD4(FITC),CD25(PE)和Foxp3(APC),通過流式細胞儀檢測其表面抗原分子的表達情況,分析CD4+CD25+Foxp3+Treg 細胞比例。
1.4.4 細胞上清液中細胞因子水平檢測
測定BMDCs細胞上清液中TGF-β和IL-10濃度,按照各ELISA試劑盒說明書進行操作。
1.5 數據處理
采用SPSS12.5統計軟件進行單因素方差分析(One-Way ANOVA),Duncan’s multiple-comparison test分析組間差異,以P<0.05為顯著性,各組數據以Mean±SD表示。
2 結果與討論
2.1 L9 調節骨髓源樹突狀細胞因子分泌
樹突狀細胞可分泌調節性細胞因子,參與機體的免疫調節。由圖1可以看出,與空白對照組相比,L9能夠顯著促進BMDCs分泌調節性細胞因子IL-10和TGF-β,且有劑量效應。高劑量L9促進TGF-β分泌增加了3.03 倍,高于陽性對照組;同時促進IL-10分泌增加了26.58 倍。
近年來的研究發現,DCs不僅是體內重要的抗原遞呈細胞,而且對機體免疫反應發揮著重要的調節作用。在自身免疫性疾病中,分泌高水平調節性細胞因子(IL-10和TGF-β)的調節性DCs能夠促進自身反應性淋巴細胞凋亡和誘導Treg細胞的生成,抑制多種炎性細胞因子的分泌,從而維持機體免疫耐受[1]。益生菌具有調節機體內細胞和體液免疫應答的功能,能夠維持機體免疫系統健康和穩定。有研究發現,益生菌可以與DCs表面受體結合(如Toll樣受體,C型凝集素受體等),誘導DCs功能,但存在菌株差異性[3,7];益生菌可以提高小鼠腸系膜淋巴結的調節性DCs中IL-10和TGF-β的mRNA表達,促進Treg細胞增多,緩解小鼠腸道炎癥[4];長雙歧桿菌可以調節BMDCs成熟狀態,促進IL-10和TGF-β分泌,調節機體內Treg細胞增多,緩解小鼠花粉過敏反應[5]。
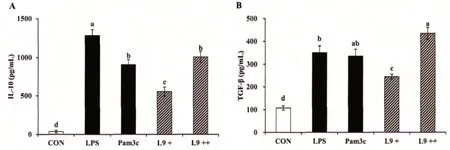
圖1 L9 對骨髓源樹突狀細胞分泌細胞因子的影響
本研究結果表明,L9可以促進BMDCs分泌調節性細胞因子IL-10和TGF-β,具有調節CD4+T細胞向Foxp3+Treg細胞分化的潛能。
2.2 L9 調節骨髓源樹突狀細胞 中CD103表達
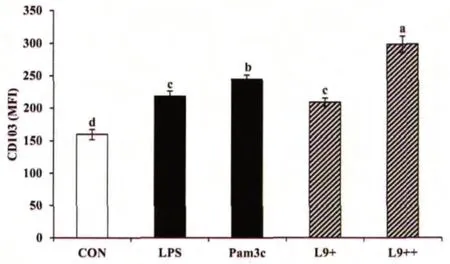
圖2 L9對骨髓源樹突狀細胞中CD103表達的影響
CD103+DCs是參與機體免疫調節的一類重要的調節性DCs,可分泌調節性細胞因子,促進機體內Foxp3+Treg細胞的產生[1]。本研究中,采用流式細胞術分析了樹突狀細胞中CD103的表達,如圖2所示,與空白組相比,L9能夠顯著促進BMDCs中CD103的表達,且高劑量L9組中CD103表達的升高幅度達87.06%,高于陽性對照組。
機體內的DCs有許多不同亞型,其中CD103+DCs是一種重要的調節性DCs,參與調節許多炎癥反應。腸黏膜層的CD103+DCs可以通過TGF-β和視黃酸代謝途徑促進naive CD4+T細胞向Treg細胞分化[2]。有研究表明,食物過敏小鼠的腸組織淋巴細胞中CD103+DCs細胞比例降低[8],證實了CD103+DCs在調節機體免疫耐受方面的重要性。益生菌與CD103+DCs相關研究表明,用雙歧桿菌灌胃小鼠,可提高小鼠腸道中CD103+DCs分泌IL-10水平,促進Treg細胞的產生,緩解小鼠腸道炎癥反應[9]。相似實驗表明,益生菌雖然可以促進DCs中IL-10和TGF-β的mRNA表達,但CD103+DCs細胞比例并沒有顯著變化[4]。
在本研究中,L9不但促進了BMDCs中IL-10和TGF-β的分泌,還促進了CD103的表達,表明L9可以通過提高CD103+DCs細胞數量來參與調節機體的免疫平衡。
2.3 L9 調節CD4+T 細胞向Foxp3+Treg 細胞分化
調節性DCs可以促進機體內Foxp3+Treg細胞分化,參與機體的免疫調節。為了更全面地研究L9對DCs功能的促進作用,采用L9誘導后的BMDCs與小鼠CD4+T 細胞聯合培養,使用流式細胞術分析了CD4+CD25+Foxp3+Treg細胞比例。由圖3可以看出,與空白組相比,L9組小鼠CD4+淋巴細胞中CD25+-Foxp3+Treg細胞比例顯著增加,且以高劑量L9組增加幅度最大。結果表明,L9刺激后的BMDCs能夠促進過敏小鼠CD4+T 細胞中Foxp3的表達,可以調節機體T淋巴細胞平衡。

圖3 L9 對小鼠CD4+T 細胞中CD25+ Foxp3+Treg 細胞數量的影響
Foxp3+Treg細胞可以調節T細胞平衡,在建立機體免疫耐受及緩解炎癥反應中起到關鍵性作用。研究表明,益生菌可以提高小鼠體內Foxp3+Treg細胞的數量,緩解炎癥反應[4,10]。機體內na?ve CD4+T細胞向Foxp3+Treg細胞分化與CD103+DCs功能有關[2]。本研究結果表明,L9誘導的BMDCs提高CD4+T中Foxp3+Treg細胞比例,證明L9可以通過誘導DCs功能,參與Foxp3+Treg細胞介導的免疫調節作用。
3 結論
以骨髓源樹突狀細胞(BMDCs)為模型,研究了L9對DCs功能的影響。研究表明,L9促進BMDCs分泌調節性細胞因子(IL-10和TGF-β),提高CD103表達,可以誘導Foxp3+Treg細胞分化。由此可見,L9可以通過調節DCs分泌調節性細胞因子,誘導機體偏向Foxp3+Treg型細胞免疫應答。本研究結果揭示,L9的免疫調節活性與其提高CD103表達有關,但其分子免疫學機制還不是很清楚,有待于進一步研究。
[1]Scott C L,Aumeunier A M,Mowat A M.Intestinal CD103+dendritic cells:master regulators of tolerance?.Trends in Immunology,2011,32(9):412-419.
[2]Lyons A,O’Mahony D,O’Brien F,et al.Bacterial strain-specific induction of Foxp3+T regulatory cells is protective in murine allergy models.Clinical &Experimental Allergy,2010,40(5):811-819.
[3]Frei R,Lauener R P,Crameri R,et al.Microbiota and dietary interactions–an update to the hygiene hypothesis?.Allergy,2012,67(4):451-461.
[4]Kwon H,Lee C,So J,et al.Generation of regulatory dendritic cells and CD4+Foxp3+T cells by probiotics administration suppresses immune disorders.Proceedings of the National Academy of Sciences,2010,107(5):2159-2164.
[5]Schwarzer M,Srutkova D,Schabussova I,et al.Neonatal colonization of germ-free mice with Bifidobacterium longum prevents allergic sensitization to major birch pollen allergen bet V 1.Vaccine,2013,46(31):5405-5412.
[6]汪昕昕,任倩然,付天嬌,等.Lactobacillus casei-14對小鼠潰瘍性結腸炎的預防作用.甘肅農業大學學報,2013,48(2):1-5.
[7]Christensen H R,Fr?ki?r H,Pestka J J.Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells.The Journal of Immunology,2002,168(1):171-178.
[8]Smit J J,Bol Schoenmakers M,Hassing I,et al.The role of intestinal dendritic cells subsets in the establishment of food allergy.Clinical &Experimental Allergy,2011,41(6):890-898.
[9]Jeon S G,Kayama H,Ueda Y,et al.Probiotic Bifidobacterium breve induces IL-10-producing Tr1 cells in the colon.PLoS Pathogens,2012,8(5),e1002714:1-15.
[10]Round J L,Mazmanian S K.Inducible Foxp3+regulatory T-cell development by a commensal bacterium of the intestinal microbiota.Proceedings of the National Academy of Sciences,2010,107(27):12204-12209.

