經皮雌二醇凝膠在凍融胚胎移植中的應用
宋娟,龔斐,羅克莉
(1.中南大學湘雅醫學院生殖與干細胞工程研究所,長沙 410000;2.中信湘雅生殖與遺傳專科醫院,長沙 410000)
自1983 年Trounson 等采用凍融人類胚胎移植首獲成功[1]以來,凍融胚胎移植(FET)已有30多年的歷史。FET 常采用自然周期、人工替代周期及促排卵周期準備內膜[2-3]。目前人工替代周期常采用口服戊酸雌二醇的方法,但是因存在肝臟首過效應(口服給藥時肝臟門脈系統內血藥濃度為血液循環中的2~3倍),不適用于有輕度肝腎功能異常、消化道吸收障礙或口服給藥消化道癥狀嚴重的患者;另外可能影響出凝血系統,故也不宜用于有血栓形成高危因素的患者。雌二醇凝膠系17-β雌二醇的經皮劑型,無需經體內分解代謝,涂抹于皮膚后在皮內與皮下形成雌二醇蓄積庫,再緩慢釋放至全身,使雌激素濃度維持更穩定[4-5]。但是偶會出現皮疹、頭暈、惡心、乳房脹痛、陰道少量流血等副作用。本研究比較口服戊酸雌二醇和經皮17-β雌二醇凝膠在FET 子宮內膜準備中的應用,初步探討經皮17-β雌二醇凝膠在FET 中的有效性和安全性。
資料與方法
一、研究對象
回顧性分析2014年6 月~7 月于中信湘雅生殖與遺傳專科醫院生殖中心行FET 人工替代周期內膜準備的患者138例。排除標準:子宮內膜息肉、子宮內膜異位癥、宮腔粘連等明顯存在子宮內膜病變的患者。其中經皮口服戊酸雌二醇組(A 組)68例,17-β雌二醇組(B組)70例。
二、研究方法
1.用藥方案:兩組患者均于月經第2天行陰道超聲檢查雙側卵巢無優勢卵泡,于月經第3天開始用藥。A 組給予口服戊酸雌二醇片(補佳樂,1mg/片,拜耳,德國),劑量為4~6mg,1次/d。B 組給予經皮17-β雌二醇凝膠(愛思妥,雌二醇含量0.06%,法杏,法國),劑量為4.5 mg(2.5g×3 卡尺凝膠),2次/d,可在早晨、晚上或任何其它時間使用。用藥10d后復查B 超,若子宮內膜厚度≥9mm 則開始黃體支持,若內膜未達標則延長用藥時間,但最長不超過21d。黃體支持:給予黃體酮膠囊(安琪坦,Laboratoires Besins-Iscovesco,法國),200mg,2次/d。
2.凍融胚胎選擇:采用玻璃化冷凍快速復蘇法,選擇第3天胚胎評級為Ⅰ~Ⅱ級的胚胎或第5天胚胎的Ⅲ~Ⅳ級囊胚。
3.觀察指標:兩組黃體酮日子宮內膜厚度、血清雌二醇(E2)水平,兩組黃體酮給藥前E2用藥總量及用藥持續時間,FET 妊娠結局和藥物副作用。
三、統計學方法
采用SPSS 19.0軟件進行統計學分析,計量資料采用(±s)表示,組間均數比較采用t檢驗。計數資料用率(%)表示,組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
結 果
一、一般情況比較
兩組患者的年齡、體重指數(BMI)、基礎卵泡刺激素(FSH)、E2、黃體生成素(LH)、孕酮(P)、不育年限等比較,差異均無統計學意義(P>0.05)(表1)。
二、兩組患者臨床參數比較
A、B兩組黃體酮日子宮內膜厚度比較,差異無統計學意義(P>0.05);B 組黃體酮日E2水平、E2用藥總量明顯高于A 組,用藥持續天數則明顯少于A 組,差異均有統計學意義(P 均<0.05)(表2)。A組患者用藥過程中未發現明顯的藥物副作用表現;B組患者用藥過程中出現1例皮膚過敏反應,表現為輕度皮疹伴皮膚瘙癢,兩組藥物副作用發生率比較,無統計學差異(P>0.05)。
表1 兩組一般情況比較(±s)
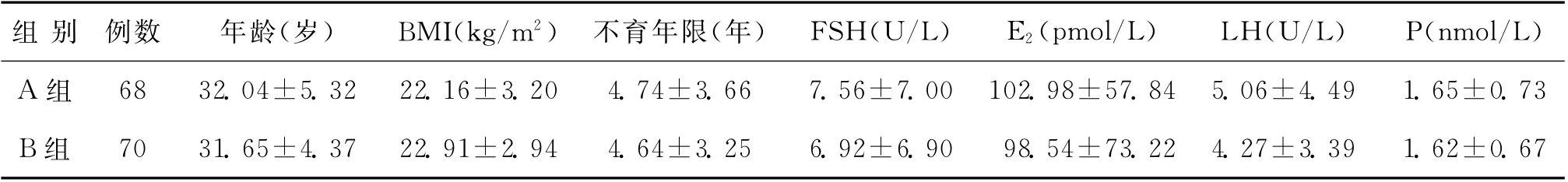
表1 兩組一般情況比較(±s)
組 別 例數 年齡(歲) BMI(kg/m2) 不育年限(年) FSH(U/L) E2(pmol/L) LH(U/L) P(nmol/L)A 組 68 32.04±5.32 22.16±3.20 4.74±3.66 7.56±7.0 0 102.98±57.84 5.06±4.49 1.65±0.73 B組 70 31.65±4.37 22.91±2.94 4.64±3.25 6.92±6.9 0 98.54±73.22 4.27±3.39 1.62±0.67
三、兩組妊娠結局相關參數比較
兩組的周期取消率、生化妊娠率、胚胎移植數、移植優胚數比較,差異均無統計學意義(P>0.05)。B組的胚胎著床率、臨床妊娠率明顯高于A 組,差異有統計學意義(P<0.05)(表3)。
表2 兩組黃體酮日子宮內膜厚度、血清E2 水平、E2 用藥總量及持續天數比較(±s)

表2 兩組黃體酮日子宮內膜厚度、血清E2 水平、E2 用藥總量及持續天數比較(±s)
注:與A 組比較,*P<0.05
組 別 例數 子宮內膜厚度(mm) E2 水平(pmol/L) 用藥總量(mg) 用藥持續天數(d)A 組 68 10.42±1.16 741.34±585.36 70.13±19.21 12.60±3.02 B組 70 10.79±1.29 1 750.22±1 390.56* 99.65±6.04* 11.13±0.57*
表3 兩組妊娠結局相關參數比較[(±s),n(%)]
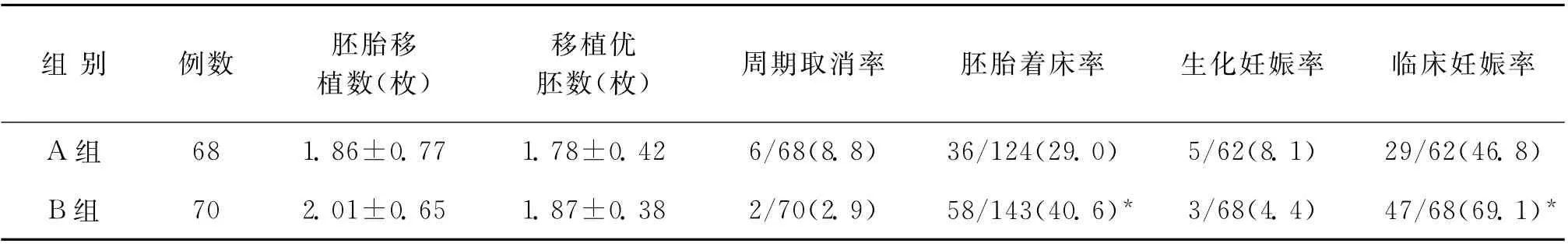
表3 兩組妊娠結局相關參數比較[(±s),n(%)]
注:與A 組比較,*P<0.05
組別 例數 胚胎移植數(枚)移植優胚數(枚)周期取消率 胚胎著床率 生化妊娠率 臨床妊娠率A 組 68 1.86±0.77 1.78±0.42 6/68(8.8) 36/124(29.0) 5/62(8.1) 29/62(46.8)B組 70 2.01±0.65 1.87±0.38 2/70(2.9) 58/143(40.6)* 3/68(4.4) 47/68(69.1)*
討 論
本次研究,我們比較了口服雌二醇和經皮雌二醇制劑在FET 人工替代周期中子宮內膜準備中的應用結局。
FET 周期中,對于月經規律的患者,常采用自然周期準備內膜,其可以使胚胎發育與內膜狀態的同步性更接近于自然受孕狀態,又可以避免外源性激素使用可能對身體的副作用,并且減輕了患者的經濟負擔。而對于月經不規律、卵巢儲備功能低下或排卵障礙的患者,臨床上常采用激素替代人工周期或促排卵周期進行FET 子宮內膜準備[2-3]。近年的研究表明,與自然周期相比,人工替代周期可以獲得相似的胚胎著床率和臨床妊娠率[6]。目前FET人工替代周期中常采用的是口服E2制劑,但是因口服藥存在肝臟首過效應,生物利用度大大降低。雌激素經肝臟代謝增加了肝臟負荷,及出現藥物性肝損害的風險;此外,雌激素在肝臟代謝的過程還會導致一些在肝臟產生合成的因子水平發生變化,以及使其他經肝臟代謝的物質代謝過程發生變化。研究表明,口服雌激素可導致一些不利的危險因素。Stevenson等[7]發現口服雌激素可以導致甘油三酯及其凝集活性的增加,故不宜用于以甘油三酯升高為主的血脂異常者。口服雌激素可顯著增加急性期蛋白質水平如C反應蛋白和血清淀粉樣蛋白A、促凝血因子如凝血酶原片段、與斑塊破裂有關的關鍵酶等[8]。口服雌激素增加靜脈血栓發生的風險,約為正常對照組的2~4倍[9],主要原因是口服雌激素可以使凝血酶合成增加、纖維蛋白溶解亢進,同時口服雌激素還可使抗凝血酶濃度降低,并產生對活化蛋白C 的抵抗,從而誘發血栓形成。且口服雌激素在肝臟及腸道中轉化為雌酮[10],雌酮與大量沉積毒素的聚集體共同刺激腺體、血液、骨骼和器官,引起細胞增生、腫大,甚至產生細胞變異、癌變等,與乳腺腫塊、卵巢囊腫、子宮肌瘤等的形成相關。本研究中口服制劑相關副作用在用藥過程中并未體現,但是由于樣本量較小,尚需進一步的大樣本研究與隨訪。
Dupont等[11]研究報道,經皮雌激素涂抹后,儲存于皮膚角質層內,緩慢滲入表皮、真皮層及血管,生物利用度高達10%。本研究結果顯示,相比于口服戊酸雌二醇組,經皮17-β雌二醇凝膠組的血清E2水平升高更為理想,且顯著減少了用藥持續時間,這與孫賢華等[12]的研究結果相似。但是與其研究結果不一致的是,本研究中17-β雌二醇組較口服戊酸雌二醇組具有較高的臨床妊娠率和胚胎著床率。這可能與經皮制劑的特殊緩釋系統有關,以及與本研究納入樣本量較少有關,其具體機制還需進一步的研究探討。經皮雌激素并不影響血漿總膽固醇、低密度脂蛋白和高密度脂蛋白水平,還可顯著降低甘油三酯水平,提高胰島素敏感性,且不改變血漿生長激素濃度,不改變肝臟對腎素-血管緊張素-醛固酮系統的作用,對于以甘油三酯增高為主的血脂異常者、糖尿病患者和高血壓患者更為安全[13]。育齡期婦女體內E2與雌酮(E1)的比例一般為2∶1,口服雌激素制劑后體內E2與E1的比例一般約為1∶5,經皮雌激素制劑進入體內后E2與E1的比例一般約為1∶1,更接近育齡期女性的比例[14]。且經皮雌激素制劑不會誘導凝血因子的生成[14],不會增加靜脈血栓栓塞(VTE)的風險[15],但缺點是可能出現皮膚過敏反應、頭暈、乳房脹痛等。本研究中經皮17-β雌二醇組出現1例皮膚過敏反應,臨床表現為輕度皮疹,伴皮膚瘙癢,暫未發現其他副作用表現。因此,對于肝腎功能障礙、血脂異常或合并血栓形成高危因素的患者,經皮雌二醇制劑更為適宜。
綜上所述,經皮17-β雌二醇制劑可以有效應用于FET 人工替代周期中,尤其適用于有肝腎功能障礙、血脂異常或合并血栓形成高危因素的患者。安全給藥是輔助生殖技術臨床用藥的永恒主題。
[1] Zeilmaker GH,Alberda AT,van Gent I,et al.Two pregnancies following transfer of intact frozen-thawed embryos[J].Fertil Steril,1984,42:293-296.
[2] Glujovsky D,Pesce R,Fiszbain G,et al.Endometrial preparation for women undergoing embryo transfer with frozen embryos or embryos derived from donor oocytes[CD/OL].Cochrane Database Syst Rev(Online),2010,20:doi:10.1002/14651858.
[3] Paulson RJ.Hormonal induction of endometrial receptivity[J].Fertil Steril,2011,96:530-535.
[4] Simon JA,Leal J,Hodgen GD.Percutaneous absorption of 17 beta-estradiol in ovariectomized rhesus monkeys:skin and serum pharmacokinetics[J].Fertil Steril,1990,53:561-565.
[5] Berning B,Kuijk CV,Kuiper JW,et al.Effects of two doses of tibolone on trabecular and cortical bone loss in early postmenopausal women:a two-year randomized,placebocontrolled study[J].Bone,1996,19:395-399.
[6] Groenewoud ER,Cantineau AE,Kollen BJ,et al.What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles?A systematic review and metaanalysis[J].Hum Reprod Update,2013,19:458-470.
[7] Stevenson JC.Type and route of estrogen administration[J].Climacteric,2009,12(Suppl 1):86-90.
[8] Menon DV,Vongpatanasin W.Effects of transdermal estrogen replacement therapy on cardiovascular risk factors[J].Treat Endocrinol,2006,5:37-51.
[9] Bagot CN,Marsh MS,Whitehead M,et al.The effect of estrone on thrombin generation may explain the different thrombotic risk between oral and transdermal hormone replacement therapy[J].J Thromb Haemost,2010,8:1736-1744.
[10] 夏賢,張紹芬,龔莉莉,等.口服和經皮雌激素替代療法對手術絕經婦女圍絕經癥狀、血脂和凝血功能的影響[J].生殖與避孕,2012,32:787-791.
[11] Dupont A,Dupont P,Cusan L,et al.Comparative endocrinological and clinical effects of percutaneous estradiol and oral conjugated estrogens as replacement therapy in menopausal women[J].Maturitas,1991,13:297-311.
[12] 孫賢華,臧麗麗,張全,等.雌激素不同用藥方式在凍融胚胎移植中的應用[J].生殖醫學雜志,2014,23:29-32.
[13] 陳蓉,吳麗萍.激素補充治療中不同雌激素的特點[J].中國計劃生育和婦產科,2012,4:13-16.
[14] Studd J.Ten reasons to be happy about hormone replacement therapy:aguide for patients[J].Menopause Int,2010,16:44-46.
[15] Canonico M,Oger E,Plu-Bureau G,et al.Hormone therapy and venous thromboembolism among postmenopausal women:impact of the route of estrogen administration and progestogens:the ESTHER study[J].Circulation,2007,115:840-845.

