薄膜包裝對鮮切芹菜抗氧化活性的影響*
郭峰,胡花麗,吳朝霞,李鵬霞
1(江蘇省農業科學院農產品加工所,江蘇南京,210014)2(沈陽農業大學食品學院,遼寧沈陽,110866)
芹菜(Apium graveolens),屬傘形科植物,是1種耐寒性柱狀葉類蔬菜,清香鮮嫩、風味獨特,具有降壓降脂等功效[1-2]。但采后芹菜的呼吸作用和生理代謝旺盛,極易失水、黃化,致使芹菜衰老加速,貨架期縮短,因此采后芹菜的貯藏保鮮技術是生產實踐中備受關注的問題[3]。
果蔬的成熟衰老與活性氧代謝及膜脂過氧化作用密切相關。果蔬中活性氧物質主要包括H2O2、·OH和 O-2·等。剛采收果蔬體內的 SOD、POD、CAT等內源抗氧化酶活性較高,能及時清除組織代謝產生的過量活性氧,維持活性氧的穩態,使其不會對果蔬造成傷害[4];然而,隨著貯藏時間的延長,果蔬體內的抗氧化能力減弱,導致組織內活性氧的積累,當活性氧的積累超過一定的閥值,即對細胞膜系統造成傷害,從而加速果蔬的衰老[5]。
薄膜包裝可通過薄膜的滲透作用與果蔬的呼吸作用在包裝袋內形成高濃度CO2和低濃度O2氣體微環境,進而影響果蔬的新陳代謝,達到延長果蔬貯藏壽命的目的[6-8]。此外,薄膜包裝具有方便、無公害等特點,已在多種果蔬保鮮中被廣泛應用[9-12]。不同種類的果蔬對薄膜包裝的貯藏適應性差異較大,需針對產品找出相適應的薄膜種類[13]。
本試驗以鮮切芹菜為材料,研究了鮮切芹菜在薄膜包裝貯藏過程中抗氧化能力及其相關酶活性的變化,旨在探討不同薄膜包裝對芹菜衰老的影響。
1 試驗材料與方法
1.1 試驗材料與預處理
本試驗芹菜材料為清晨采收的南京地產香芹,采收后1 h內運回實驗室。切去莖基部和葉柄,保留莖長度20~25 cm,挑選長度一致、成熟度相近、色澤鮮艷、無機械傷、無病害的鮮切芹菜作為試驗材料。采用P1-12.75 μm 聚乙烯袋[滲透系數:CO2,553 525.26 mL/(m2·d);O2,440 129.22 mL/(m2·d)]、P2,32.70 μm聚乙烯袋[滲透系數:CO2,31 616.57 mL/(m2·d);O2,4 329.00 mL/(m2·d)]對芹菜進行包裝處理,以12.75 μm聚乙烯袋打孔(上下各開一直徑2 cm圓孔)包裝作對照處理(CK)。每袋裝芹菜(800±50)g,置于(7±1)°C進行自發氣調貯藏,相對濕度為80%~90%。貯藏期間每5 d取樣1次,每處理取樣(500±20)g,用于各項指標的測定。
1.2 實驗方法
1.2.1 袋內CO2和O2比例的測定
用CYES-Ⅱ氧CO2氣體測定儀測定薄膜包裝袋內O2和CO2含量。
1.2.2 葉綠素含量測定
切除芹菜根部和頂部6~7 cm,保留的中間部分作為指標測定用樣品。參考李合生[14]的方法,采用乙醇浸提法測定葉綠素含量。稱取樣品5 g,體積分數95%乙醇勻漿定容15 mL,避光浸提,于649、665 nm波長處測定吸光值,計算葉綠素含量。
1.2.3 丙二醛(MDA)含量測定[14]
樣品選取方法同1.2.2。取5 g樣品,加入質量分數5%三氯乙酸15 mL,研磨勻漿,3 000 r/min下離心10 min,取上清液2 mL,加入2 mL 0.67%硫代巴比妥酸,混合后沸水浴30 min,冷卻后離心,取上清液測定在450、532、600 nm波長處的吸光值,計算MDA含量。
1.2.4 抗氧化能力的測定[15-16]
樣品選取方法同1.2.2。提取液的制備:稱取5 g樣品,加入10 mL 95%乙醇勻漿,浸提5 h,10 000 r/min離心20 min,上清液即為提取液。
1.2.4.1 DPPH清除能力的測定
反應液為2.5 mL 1.0×10-4mol/L DPPH溶液,1 mL樣品提取液,于波長517 nm處測定吸光值,計算清除能力。
1.2.4.2 羥基自由基(·OH)清除能力測定
在試管中分別加入2 mL磷酸緩沖液(pH 7.4),0.3 mL 5 mmol/L的鄰二氮菲溶液,0.2 mL 7.5 mmol/L FeSO4溶液,每加一管后立即混勻。加入0.5 mL提取液,混勻后加入1 mL 0.02%的H2O2最后補充體積至6 mL。于37°C水浴1 h,于510 nm處測定吸光值,計算清除能力。
1.2.4.3 超氧陰離子自由基(O2-·)清除能力測定
取2.5 mL 0.05 mol/L Tris-HCl緩沖溶液(pH 8.2),置于25°C水浴20 min,分別加入0.5 mL提取液和0.5 mL 25 mmol/L的鄰苯三酚溶液,混勻后于25°C水浴5 min,8 mol/L HCl溶液0.5 mL用于終止反應,于425 nm處測定吸光值,計算清除能力。
1.2.5 酶活性的測定[17]
1.2.5.1 過氧化物酶(POD)活性的測定
采用愈創木酚法,樣品選取方法同1.2.2。取5 g樣品,加入10 mL 50 mmol/L磷酸緩沖液(pH 7.0,內含1%PVP),冰浴下研磨,4°C下10 000 r/min下離心20 min,上清液即為POD粗提液。取1 mL粗酶提取液,加入2 mL 0.05 mol/L愈創木酚(用0.2 mol/L pH 6.4的磷酸緩沖液配成)中,在30°C水浴中平衡5 min,然后加入1 mL 0.2%H2O2(用0.2 mol/L pH 6.4的磷酸緩沖液配成)混勻,以每分鐘OD470變化0.01為表示1個過氧化物酶活性單位計算POD活性。
1.2.5.2 過氧化氫酶(CAT)活性的測定
樣品選取方法同1.2.2。取5 g樣品,加入10 mL 50 mmol/L磷酸緩沖液(pH 7.0,內含1%PVP),冰浴下研磨,4°C下10 000 r/min下離心20 min,上清液即為CAT粗提液。取1 mL粗酶液,加入2 mL 0.05 mol/L磷酸緩沖液(pH 7.8),在25°C水浴下預熱5 min,加入1 mL 0.2%H2O2,以每分鐘 OD240減少0.1個單位為一個酶活性單位計算CAT活性。
1.2.5.3 超氧化物歧化酶(SOD)活性的測定
采用氮藍四唑(NBT)法,樣品選取方法同1.2.2。取5 g樣品,加入15 mL 50 mmol/L磷酸緩沖液(pH 7.8,內含1%PVP)冰浴下研磨,于4°C下10 000 r/min離心20 min,上清液即為SOD粗提液。取1 mL上清液,加入1.5 mL 50 mmol/L磷酸緩沖液、0.3 mL 130 mmol/L Met溶液、0.3 mL 750 μmol/L NBT 溶液、0.3 mL 100 μmol/L EDTA-Na2液、0.3 mL 20 μmol/L核黃素,置于4 000 lux日光燈下反應20 min,于560 nm波長下測定吸光度,計算SOD活性。
1.3 數據處理
數據采用Origin 8.5進行作圖,顯著性采用SPSS 20.0軟件ANOVA進行鄧肯式多重差異分析(P<0.05)。
2 結果與分析
2.1 薄膜包裝袋內CO2和O2的比例
由表1可知,P2包裝袋內CO2濃度高于P1,O2濃度低于P1,分別維持在1.10% ~1.97%和12.53%~17.63%之間,這與P2薄膜包裝更低的氣體滲透性[CO2滲透系數:31 616.57 mL/(m2·d);O2滲透系數:4 329 mL/(m2·d)]有直接聯系。可見,P2薄膜包裝極大地限制了包裝袋內氣體與空氣間的滲透。
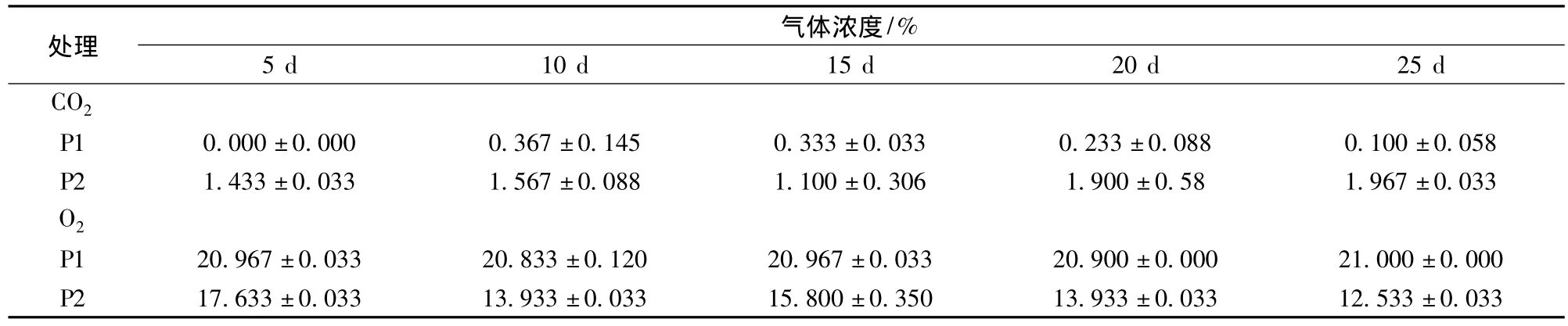
表1 薄膜包裝袋內CO2和O2的比例Table 1 CO2and O2content in bags during film packaging storage
2.2 不同薄膜包裝對鮮切芹菜葉綠素含量的影響
芹菜采后呼吸旺盛,極易黃化[1],由此影響保鮮和銷售。表2表明,在貯藏過程中,芹菜葉綠素含量整體呈下降趨勢。在貯藏第5、10、25天時,P2處理的芹菜葉綠素a、b和總葉綠素含量均顯著高于P1和CK(P<0.05),總葉綠素含量分別為 CK的1.19、1.26、2.34倍,表明P2薄膜包裝可有效延緩芹菜葉綠素分解,顯著提高芹菜貯藏品質及壽命。
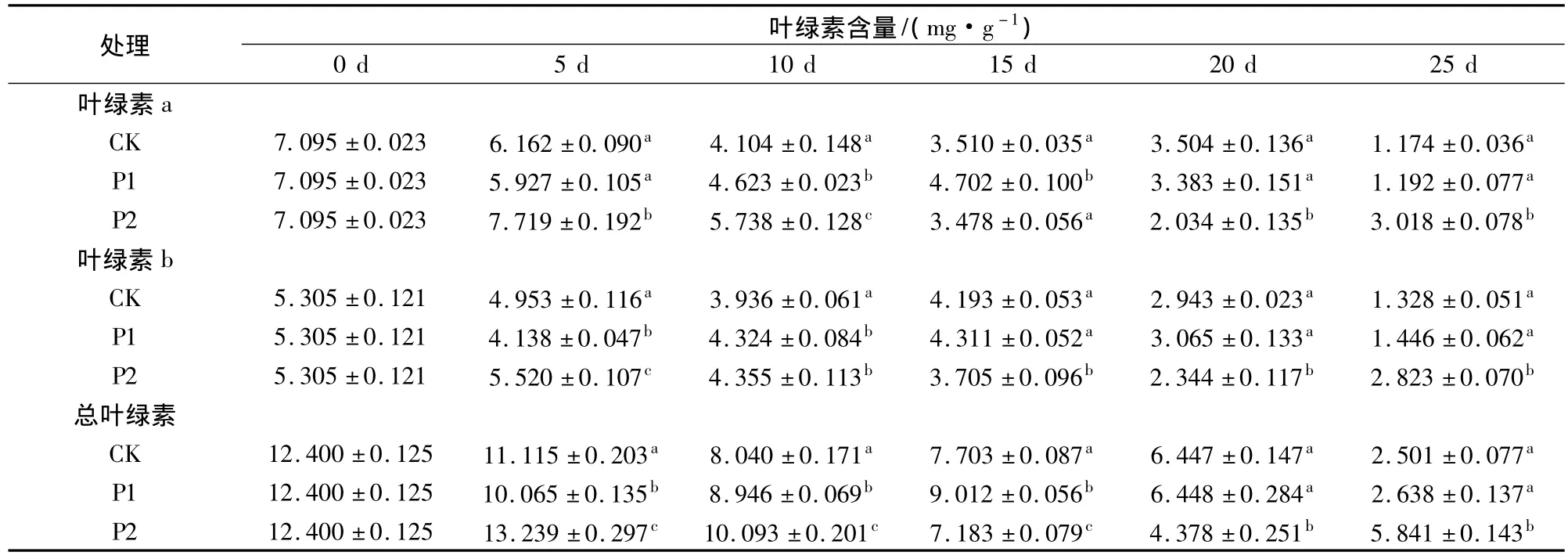
表2 鮮切芹菜在薄膜包裝貯藏過程中葉綠素含量的變化Table 2 chlorophyll content of fresh-cut celery during film packaging storage
2.3 不同薄膜包裝對鮮切芹菜丙二醛(MDA)含量的影響
MDA含量是反映膜脂過氧化程度的一個重要指標。由圖1可看出,在鮮切芹菜貯藏過程中,MDA含量整體呈上升趨勢,其中P1和P2處理芹菜的MDA含量均低于CK。在整個貯藏過程中,P2處理芹菜的MDA含量顯著低于P1和CK(P<0.05),且在第10天達到最小值,為0.34 μmol/g。可見,在鮮切芹菜貯藏過程中,薄膜包裝可有效抑制丙二醛含量的增加,其中P2薄膜包裝處理的效果更好。
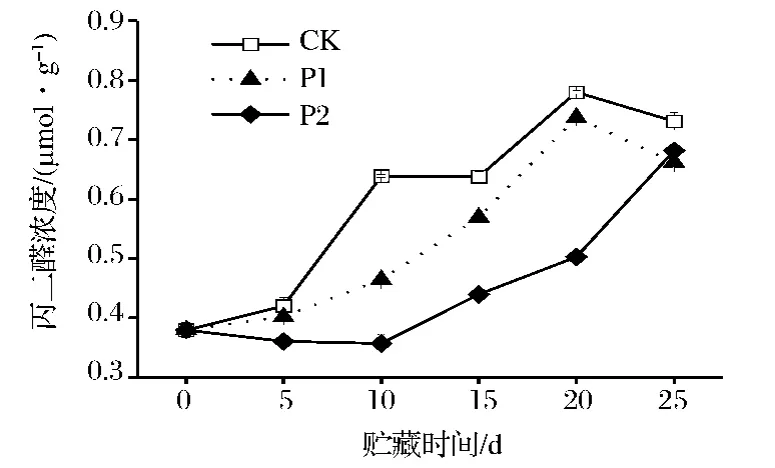
圖1 鮮切芹菜在薄膜包裝貯藏過程中丙二醛(MDA)含量的變化Fig.1 MDA content of fresh-cut celery during film packaging storage
2.4 不同薄膜包裝對鮮切芹菜自由基清除能力的影響
圖2-A表明,在鮮切芹菜在貯藏過程中,DPPH清除能力先上升后下降。CK、P1、P2處理芹菜的DPPH清除能力均在貯藏第20天時達到峰值。在貯藏第5、10、15、20、25 天時,P2 處理芹菜的 DPPH 清除能力分別是 CK 的 1.19、1.27、1.21、1.20、1.46 倍,且該處理芹菜對DPPH清除能力顯著高于CK(P<0.05)。然而,整個貯藏過程中,P1處理與CK相比無顯著性差異。
由圖2-B可知,整個貯藏過程中,P1、P2處理芹菜的羥基自由基清除能力均高于CK;在貯藏第5、10、15、25天時,P1處理芹菜的·OH清除能力與P2無顯著性差異,而在第20天時,P2處理芹菜的·OH清除能力比P1處理高9.51%。可見,P2薄膜包裝處理芹菜可維持較高的·OH清除能力。
由圖2-C可知,貯藏期間,鮮切芹菜超氧陰離子自由基清除能力上升后迅速下降。CK芹菜中O2-·清除率峰值出現在第10天,為11.57%;P1、P2處理O2-·清除率的峰值則均出現在第15天,分別為15.62%、18.65%。總體來看,貯藏10 d后,P1、P2處理芹菜中的O2-·清除能力顯著高于CK(P<0.05)。
2.5 不同薄膜包裝對鮮切芹菜內源抗氧化酶活性的影響

圖2 鮮切芹菜在薄膜包裝貯藏過程中自由基清除能力的變化Fig.2 Radical scavenging activity of fresh-cut celery during film packaging storage
2.5.1 不同薄膜包裝對鮮切芹菜超氧化物歧化酶(SOD)活性的影響
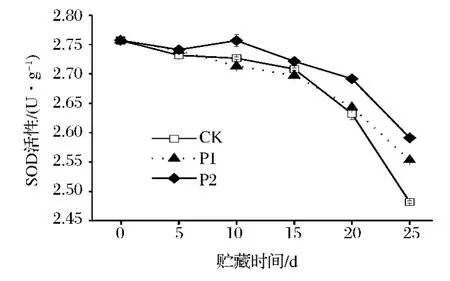
圖3 鮮切芹菜在薄膜包裝貯藏過程中SOD活性的變化Fig.3 SOD activity of fresh-cut celery during film packaging storage
由圖3可看出,鮮切芹菜在貯藏期間,其SOD活性整體呈現下降趨勢,且在貯藏15 d后SOD活性下降速率明顯加快。除第5天外的整個貯藏過程中,P2處理芹菜的SOD活性顯著高于CK(P<0.05)。整個貯藏過程P1處理芹菜的SOD活性與CK無顯著性差異。可知,P2薄膜包裝可有效延緩鮮切芹菜SOD活性的降低。
2.5.2 不同薄膜包裝對鮮切芹菜過氧化物酶(POD)活性的影響
圖4表明,鮮切芹菜在貯藏期間,POD活性在前期緩慢上升,之后呈波動上升的趨勢。在貯藏0~10 d時,P1、P2處理芹菜的POD活性均高于CK;貯藏10 d之后,CK、P1處理芹菜的POD活性開始波動上升,且CK高于P1(P<0.05)。P2處理芹菜的POD活性在貯藏15 d后出現波動。可知,P2處理薄膜包裝可有效延緩鮮切芹菜過氧化物酶(POD)活性峰值的出現。

圖4 鮮切芹菜在薄膜包裝貯藏過程中POD的變化Fig.4 POD activity of fresh-cut celery during film packaging storage
2.5.3 不同薄膜包裝對鮮切芹菜過氧化氫酶(CAT)活性的影響

圖5 鮮切芹菜在薄膜包裝貯藏過程中CAT的變化Fig.5 CAT activity of fresh-cut celery during film packaging storage
由圖5可看出,鮮切芹菜在整個貯藏過程中,其CAT活性先上升后下降。CK、P2處理的CAT活性均在第15天出現極大值,分別為1.771 U/g和1.959 U/g;在第15、20天時,P1處理的CAT活性低于CK處理。整個貯藏過程中,P2處理的CAT活性顯著高于CK(P<0.05)。可知,P2處理可有效維持鮮切芹菜較高的CAT活性。
3 討論與結論
生物細胞膜脂過氧化的一個主要機制是活性氧自由基誘發膜脂不飽和脂肪酸發生連鎖的過氧化反應,使脂肪酸發生降解,產生脂質過氧化物[18]。SOD能催化O2-·的歧化反應[19],保護膜結構,延緩組織衰老。SOD活性下降與MDA含量增加,意味著組織清除活性氧能力的下降和膜脂過氧化作用的加強。本研究表明,CK處理鮮切芹菜貯藏10 d后SOD活性下降速率加快,O2-·清除率下降,MDA含量迅速升高;SOD活性與MDA含量顯著呈負相關(r=-0.793),這與阮亞楠[20]的研究結果一致。與對照相比,薄膜包裝顯著降低了鮮切芹菜MDA的積累,延緩了SOD活性和O2-·清除能力的下降,說明薄膜包裝對抑制膜脂過氧化損傷具有一定的作用,這可能與其維持包裝袋微環境中的低濃度O2(12.53%~17.63%)和高濃度CO2(1.10%~1.97%)有關,這一結果同樣被胡花麗在草莓[21]中證實。
CAT催化分解組織中高濃度的 H2O2,從而使H2O2控制在較低水平。POD催化組織中低濃度的H2O2發生氧化,用以清除過氧化物和H2O2。POD伴隨果蔬的成熟衰老而不斷發生變化,其所表現的保護作用或傷害效應因植物種類和品種不同而異[22]。有學者認為可能植物體中存在2種POD作用機制,一種機制是它在遇逆境或衰老初期即表達,表現為保護效應,能增加果實的耐藏性;另一種則是在逆境后期或衰老后期被啟動,表現為傷害效應,因此降低果實的耐藏性[23]。本研究結果表明,芹菜CAT活性先上升后下降,這與 Bartoli[24]和閆瑞香[25]等的研究結果一致。POD活性在貯藏前期緩慢上升,此時POD表現為保護效應,隨后出現的峰值標志衰老加速的開始[26-27],POD 活性出現波動和上升,這與聶華堂[28]等的研究結果一致。與對照相比,P2薄膜包裝顯著提高了CAT活性,延緩POD活性峰值的出現并在貯藏后期抑制POD活性波動上升,表明P2薄膜包裝可有效保持鮮切芹菜活性氧自由基代謝的平衡,延緩其衰老進程。
自由基清除能力是判定果蔬抗氧化活性的重要指標,抗氧化物質(酚類、黃酮類、Vc)和抗氧化酶(SOD、CAT、POD)系統共同維持植物體內的自由基平衡。研究結果表明,與對照相比,P2薄膜包裝維持鮮切芹菜較高的DPPH、·O2-、·OH的清除能力,說明P2薄膜包裝可有效保持鮮切芹菜較高的抗氧化活性,減少自由基對組織的損傷,這也與MDA含量變化的結果一致。
綜上所述,鮮切芹菜在貯藏過程中,SOD活性下降,CAT活性先上升后下降,POD活性在貯藏前期緩慢上升,后期出現峰值和波動,表明芹菜衰老加速。結果表明,與對照相比,薄膜包裝可提高鮮切芹菜DPPH、O2-·、·OH的清除能力及 CAT、POD的活性。此外,P2薄膜包裝更有效延緩了MDA的積累和SOD活性下降,并延遲了POD活性峰值的出現;另外,P2薄膜包裝還有效減緩了組織中葉綠素的降解,這與其低滲透性所形成的高比例CO2和低比例O2密切相關。因此,薄膜包裝可有效延緩鮮切芹菜的衰老進程,其中P2薄膜包裝效果更佳。
[1] 朱軍偉,謝晶,章佳君,等.薄膜包裝芹菜品質分析及貨架壽命研究[J].食品科學,2013,34(4):272-276.
[2] 張立奎,陸兆新,郁志芳.臭氧水處理鮮切生菜貯藏期間的品質變化[J].食品與發酵工業,2004,30(3):128-131.
[3] 侯建設,李中華,江杰,等.芹菜的薄膜包裝冷藏研究[J].食品科學,2002,23(6):143-145.
[4] 班兆軍,馮建華,徐新明,等.果蔬衰老機理研究簡述[J].中國果菜,2011(1):55-56.
[5] 王麗嬌,牟其云,李文香,等.微真空條件對西蘭花葉綠素降解與內源抗氧化性的影響[J].食品科學,2013,34(20):312-317.
[6] ?zogul F,Polat A,?zogul Y.The effects of modified atmosphere packaging and vacuum packaging on chemical,sensory and microbiological changes of sardines[J].Food Chemistry,2004,85(1):49-57.
[7] Guynot M E,Marín S,Sanchis V,et al.An attempt to minimize potassium sorbate concentration in sponge cakes by modified atmosphere packaging combination to prevent fungal spoilage[J].Food Microbiology,2004,21(4):449-457.
[8] 王寶剛,侯玉茹,李文生,等.自動自發氣調箱貯藏對甜櫻桃品質及抗氧化酶的影響[J].農業機械學報,2013,44(1):137-141.
[9] Jafri M,Jha A,Bunkar D S,et al.Quality retention of oyster mushrooms by a combination of chemical treatments and modified atmosphere packaging[J].Postharvest Biology and Technology,2013,76:112-118.
[10] Sothornvit R,Kiatchanapaibul P.Quality and shelf-life of washed fresh-cut asparagus in modified atmosphere packaging[J].LWT-Food Science and Technology,2009,42(9):1484-1490.
[11] 古榮鑫,胡花麗,曹宏,等.不同薄膜包裝對冷藏空心菜采后品質的影響[J].食品與發酵工業,2014,40(3):237-243.
[12] 王亞楠,胡花麗,古榮鑫,等.不同薄膜包裝對桑葚采后品質的影響[J].食品科學,2014,0-0.
[13] 李寧,閻瑞香,王步江.不同包裝方式對白靈菇低溫保鮮效果的影響[J].農業工程學報,2011,27(7):377-382.
[14] 李合生.植物生理生化實驗原理和技術[M].高等教育出版社,2000.
[15] DU G,LI M,MA F,et al.Antioxidant capacity and the relationship with polyphenol and Vitamin C in fruits[J].Food Chemistry,2009,113(2):557-562.
[16] Alothman M,Bhat R,Karim A.Antioxidant capacity and phenolic content of selected tropical fruits from Malaysia,extracted with different solvents[J].Food Chemistry,2009,115(3):785-788.
[17] 孫群,胡景江.植物生理學研究技術[M].楊凌:西北農林科技大學出版社,2006.
[18] Bowler C,Montagu M V,INZE D.Superoxide dismutase and stress tolerance[J].Annual review of plant biology,1992,43(1):83-116.
[19] 曹慧,王孝威.水分脅迫下新紅星蘋果超氧化自由基累積和膜脂過氧化作用[J].果樹學報,2001,18(4):196-199.
[20] 阮亞男,何興元,陳瑋,等.CO2濃度倍增對城市銀杏葉片膜脂過氧化與抗氧化酶活性的影響[J].生態學報,2007,27(3):1 106-1 121.
[21] 胡花麗,李鵬霞,王毓寧,等.不同氣體成分處理對豐香草莓采后品質,SOD及 CAT活性的影響[J].江西農業學報,2010,22(12):26-29.
[22] 魏云瀟,葉興乾.果蔬采后成熟衰老酶與保護酶類系統的研究進展[J].食品工業科技,2009(12):427-431.
[23] 寇曉虹,王文生,吳彩娥.果實成熟衰老與保護酶系統的關系[J].中國果菜,2002(6):24-25.
[24] Bartoli C G,Simontacchi M,Guiamet J J,et al.Antioxidant enzymes and lipid peroxidation during aging of RAM petals[J].Plant Science,1995,104(2):161-168.
[25] 閆瑞香,王仁才,關文強.亞精胺對獼猴桃采后抗氧化酶活性的影響[J].園藝學報,2002,29(2):173-175.
[26] 頡敏華,張繼澍,頡建明.苦瓜采后某些生理生化變化與其衰敗的關系[J].西北植物學報,2004,24(4):716-719.
[27] Gorin N.Differences inl-malate determined enzymatically ortitrimetrically in golden delicious apples[J].Zeitschrift für Lebensmittel-Untersuchung und Forschung,1976,162(3):259-261.
[28] 聶華堂,鐘廣炎,陳竹生,等.錦橙,鳳梨甜橙貯藏期間果皮過氧化物酶活性的變化[J].中國南方果樹,1990,19(3):24-25.

