L-苯丙氨酸解氨酶產生菌的原生質體誘變育種
李麗,熊思馳,黃飛,王國盼,韋春葵,蘇宏飛,梁智群,黃時海,*
(1.廣西大學生命科學與技術學院,廣西南寧530005;2.南寧高新區人才交流中心,廣西南寧530007)
L-苯丙氨酸解氨酶產生菌的原生質體誘變育種
李麗1,熊思馳1,黃飛2,王國盼1,韋春葵1,蘇宏飛1,梁智群1,黃時海1,*
(1.廣西大學生命科學與技術學院,廣西南寧530005;2.南寧高新區人才交流中心,廣西南寧530007)
原始菌株海洋紅酵母M1202產生的L-苯丙氨酸解氨酶(PAL),能夠逆反應催化反式肉桂酸(t-Ca)生成L-苯丙氨酸。對M 1202進行原生質體紫外誘變獲得一株轉化率為原始菌株115%的菌株TM2,經6次傳代,仍具有較好的遺傳穩定性。
海洋紅酵母;L-苯丙氨酸解氨酶;原生質體誘變
L-苯丙氨酸(L-phenylalanine)是具有特殊生物活性的芳香族氨基酸,為人和動物不能合成的8種必須氨基酸之一,被廣泛地應用于現代新型藥物中[1]。它與L-天冬氨酸縮合,可以生產新型保健甜味劑阿斯巴甜(Aspartame,APM)[2]。而目前阿斯巴甜被認為是一種非常安全的二肽甜味劑[3],適合在肥胖及糖尿病人中使用[4]。自20世紀80年代以來,隨著氨基酸類抗癌藥物及營養保健品的開發應用,國際市場對L-苯丙氨酸的需求快速增長[5]。其制備方法,歸納起來共有4種:蛋白水解法,化學合成法,酶轉化法及微生物發酵法[6-7]。其中酶轉化法工藝簡單,產物濃度較高,純化步驟簡便且生產能力較強,為目前工業化生產L-苯丙氨酸的主要方法之一。而酶法制備中研究較多的是利用紅酵母中的L-苯丙氨酸解氨酶(PAL)逆反應催化反式肉桂酸(t-Ca)生成L-苯丙氨酸。
本試驗采用海洋紅酵母的L-苯丙氨酸解氨酶(PAL)生產L-苯丙氨酸。為了獲得高產菌株,對原始菌株海洋紅酵母M1202進行紫外誘變。考慮到原生質體對紫外線較敏感,先將M1202制備成原生質體,紫外誘變后進行原生質體再生培養,利用類似物選擇培養基對再生菌株進行篩選,以期獲得抗反饋調節高水平PAL酶源的突變株。
1 材料與方法
1.1 材料
1.1.1 菌株
紅酵母菌M1202由實驗室自主篩選保藏。
1.1.2 主要培養基
固體培養基(g/L):10°Bx麥芽汁,瓊脂20.0,pH 5.5。
種子培養基:10°Bx麥芽汁,pH 5.5。
再生高滲培養基(g/L):10°Bx麥芽汁,0.8mol/L的甘露醇,瓊脂20.0,pH 5.5。
菌株產酶培養基(g/L):10°Bx麥芽汁,酵母膏1.5,L-Phe 1.0,K2HPO41.0,pH5.5。
選擇培養基(g/L):L-Tyr 0.5,(NH4)2SO420.0,K2HPO41.0,MgSO4·7H2O 0.2,FeSO4·7H2O 0.06,CaCl20.02,LiCl0.5,瓊脂20.0,pH 5.5。
類似物篩選培養基(g/L):在上述選擇培養基中,按表1添加結構類似物DL-Phe和M-OH-Ca(間羥基反式肉桂酸)。
1.1.3 主要試劑
預處理液:1%EDTA,0.1%巰基乙醇,用50mmol/L Tris-HCl配制。
原生質體滲透壓穩定劑:0.5mol/L蔗糖,10mmol/LMgCl2,50mmol/LTris-HCl,pH7.0。
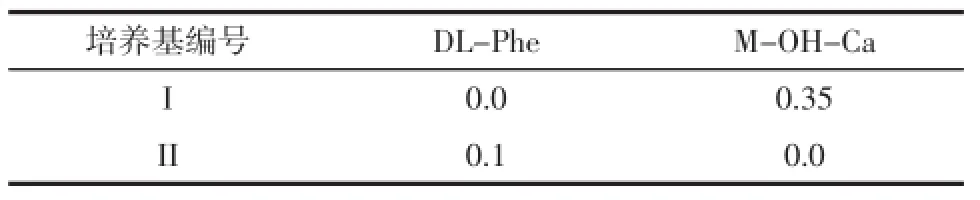
表1結構類似物添加配比Table1 The ratio of DL-phe and M-OH-Ca
紅酵母去壁酶液:含質量分數1%蝸牛酶的原生質體滲透壓穩定劑,微孔濾膜過濾除菌。
轉化液:15g/L反式肉桂酸(t-Ca),Triton-1000.1%(體積分數),氨水濃度6.87 mol/L,碳酸氫銨濃度0.93mol/L,調pH至10.5。
生理鹽水:稱取9 g NaCl溶解于一定的蒸餾水后定容至1 L,滅菌備用。
1.2 方法
1.2.1 細胞懸液的制備
用接種環在斜面培養基上刮取一環菌體,接種于種子培養基,于30℃、160 r/min條件下搖床振蕩培養20 h~24 h,至對數生長期。取發酵液10mL,4 000 r/min離心10min,滲透壓穩定劑洗滌2次,將菌體懸浮于10mL穩定劑中制備成細胞懸液。取0.5mL,用無菌生理鹽水適當稀釋后用平板菌落計數法測細胞懸液濃度。
1.2.2 原生質體的制備與再生[8-9]
取5m L細胞懸液,4 000 r/min離心10min,棄上清液,加入預處理液,靜置15min,用滲透壓穩定劑洗滌2次,離心10min棄上清液,然后加入5mL酶液,30℃震蕩保溫,顯微鏡記錄原生質體數量。吸取0.5m L酶處理液,加入4.5mL原生質體滲透壓穩定劑,成原生質體懸液后經適當稀釋,再用再生高滲培養基培養計數。另取0.5m L酶處理液至4.5m L無菌水中,震蕩搖勻,適當稀釋后,用固體培養基培養計數。計算原生質體制備率和再生率:原生質體制備率(%)=(酶解前菌落數-固體培養基上菌落數)/酶解前菌落數× 100%;原生質體再生率(%)=(再生高滲固體培養基上菌落數-固體培養基上菌落數)/(酶解前菌落數-固體培養基上菌落數)×100%。
1.2.3 原生質體紫外誘變[10]
將制備好的原生質體用滲透壓穩定劑稀釋至5× 103個/mL,取5mL移入直徑9 cm的培養皿,并置于已預熱30min的15w紫外燈下,距離20 cm。磁力攪拌下,分別照射20、40、60、80、100、120、140、160、180 s。取0.2mL照射后的菌液涂布于再生培養基上,30℃下倒置避光培養一周。整個過程需在黑暗或紅光中進行,防止光復活。觀察菌落形態,統計平板中的菌落數量,計算致死率,以未經誘變處理的菌懸液涂布平板作對照。
1.2.4 初篩
挑取直徑大、長勢稠厚的再生單菌落接種到類似物篩選培養基I、II上,30℃培養72 h。將類似物篩選培養基上菌落直徑大、長勢稠厚的單菌落接種于5mL種子培養基,30℃、160 r/min搖瓶培養20 h,再以4%的接種量接種至5mL產酶培養基,30℃、180 r/min培養30 h。離心得菌體,加入2m L轉化液,于30℃、50 r/min條件下轉化反應12 h。離心取上清,紫外-分光光度法檢測轉化率[11]。選取轉化率較高的突變菌株斜面保藏,用于下一步復篩。
1.2.5 復篩
方法與初篩方法基本一致,采用高相液相色譜法檢測L-Phe含量。
1.2.6 反式肉桂酸轉化特性的研究
轉化率的測定:取5mL發酵液,離心棄上清,加入2mL轉化液,于30℃,50 r/min反應12 h。沸水浴10min鈍化,5 000 r/min離心10min,取上清液0.1mL,稀釋2 500倍,測定溶液OD271。
產酸量的測定:高相液相色譜法(HPLC),C18柱(4.6mmid×250mm),流動相為甲醇-水(體積比為30∶70),流速0.65mL/min,UV檢測波長210 nm。
1.2.7 菌株連續轉化穩定性研究
取培養至產酶階段的125 g濕細胞,用生理鹽水洗滌,加入250m L轉化液,在不添加任何穩定劑的條件下進行生物轉化12 h,測定轉化率和L-Phe含量。通過計算t-Ca的轉化量,向反應液中添加t-Ca使其回復到反應初始時的t-Ca濃度,并用濃氨水和碳酸氫銨調節維持反應液的pH為10.0。再次轉化12 h,并多次重復上述過程,研究菌株多批次連續轉化的穩定性。
2 結果與分析
2.1 原生質體制備率及再生率測定
原生質體的制備率為73.5%,再生率為13.0%。
2.2 原生質體紫外誘變
將經過紫外照射處理不同時間的菌懸液涂布于再生平板上,采用平板計數法計算菌落數,其致死率曲線如圖1所示。
從圖1可知,致死率隨紫外照射時間的延長而增加,140 s時達到99%,之后基本穩定。當紫外照射時間為120 s,致死率為90%,菌體正誘變率最大。因此確定紫外誘變的最佳時間為120 s。
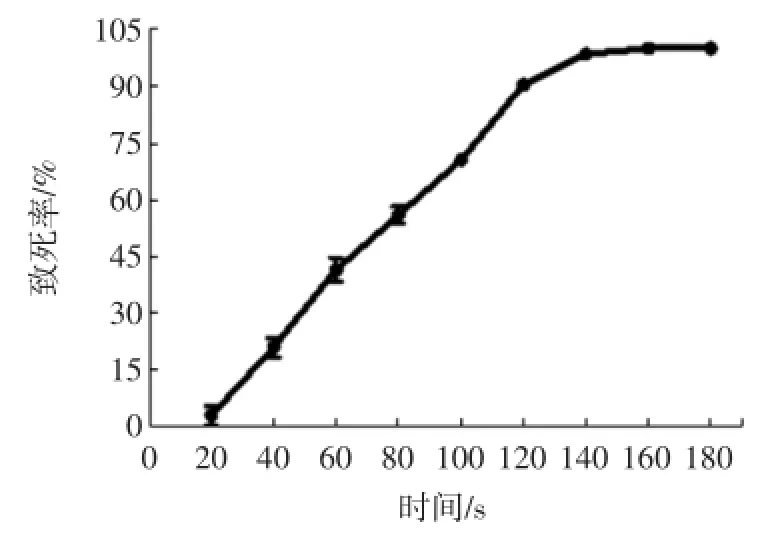
圖1 紫外誘變致死率曲線Fig.1 Lethality curve of strain induced by UV
2.3 L-Phe標準曲線與t-Ca標準曲線的繪制
L-Phe標準曲線與t-Ca標準曲線的見圖2與圖3。
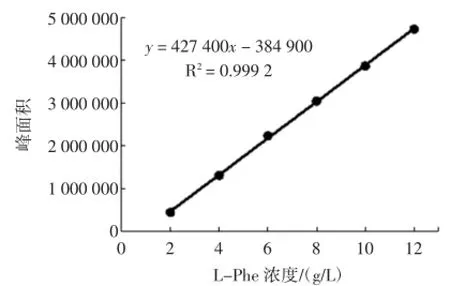
圖2 L-苯丙氨酸標準曲線的繪制Fig.2 The plotting of standard curve of L-phe
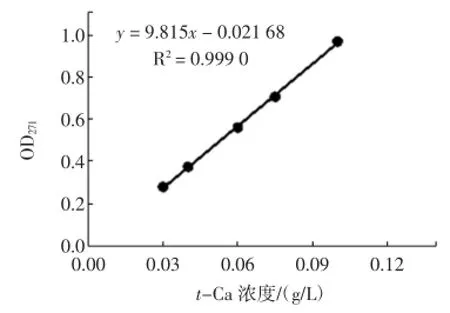
圖3反式肉桂酸標準曲線的繪制Fig.3 The plotting of standard curve of t-Ca
由圖2和圖3可知L-Phe和t-Ca分別在2 g/L~12 g/L、0.03 g/L~0.10 g/L范圍內線性關系良好。
2.4 初篩
經過紫外結合誘導類似物誘變篩選獲得了106個突變株,挑取其中的65株進行初篩,結果見表2。

表2初篩結果Table2 The results of preliminary screening
經過初篩得到了5株優于出發菌株的突變株,其生物轉化能力比較見表3。
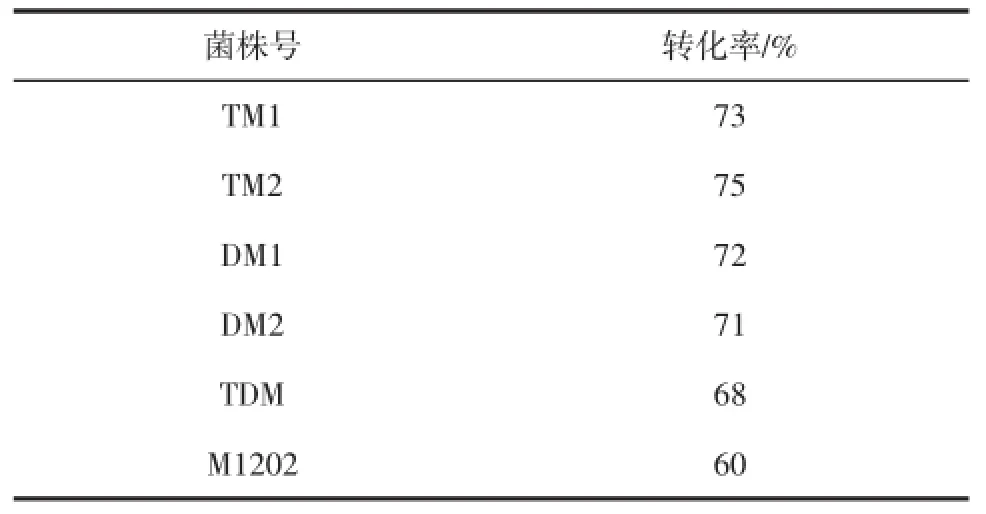
表3 誘變株和出發菌株(M 1202)PAL生物轉化能力比較Table3 The PAL bioconversion capacity comparison between the original strain(M 1202)and the mutant strains by UV mutagenesis
從表3中可知,突變株DM1,DM2,TM1,TM2,TDM的轉化率均大于68%,較出發菌株M1202高。
2.5 復篩
對初篩得到的五株轉化率較高的菌株進行復篩,利用HPLC測定苯丙氨酸含量,結果見表4。

表4 復篩結果Table4 The results of rescreening
從表4可知,TM2的產酸量最高,達9.67 g/L。2.6 轉化產物的鑒定
HPLC分析L-Phe與t-Ca的標準混合液及轉化液,結果顯示,混標樣和轉化液中的L-Phe與t-Ca分離效果較好,t-Ca保留時間約為6.78min,L-Phe保留時間約為11.34min,峰型對稱且無明顯干擾峰,說明酵母細胞通過催化轉化反應體系中的t-Ca和NH3合成了L-Phe。
2.7 遺傳穩定性實驗
TM2經過6次連續傳代,產酸量基本保持穩定,具有較好的遺傳穩定性,結果如圖4。
2.8 菌株連續轉化穩定性的研究
結果如圖5和圖6所示。
經過120 h的10次連續轉化,L-Phe積累量達63.80 g/L。第九次取樣測定時(108 h),轉化率降至約40%。與出發菌株M1202比較(半衰期約為70 h),TM2半衰期有了一定程度的提高。此外,這種連續補料與分批轉化相比,省略了多次離心的步驟,十分有利于工業化生產。
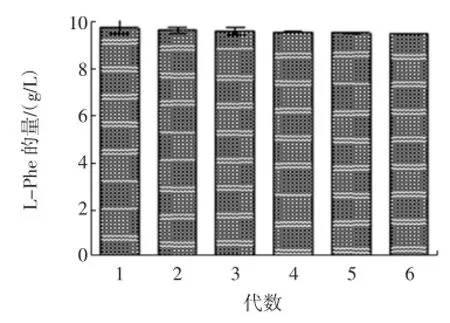
圖4 菌株TM2的遺傳穩定性實驗Fig.4 The genetic stability experiment of strain TM2
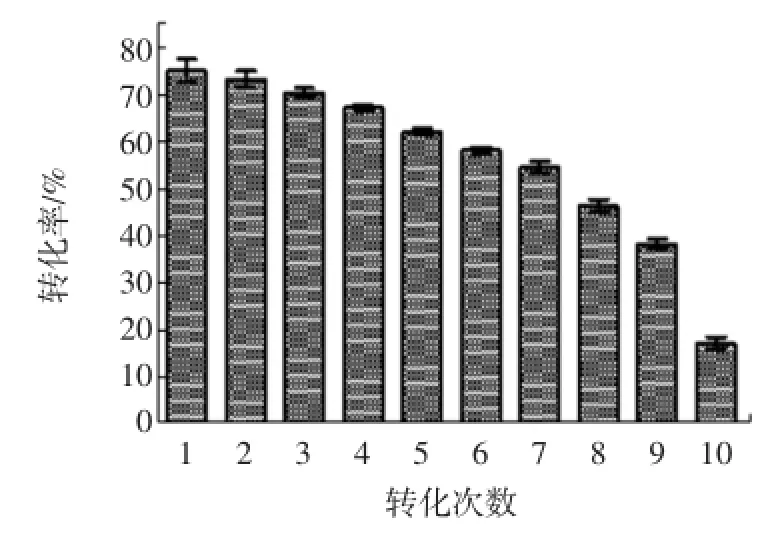
圖5 轉化10次對轉化率的影響Fig.5 The effect of conversion rateby transform ing ten times
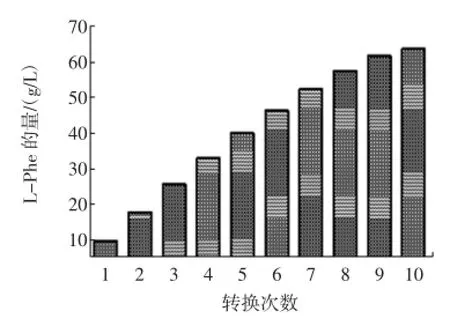
圖6 轉化10次的苯丙氨酸積累量Fig.6 The accumulation of L-Phe by transforming ten times
3 結論與討論
1)紫外線產生的高能射線,直接作用于菌株DNA,引起堿基互補配對出錯,從而導致菌體突變。此外,紫外誘變還具有正突變率較高、不易產生回復突變的特點[12],故常被用于微生物誘變育種。本實驗將菌體制備成原生質體后再進行紫外誘變,去壁后的紅酵母由于失去了細胞壁的保護,對紫外線更加敏感,從而提高了突變率。顧蕾[10]等對一株產類胡蘿卜素紅酵母ns-1進行原生質體紫外誘變,獲得類胡蘿卜素產量明顯提高的突變菌株UVss,其生物量、色素產量分別比原始菌株提高了67.6%、54.1%。我們的實驗結果也表明,原生質體紫外誘變與常規方法相比,在提高海洋紅酵母PAL酶活、轉化率等方面效果較好。比如,本實驗誘變的TM2菌株的穩定性明顯高于目前報道的其它微生物[13]。
2)本試驗在篩選培養基中添加了結構類似物DL-苯丙氨酸(DL-Phe)和間羥基反式肉桂酸(M-OHCa),建立了高通量的篩選方法。DL-Phe為PAL非天然底物,具有較高的Km值,作為唯一碳源時能誘導出高水平的PAL[14-15];M-OH-Ca是PAL反應產物的結構類似物,添加時迫使PAL酶源菌株產生反饋調節,從而阻遏PAL的生成和影響菌體的生長、代謝。因此,添加M-OH-Ca能輔助篩選出高抗反饋調節的PAL酶源菌株。本實驗結果表明,該高通量方法簡單、高效、省時和低成本,并可用于再生原生質體的篩選。
3)采用改良的轉化方式,分批連續補料進行轉化,省略了多次離心步驟。連續10次補料,250mL轉化液共加入25 g t-Ca,相當于底物濃度為100 g/L。經120 h轉化,L-Phe積累量達63.80 g/L,即轉化率達63.80%,這為下一步優化反應條件,擴大實驗規模,奠定了堅實的基礎。
[1]李冀新,張超.L-苯丙氨酸生產及應用研究進展[J].氨基酸和生物資源,2006,28(2):51-56
[2]鄧菊香,王祖元.苯丙氨酸的生產現狀與發展前景[J].安徽化工, 2007,33(4):1-3
[3] 馬德金,張凱,唐根生.阿斯巴甜工藝制作工程分析 [J].理論研究, 2010,9(4):22-23
[4] Portmann MO,Kilcast D.Psychophysical characterization of new sweeteners of commercial importance for the EC food industry[J]. Food Chem,1996,56(3):291-302
[5]王敏.L-苯丙氨酸開發前景誘人[J].化工生產與技術,2003,10(1): 23
[6]SprengerG.From scratch to value:engineering Escherichia coli wild type cells to theproduction of L-phenylalanine and other fine chemicals derived from chorismate[J].Appl Microbiol Biotechnol,2007, 75(4):739-749
[7]Chem SJ.L-苯丙氨酸的現狀與發展前景[J].精細與專用化學品, 2002(10):13-14
[8]詹萍,蘇龍,周乃東.紅酵母原生質體制備和再生條件研究[J].安徽農業科學,2010,38(3):1154-1155
[9]劉鳳珠,牛小明.耐高滲酵母原生質體誘變育種的研究[J].食品工程,2010(2):37-39
[10]顧蕾,陸玲,袁生.紅酵母原生質體制備及其紫外誘變育種的研究[J].食品工業科技,2004,25(4):60-62
[11]楊順楷,李果龍,趙健生.酵母全細胞苯丙氨酸解氨酶(PAL)活性的紫外分光測定法[J].天然產物研究與開發,1990(1):59-62
[12]Rowlands RT.Rational screens and genetic recombination techniques[J].Enzyme Microb Technol,1984,6(7):290-300
[13]Macdonald MJ,D’Cunha GB.A modern view of phenylalanine ammonia lyase[J].Biochem Cell Biol,2007,85(3):273-282
[14]楊敏,楊順楷.化學誘變結合結構類似物法選育高苯丙氨酸解氨酶菌種[J].應用與環境生物學報,1999,5(5):525-528
[15]李楠,熊彬,張云開,等.產L-苯丙氨酸解氨酶菌種篩選[J].廣西農業生物科學,2005,24(4):335-338
Mutation Breeding of Protoplast of L-phenylalanine Ammonia-lyase Producing Strains
LI Li1,XIONG Si-chi1,HUANG Fei2,WANG Guo-pan1,WEI Chun-kui1,SU Hong-fei1,LIANG Zhi-qun1,HUANG Shi-hai1,*
(1.Life Science and Technology College,Guangxi University,Nanning 530005,Guangxi,China;2.the Communication Centre for Talents of Nanning New and High-tech Industrial Development Zone,Nanning 530007,Guangxi,China)
Using Rhodotorula benthica M1202 as the original strain,the L-phenylalanine ammonia-lyase(PAL)of M1202 could transform trans-Cinnamic acid(t-Ca)to L-phenylalanine.The aim of this study was to obtain new Rhodotorula benthica mutants with high conversion rate.UV induced mutagenesis of protoplast was performed on original strain Rhodotorula benthica M1202.A genetically stable mutant strains TM2was selected from a large amount of the regenerative mutants.The conversion rate of TM2was1.15-fold increased compared with its original strain.Further experiment confirmed after six generations successively propagating the conversion rate of TM2 was stable.
Rhodotorula benthica;L-phenylalanine ammonia-lyase;protoplast mutation
10.3969/j.issn.1005-6521.2015.01.029
2013-07-29
南寧市科學研究與技術開發計劃項目(20125193);梧州市科學研究與技術開發計劃項目(201201023)
李麗(1988—),女(漢),碩士研究生,研究方向:食品與發酵工程。
*通信作者:黃時海,男,博士,食品與發酵工程專業。

