雛雞關節炎病原菌株分離鑒定及藥敏性分析
王林果馬 軍
(1.普萊柯生物工程股份有限公司,河南洛陽 537000; 2.海南大學,海南三亞 570225)
雛雞關節炎病原菌株分離鑒定及藥敏性分析
王林果1馬 軍2
(1.普萊柯生物工程股份有限公司,河南洛陽 537000; 2.海南大學,海南三亞 570225)
根據雞胚孵化周期,對南方某公司提供的雞胚及發病小雞進行連續21d細菌調查,分別從雞胚的蛋清、蛋殼、死胚內物質、死胚的肝及關節、發病小雞的肝及關節中分離可疑細菌,并接種于營養肉湯,培養后進行細菌分離;采用生化特征法鑒定出三種優勢細菌分別為大腸桿菌、沙門氏菌及弗勞地氏枸掾酸桿菌。采用K-B法進行藥物敏感試驗,結果顯示三種菌株對復達欣、先鋒V、鏈霉素、慶大霉素、阿莫西林的敏感性達100%;對氯霉素、四環素的敏感性達75%;對利福平、萘啶酸的敏感性達25%。結果表明,對雞的細菌性疾病,采取預防措施,對癥下藥是提高經濟效益的關鍵因素。
雞胚;分離;鑒定;藥敏實驗
2014年11月中旬,南方某公司孵化場自行孵化的幾批次三黃雞雛雞1~10日齡大量雞跛行,并伴有死亡現象,死亡率較高。場方采用添加多種維生素,復合維生素B并用抗菌藥物治療,能較好控制病情繼續發展。為搞清楚導致這幾批次雛雞發病的病原,從根本上找到原因解決它,筆者設計一個實驗對病原展開調查,現將其結果匯報如下文。
1 材料與方法
1.1 材料
1.1.1 收集監測材料
活雞胚,死胚,發病小雞及死亡小雞。
1.1.2 主要儀器及藥品
生化培養箱,電子天平,光學顯微鏡,潔凈工作臺,腸桿菌科細菌生化常規微量鑒定管,藥敏鑒定試紙,革蘭氏染色試劑盒,緩沖蛋白胨水(BPW),XLD培養基及胰酪胨大豆酵母浸膏瓊脂培養基(TSEA),鑒定培養基。
1.2 方法
1.2.1 細菌調查
取雞胚的蛋清、蛋殼,死胚的內物質或死胚的肝及關節,小雞的肝及關節接種于BPW培養基中,于37℃恒溫溫箱培養24h;取BPW培養基培養物分別劃線接種于營養瓊脂平板、XLD瓊脂平板上,37℃培養24h進行細菌調查[1],記錄細菌的感染情況,并計算每天每個檢測項目的細菌感染率。
1.2.2 生化鑒定
生化鑒定項目包括以下項目:糖醇類發酵試驗、氨基酸類試驗、產硫化氫試驗、靛基質試驗、苯丙氨酸試驗、尿素試驗、枸櫞酸鹽試驗。具體操作方法按照說明書進行,記錄結果根據《伯杰氏細菌鑒定手冊》進行鑒定分離的細菌。
1.2.3 病原細菌的生物學特性研究
(1)培養特性 取純培養物分別接種于XLD平板、胰酪胨大豆酵母浸膏瓊脂培養基(TSEA),37℃培養18~24h觀察其培養特性。
(2)革蘭氏陽性、陰性染色
1.2.4 病原細菌的藥敏試驗
按NCCLS抗微生物藥物敏感性試驗M2-A8標準。本實驗采用的菌種都已經經過分離鑒定。取分離純化的四株菌做藥敏實驗,測定其耐藥性。藥敏實驗按K-B紙片擴散法進行,將四株菌株接種于1.5mlBPW培養基的EP管中,置于37℃溫箱中培養18h[2],菌液與滅好菌的0.9%生理鹽水按1:1000稀釋,在普通瓊脂平板上均勻涂布,蓋上平板,置室溫數分鐘至培養基表面無明顯液體,用無菌小鑷子夾取藥敏紙片平貼于瓊脂平板表面,然后翻轉倒置于37℃恒溫箱培養24h,測量抑菌環直徑并判定。以上所有菌株均做兩個重復。把抑菌圈直徑的大小作為判定藥物敏感性的高低的標準,采用WHO質控標準菌的敏感性及抑菌環大小,采用劃分方式報告結果,即敏感、中度敏感和耐藥(見表1)。
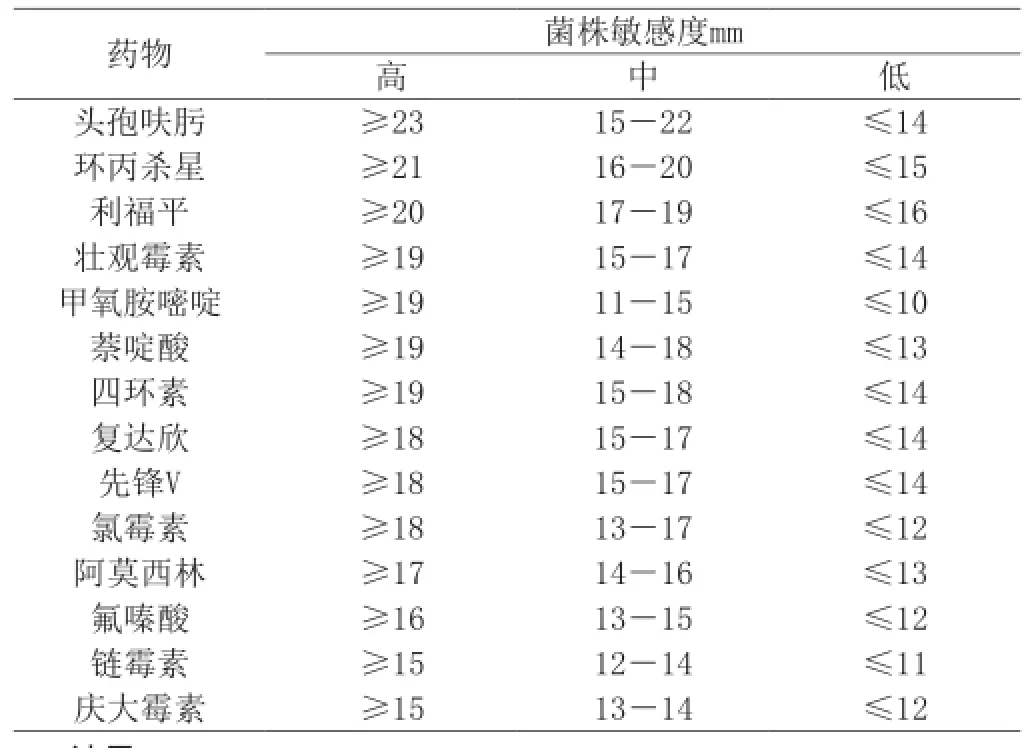
表1 具體判定標準
2 結果
2.1 細菌感染率調查結果
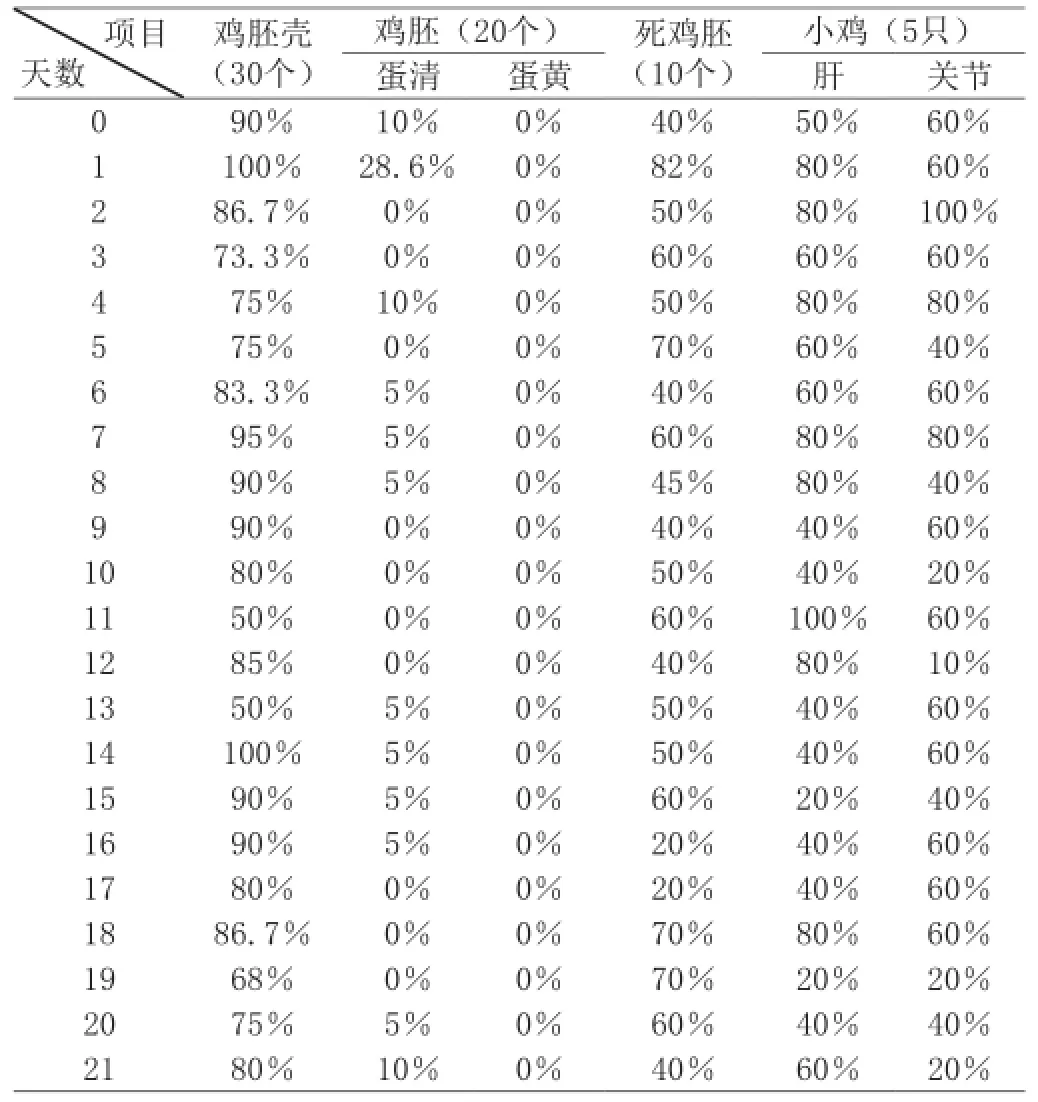
表2 各項目細菌感染率調查表
由表2可看出,每天隨機抽取的雞胚中,殼的染菌率較高,在50~100%之間浮動;根據雞胚孵化的生理時間,對雞胚的細菌調查分兩階段,第一階段中蛋清部分被染菌,感染率在0~28.6%之間,而蛋黃都未被染菌,第二階段雞胚初步成型,染菌率為0~10%之間;死的雞胚中染菌率也較高,在抽取的生長緩慢或帶病小雞中,肝和關節的染菌率,分別為20~100%和10~100%;由此可知,殼、死雞胚及小雞的肝、關節的染菌率較高,雞胚殼上的細菌通過種雞的排泄物進行水平傳播,雞胚及死雞胚中的細菌通過種雞垂直傳播,而小雞則是通過飲食或周圍環境,水平傳播或垂直傳播。
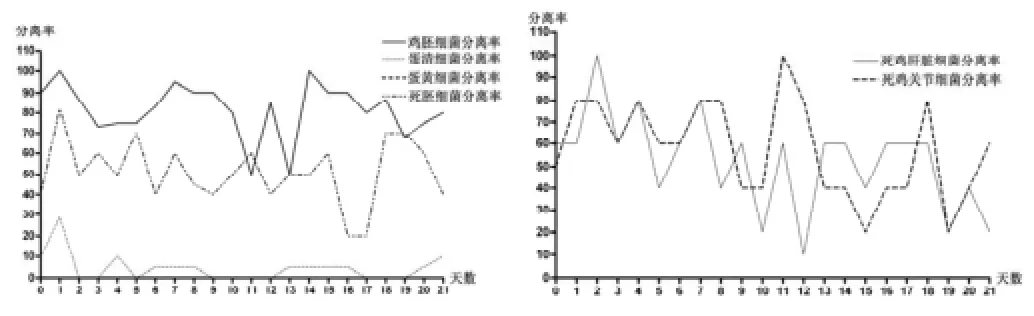
圖1 各項目細菌分離率曲線圖
2.2 病原分離結果
從雞胚殼及雞胚分離出的可疑細菌菌落形態各異(見圖2),圖中(a)、(d)分別為第5d、17d從雞胚殼上分離出的可疑細菌,菌體黃色,圓形濕潤,有光澤,不透明;(b)為第11d從雞胚殼上分離出的可疑細菌,平板上方及左下方菌體黃色,圓形濕潤,有光澤,不透明,右下方菌體黑色圓形,有光澤,不透明;(c)為第14d從雞胚內分離出的可疑細菌,菌體黑色圓形,無光澤,不透明。
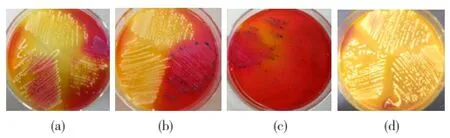
圖2 雞胚殼及雞胚分離出的細菌菌落形態
2.2.1 三種細菌在XLD選擇性培養基上的菌落形態
將從雞胚殼及雞胚分離出的可疑細菌接到XLD選擇性培養基上培養,24h后觀察其形態(見圖3.2),(a)為細菌A在此培養基上發酵乳糖產酸,在酚紅中呈黃色,菌體圓形濕潤,有光澤,不透明;(b)為細菌B與培養基中硫代硫酸鈉產生H2S,故呈黑色,菌體圓形濕潤,有光澤,不透明;(c)為細菌C發酵乳糖產酸,又與培養基中硫代硫酸鈉產生H2S,故菌在培養中黑而不亮,表面有一層黃色,邊緣也呈黃色。

圖3 三種細菌在XLD選擇性培養基上的菌落形態
2.2.2 三種細菌在胰酪胨大豆酵母浸膏瓊脂培養基上的菌落形態
將從雞胚殼及雞胚分離出的可疑細菌接到胰酪胨大豆酵母浸膏瓊脂培養基上培養,24h后觀察其形態(見圖4),圖中(a)為細菌A,菌體乳白色,圓形濕潤,有光澤,半透明;(b)為細菌B,菌體乳白色,圓形濕潤,有光澤,不透明,菌落直徑較小,(c)為細菌C,菌體形態與細菌B相似。

圖4 三種細菌在胰酪胨大豆酵母浸膏瓊脂培養基上的菌落形態
2.3 細菌菌體形態
對所分離的菌落進行革蘭氏染色鏡檢,三種細菌鏡檢結果都為革蘭氏陰性,圖5為細菌A,其菌體形態兩極鈍圓,短桿狀;圖5細菌B的菌體形態細桿狀,散亂分布;圖5 細菌C的菌體形態桿狀,且較粗短,均勻分布。

圖5 細菌A、B、C菌體光鏡下形態.
2.4 細菌的生化鑒定
2.4.1 細菌的生化鑒定結果
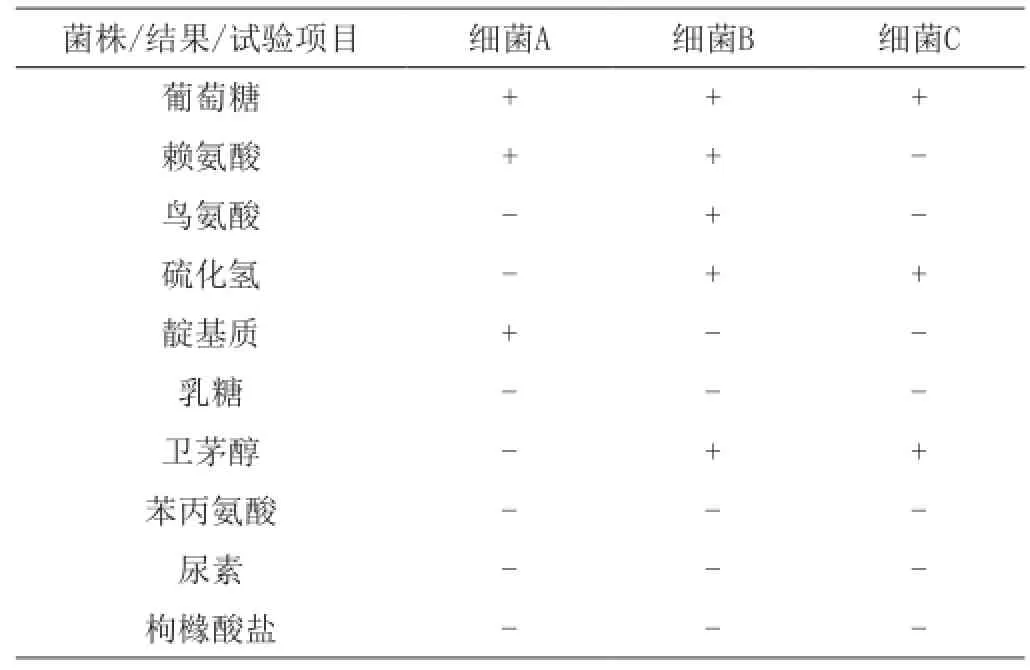
表3 生化鑒定結果
2.4.2 三種細菌的鑒定結果
菌A鑒定值為AG440,鑒定結果為大腸埃希氏菌;菌B鑒定值為AG710,鑒定結果為沙門氏菌;菌C鑒定值為AG110,鑒定結果為弗勞地氏枸櫞酸桿菌。
2.5 藥敏試驗
三種菌株的藥敏試驗,18~24h的試驗結果(見圖6)
三種菌株的藥敏試驗,18~24h的試驗結果(見圖6)
2.5.1 不同藥物對不同菌株的抑菌直徑
2.5.2 三株菌株對20種藥物的耐藥與敏感情況
3 分析與討論
3.1 對細菌性疾病的預防措施
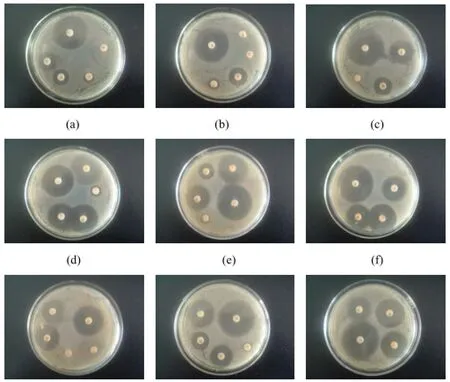
圖6 三種菌株的藥敏試驗結果
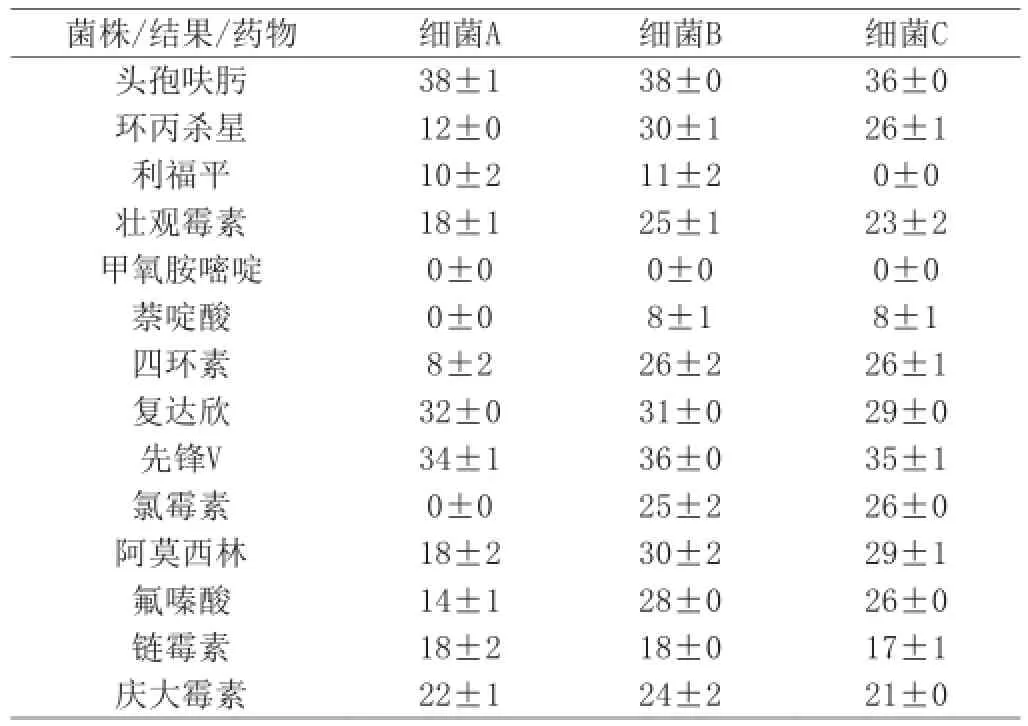
表4 三株菌株的抑菌直徑(單位:mm)
表1的調查數據表明,殼、死雞胚及小雞的肝、關節的染菌率較高,雞胚殼上的細菌通過種雞的排泄物進行水平傳播,雞胚及死雞胚中的細菌通過種雞垂直傳播,而小雞則是通過飲食或周圍環境,水平傳播或垂直傳播,從而導致雞的孵化率低、雞生長緩慢、跛腳甚至死亡等病癥,因此疫病的綜合性防制和營造良好的飼養環境就成為了養雞業控制大腸桿菌病的關鍵所在。我們僅從飲水、飼料和雞舍這三個方面就輕而易舉地說明道理:飲水極易腐敗變質,通常養雞場使用的是貯水式給水器和罐式飲水器,在混入的飼料、塵埃和雞的唾液等污物的污染下,通常-晝夜細菌會增殖百萬倍,尤其是夏季和雞舍內溫度較高的情況下,以及在飲水中添加營養性物質(如維生素等)。在飼料中反映出的問題更為嚴重,本來大腸桿菌對抗生素類藥品就有較強的抗藥性,但現在的-些飼料生產企業濫加抗生素,使病原微生物產生的抗藥性給預防和治療都帶來極大的困難[3]。另外,飼料廠在生產中原材料品質較差,劣質的原料(魚粉、骨粉、羽毛粉、血粉等)帶入大量的致病菌。雞舍的環境衛生不好,就可給大腸桿菌的繁衍創造更加良好的條件。在這種情況下諸如濕度、溫度、灰塵、酸堿度發生改變時[4],當飼養水平低下時病雞就會源源不斷地出現,因此,應做到以下預防:
(1)防止水源的污染,注意飲水的衛生和消毒,這是預防本病的重要方面。水槽要經常清洗,必要時可在飲水中加入適當濃度的消毒藥,以殺滅飲水中的病源微生物,不但對大腸桿菌病,對其他-些疾病也有較好的預防作用。
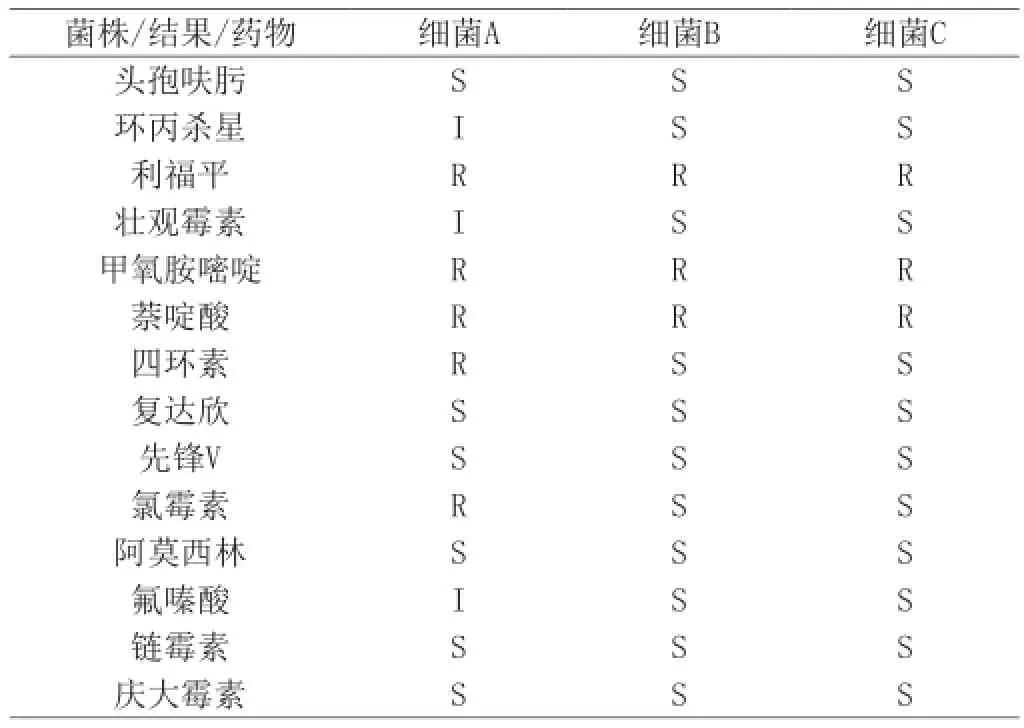
表5 三株菌株的藥物敏感度
(2)種雞場要及時收撿種蛋,避免種蛋被糞便污染,在孵化前做好種蛋細菌總數檢驗,凡被糞便污染的種蛋,一律不得做孵化。
(3)搞好種蛋、孵化器及孵化全過程的清潔衛生及消毒工作,以減少雛雞感染大腸桿菌病和大腸桿菌病的傳播。
(4)注意育雛期間的飼養管理,保持較穩定的溫度、濕度,做好飼養管理用具的消毒衛生。
(5)控制雞群的飼養密度,防止過分擁擠,保持空氣流通、新鮮,防止有害氣體污染,定期消毒雞舍、用具及養雞環境。
3.2 對細菌性關節病的治療
對細菌性關節病的治療,最好是做藥敏試驗后再用藥。因時間及條件限制時,可選用幾種對革蘭氏陰性菌和革蘭氏陽性菌都敏感的藥物試用[5]。對重度跛行雞全部淘汰,對10~30日齡的輕度跛行雛雞肌注卡那霉素,每只5千至1萬單位,經處理后,可以使淘汰病雞數量隨之減少,但確切有效的方法還有待在生產研究中不斷發現,不斷完善。
本次調查發現雞沙門氏菌可引起雞關節炎。沙門氏菌傳播的方式有:①經口感染,如通過飼料或飲水;②能垂直傳遞和水平傳播,受感染種蛋,出雛后進橫向傳播給同群雞,因幼齡雛雞敏感,故這一途徑極為重要;③間接感染,哺乳動物(包括人),鳥和昆蟲等均可為傳染源,其中特別重要的使老鼠和甲蟲,它們會將病源從一群傳播到另一群。因此要對沙門氏菌達到有效防治,就要做到以下幾點:①加強飼養管理,如飼料飲水的控制管理,環境對健康雞腸道菌群的構成起決定作用,控制雞白痢等疾病應注意環境的凈化[6];②從種雞場開始,采用有計劃的檢疫淘汰和綜合防治相結合的方法進行凈化;③培育無雞白痢沙門氏菌的種雞群以切斷由蛋循環傳遞的鏈鎖[7-8];④消滅傳染源,逐步控制和消滅此病。
3.3 耐藥性的控制
本試驗表4、表5的藥敏結果顯示在雞胚殼上及死雞胚內分離出的四個菌株對甲氧胺嘧啶耐藥率達100%;對利福平、萘啶酸的耐藥率達75%;對氯霉素、四環素耐藥率為25%;對復達欣、先鋒V、鏈霉素、慶大霉素、阿莫西林的敏感性達100%;對氯霉素、四環素的敏感性達75%;對利福平、萘啶酸的敏感性達25%。可見菌株的耐藥性達到-個相當的程度。對于該病的控制目前我國各地主要通過使用抗菌藥物進行預防和治療,但是抗菌藥物的使用不當或濫用,不僅使成本上升,而且帶來了耐藥性等-系列問題。
國內外有關研究表明,細菌產生耐藥性的機理包括:與抗生素結合靶位改變,使抗生素與細菌親和力下降,從而使抗生素失活或活性下降;細胞膜通透性的改變,使抗生素進入細菌體內量減少;R質粒在細菌間穿梭,可將耐藥基因傳入不同的細菌,使細菌獲得耐藥性。
造成耐藥性的原因有很多,如養殖戶用藥過程中選藥、劑量、療程不當,甚至有不少專業戶常常在未確定病因的情況下,大量使用廣譜抗菌藥,存在嚴重濫用藥物現象[9];假冒偽劣獸藥產品充斥市場,個別獸藥廠家的產品有效成分含量不足,名牌中標記的劑量、療程常不能達到治療效果,對養殖戶的用藥起到嚴重的誤導作用。其中最主要的養殖戶不規范使用或濫用抗生素,使得很多耐藥菌株的產生。
要有效控制耐藥性的產生,就要做到以下幾點:①在治療過程中,做藥敏實驗篩選高敏感藥物,增加了選藥、劑量、療程的準確性;②在養殖專業戶和養殖場工作人員中進行宣傳教育,使其加強飼養管理,合理用藥,特別是合理使用抗生素;③制定相關的法律法規,對于制造假冒偽劣獸藥產品,誤導群眾的廠家進行嚴厲打擊,加大力度規范獸藥市場。
4 結論
(1)本實驗細菌感染調查數據表明,雞胚殼上的染菌率最高,死雞胚及小雞的肝、關節的染菌率次之。分別從第17d的雞胚殼上、第11d的雞胚殼上及第14d的死雞胚內分離出的細菌A、細菌B及細菌C,經鏡檢及生化鑒定,鑒定出細菌A為大腸桿菌,細菌B為沙門氏菌,細菌C為弗勞地氏枸櫞酸桿菌(C.freundii)。
(2)藥敏結果顯示三個菌株對甲氧胺嘧啶耐藥率達100%;對利福平、萘啶酸的耐藥率達75%;對氯霉素、四環素耐藥率為25%;對復達欣、先鋒V、鏈霉素、慶大霉素、阿莫西林的敏感性達100%;對氯霉素、四環素的敏感性達75%;對利福平、萘啶酸的敏感性達25%。
[1] 李鍵強,李六金.獸醫微生物學實驗指導[M]. 陜西:科學技術出版社,1999.
[2] 劉媚,曹文匯,白芳等. 雞大腸桿菌和沙門氏菌混合感染的分離鑒定及藥敏試驗研究[J] .獸醫研究,2007,(213):14-16.
[3] 石優章,徐霞芬,何水淵等.76株沙門氏菌菌型鑒定與耐藥性檢測[J].浙江預防醫學,1998,(6):383.
[4] 溫群文,袁夢,俞幕華等. 三種方法檢測沙門氏菌的比較研究[J].中國熱帶醫學,2006,6(11):1960-1961.
[5] 任廣蓮.淺談雞白痢病的凈化與防治[J].禽業科技,1998,14(2):47.
[6] 代玉林.沙門氏菌的綜合控制措施[J] .肉類工業,2003,(11):35-36.
王林果(1978-),男,禽病學博士,普萊柯生物工程股份有限公司,獸醫師。

