原代乳鼠心肌細胞分離培養的改進
原代乳鼠心肌細胞分離培養的改進
包馨慧, 李曉梅, 楊毅寧, 馬依彤, 陳邦黨, 陶靜, 陳小翠
(新疆醫科大學第一附屬醫院心臟中心, 烏魯木齊830054)
摘要:目的探討提高細胞純度、存活率及活性的乳鼠心肌分離培養方法。方法改進心臟組織的處理方法,用胰酶預處理后再用II型膠原酶依次處理心肌組織,采用差速貼壁及化學藥物純化心肌細胞。結果提取的單個心肌細胞結構完整,呈類圓形;12 h時大部分細胞貼壁;24 h后幾乎全部貼壁,僅見少量漂浮細胞,貼壁細胞伸出偽足,呈梭形、三角形等,細胞出現自主搏動。48 h后心肌細胞偽足間形成聯接,交織成網狀,局部心肌細胞出現同步搏動。3 d后心肌細胞聚集成簇,呈島嶼樣搏動。心肌細胞存活率為96.6%,純度>96%。結論此改進方法所提取培養的乳鼠心肌細胞存活率及純度高,細胞活性好,結構功能完整,可用于相關實驗中原代乳鼠心肌細胞的分離培養。
關鍵詞:心肌細胞; 原代培養; 新生大鼠
中圖分類號:Q463文獻標識碼:A
doi:10.3969/j.issn.1009-5551.2015.05.010
[收稿日期:2014-07-02]
基金項目:國家藥典委員會國家藥品(維藥)標準提高項目(510)
作者簡介:劉杰(1980-),男,碩士,主管中藥師,研究方向:中藥質量控制。
基金項目:國家自然科學基金(81260624)
作者簡介:木克熱木·吐地買提(1988-),女(維吾爾族),在讀碩士,研究方向:食品毒理學。
An improved protocol for primary cultur of myocytes extracted from neonatal rat
BAO Xinhui, LI Xiaomei, YANG Yining, MA Yitong, CHEN Bangdang, TAO Jing, CHEN Xiaocui
(DepartmentofCardiology,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,
Urumqi830054,China)
Abstract:ObjectiveTo improve the traditional method of culturing neonatal rat myocytes for the better purity, survival rate and activity of myocytes in experiments. MethodsTrypsin and type Ⅱ collagen enzyme were used to digest heart tissue and myocytes were purified with differential sticking wall method and chemical purification. ResultsThe extracted single myocyte is of structural integrity and circular shape. Most cells were touching to wall in 12 hours, and all cells sticking to wall in 24 hours, with small amount of floating cells. The touching-wall cells extended pseudopodia in the form of fusiformis, triangle and so on, with independent rhythm. Myocardial cells′ pseudopodia became connected into webs 48 hours later, with local synchronization rhythm. There days later, myocytes gethered into clusters, with island-like pulse. The activity and purity of myocytes was up to 96%. ConclusionThis method helped improve the activity and purity of myocytes, and protect the integrity of cells. The extracted myocytes could be used in relative experiments.
Key words: myocardial cell; primary culture; neonatal rat
乳鼠心肌細胞常被用作體外實驗研究模型,用于心血管病的基礎研究。雖然早在1960年,Harary等[1]已提出原代乳鼠心肌細胞分離培養方法,但由于這一傳統方法所分離的心肌細胞存活率及純度低、細胞活性差等原因,尚不能滿足于基礎研究的需求。目前所報道的培養方法大多基于傳統方法進行改進[2-12],主要分為單一酶消化法和混合酶消化法2種,前者單一使用胰酶消化會引起心肌細胞消化過度,降低心肌細胞的存活率;后者則由于消化能力減弱造成心肌組織消化不完全,獲得心肌細胞數目較少。對于原代乳鼠心肌細胞分離培養仍無統一的方法。為了得到純度及活力較高的心肌細胞而滿足于實驗的需要,本研究對乳鼠心肌細胞分離培養的方法進行了探索,改進了傳統的分離方法,現報道如下。
1材料與方法
1.1材料
1.1.1實驗動物新生SD大鼠乳鼠(1~3 d),由新疆醫科大學實驗動物中心提供。
1.1.2實驗試劑及設備胰蛋白酶(Sigma),Ⅱ型膠原酶(Sigma),D-Hanks(武漢博士德生物工程有限公司),高糖DMEM(Gibco),胎牛血清(Gibco),青鏈霉素(Sigma),5-溴脫氧尿核苷(Brdu,Sigma),臺盼藍,抗cTNT抗體(Abcam),二抗(Immuno Reagents),驢血清,0.25% Triton-X100,4%多聚甲醛,PBS,DAPI(Immuno Reagents),濾器,注射器,超凈臺(上海智城分析儀器制造有限公司),二氧化碳培養箱(Thermo),水浴鍋,搖床,離心機,倒置熒光顯微鏡(Leica)。
1.2方法
1.2.1消化酶的配制胰酶和II型膠原酶均用D-Hanks配制,胰酶濃度為0.1%,Ⅱ型膠原酶濃度為0.08%,用NaHCO3或HEPES將pH調節為7.0~7.2。
1.2.2心肌細胞的培養及純化取新生(1~3 d)SD乳鼠,75%乙醇消毒后開胸剪取心臟,將心臟放入預冷的D-Hanks中,用鑷子輕輕擠壓排出殘留血液,剪取心尖1/3處,分別沿橫軸、縱軸將心室剪為花瓣樣,4~8瓣即可。將剪好的心肌組織放入提前配好并預冷的0.1%胰酶中,置于4℃冰箱水平搖床上,速度50次/min,過夜消化12~14 h。第2天用等體積的完全培養液中和胰酶,于37℃水浴搖床以90次/min速度震蕩10 min后吸棄上清液。用配好的II型膠原酶消化心肌組織,37℃水浴搖床以90次/min速度震蕩7~10 min,每次消化完的上清液吸入等體積的完全培養液中,將盛有含消化后上清液的離心管擰松瓶蓋置于二氧化碳培養箱中,以此重復4~5次直至組織完全消化。所得的消化液1 200 r離心8 min。37℃水浴鍋預熱的完全培養液重懸得到細胞懸液,將其接種于直徑為10 cm的培養皿中,置于二氧化碳培養箱中差速貼壁2次,時間分別為50、40 min。收集并計數差速貼壁后的細胞,用預熱的完全培養液將細胞濃度調整為5×105/mL后加入Brdu 0.1 mmol/L。將細胞接種于6孔板中,用免疫熒光法檢測心肌細胞純度。靜置培養48 h后換液,2~3 d更換1次培養液。
1.2.3心肌細胞存活率檢測重懸時取細胞懸液稀釋為約1×106個/mL,用0.4%臺盼藍染色,著色的為死細胞,其余為活細胞。顯微鏡下計數細胞以計算細胞存活率,細胞存活率=活細胞數/細胞總數。
1.2.4心肌細胞形態學觀察倒置熒光顯微鏡下觀察并記錄心肌細胞在1、2、3 d及1 w時的形態、自主搏動情況及頻率。
1.2.5心肌細胞純度鑒定用免疫熒光法鑒定心肌細胞純度,一抗為抗心肌肌鈣蛋白T抗體,二抗標有紅色熒光。將培養72 h的接有心肌細胞的6孔板用PBS清洗2~3遍,室溫下4%多聚甲醛固定10 min,0.25% Triton-X100透化10 min,驢血清封閉30 min后加入一抗孵育1 h。加入二抗避光孵育1 h后用DAPI 1 μg/mL染色1 min。于倒置熒光顯微鏡下觀察并計數心肌細胞。
2結果
2.1心肌細胞存活率臺盼藍染色計數356個細胞中12個染色陽性,344個染色陰性,細胞存活率為96.6%。
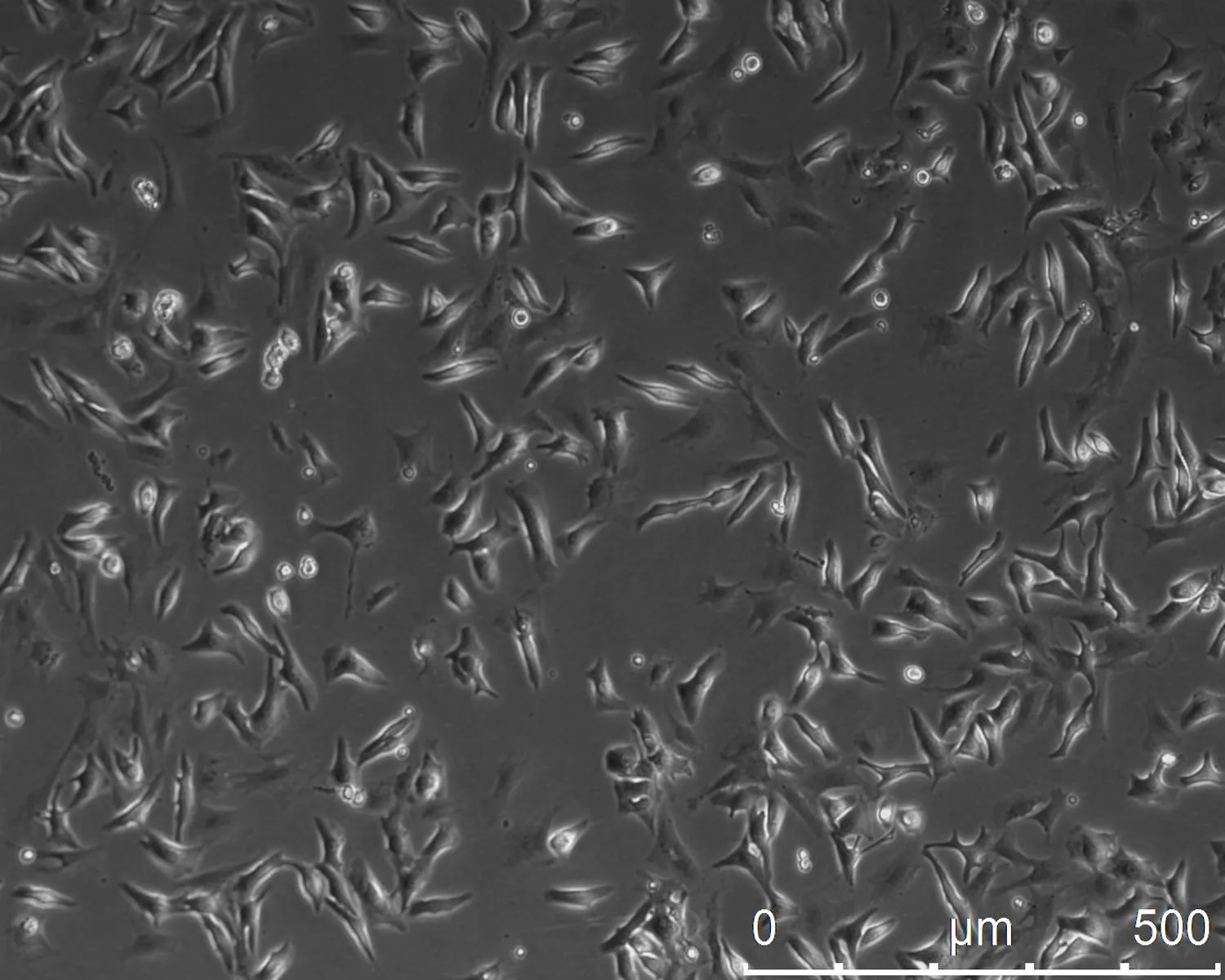
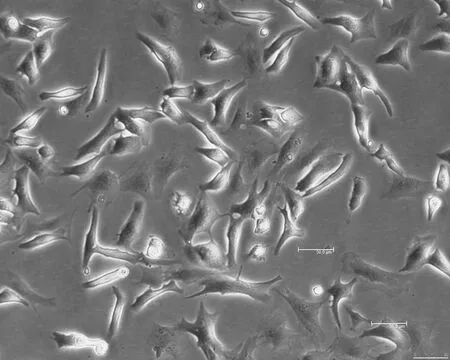
2.2心肌細胞形態學顯微鏡下可見剛分離出的單個心肌細胞結構完整,呈類圓形,12 h后大部分心肌細胞貼壁,出現少量的自主搏動,頻率緩慢(5~10次/min),24 h后幾乎全部貼壁,僅見少量漂浮細胞,貼壁細胞伸出偽足,呈梭形、三角形等,貼壁細胞的細胞核大且胞漿豐富,立體感明顯且折光性好,細胞出現自主搏動,搏動頻率不同,為20~30次/min(圖1)。48 h后心肌細胞偽足間形成聯接,交織成網狀,局部心肌細胞出現同步搏動(圖2)。3 d后心肌細胞聚集成簇,呈島嶼樣或放射狀搏動(圖3)。1 w后細胞搏動逐漸減弱,并出現細胞皺縮、脫落。
2.3心肌細胞純度鑒定倒置熒光顯微鏡下鑒定心肌細胞(圖4),紅色為與熒光標記二抗結合的特異性心肌肌鈣蛋白cTNT,藍色為DAPI所染細胞核。計數后心肌細胞純度>96%。
3討論
心肌細胞原代培養是心血管疾病基礎研究中一個重要部分,如何分離培養出純度高、活性好的心肌細胞對于實驗研究至關重要。本研究對傳統的原代乳鼠心肌細胞分離培養方法進行了改進,所提取培養的乳鼠心肌細胞存活率及純度高,細胞活性好,結構完整,可用于相關實驗中乳鼠心肌細胞培養,認為關鍵是平衡鹽溶液的選擇、溶液pH的調節、溫度的調節、消化酶的選擇及差速貼壁及化學藥物抑制成纖維細胞。

ABC
圖124 h后心肌細胞形態(A、B、C 分別為×100、×200、×400)


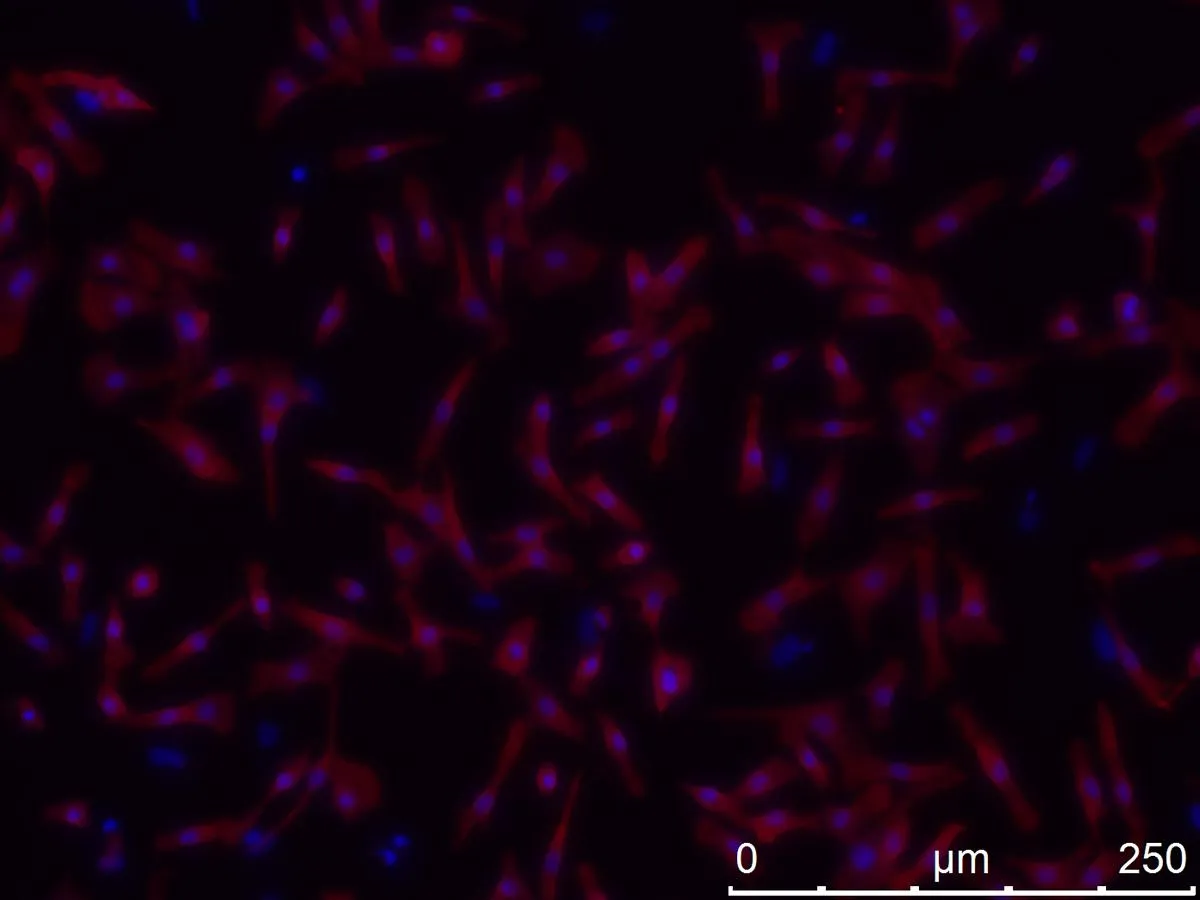
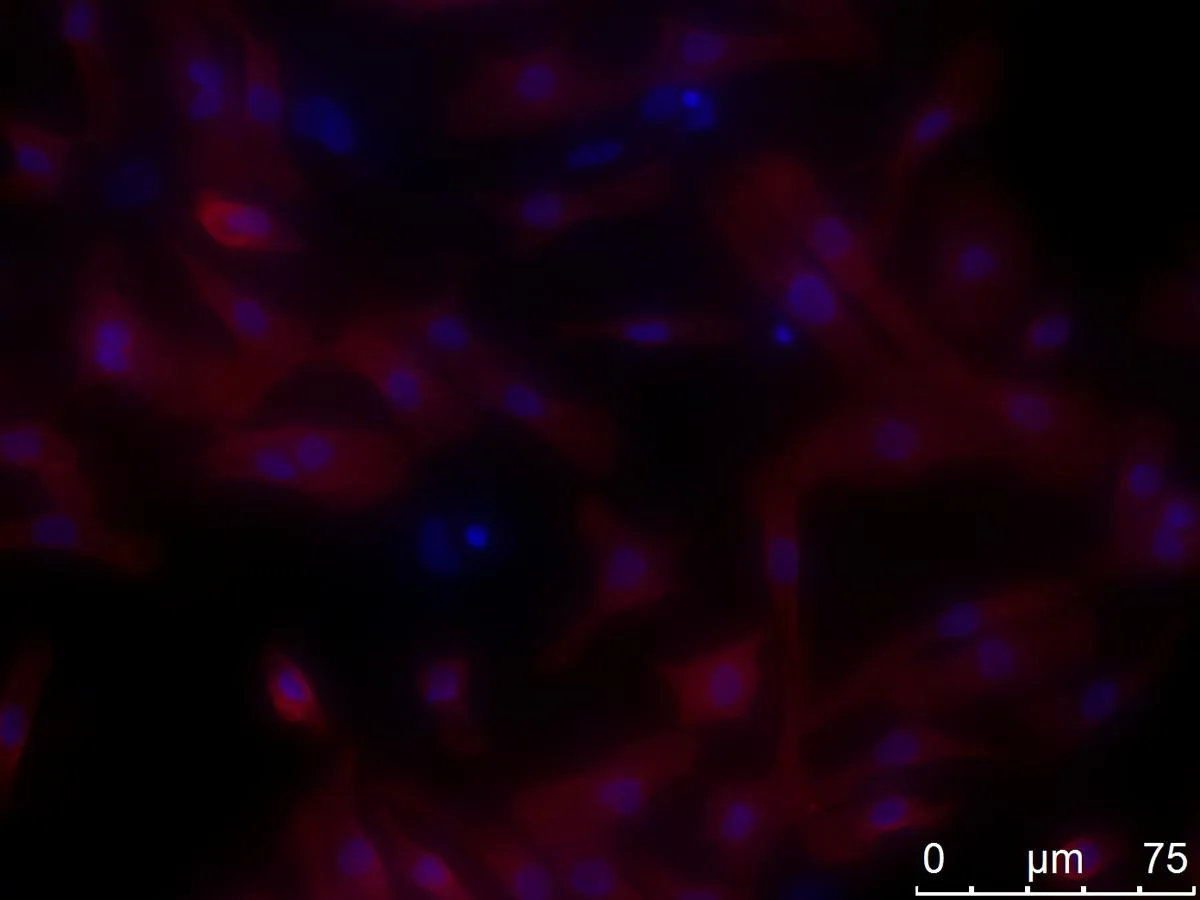
圖248 h后心肌細胞形態(×100)>圖372 h后心肌細胞形態(×100)A(×100) B(×400)
圖4免疫熒光結果 ×400倍下可見心肌細胞肌絲結構
3.1平衡鹽溶液的選擇平衡鹽溶液的選擇非常重要,以往常用于配制試劑的平衡鹽溶液主要有PBS、Hanks。然而,由于PBS、Hanks中含有Ca2+、Mg2+,能降低胰酶活性,因此在配置胰酶時要選擇不含Ca2+、Mg2+的鹽溶液以免胰酶活性降低而達不到消化的目的[13]。本研究參照文獻[13]選擇不含Ca2+、Mg2+的D-Hanks來配制胰酶。
3.2溶液pH的調節離體心肌細胞對pH非常敏感,培養液過酸或過堿均會影響心肌細胞的貼壁能力及活性[13]。本研究發現培養液pH在7.0~7.2時細胞貼壁最好,活性最佳。本實驗在調節培養液及D-Hanks的pH值時添加了HEPES 10 mmol/L,因HEPES緩沖能力較強而無毒,有利于保持穩定的酸堿度。
3.3溫度的調節在心肌細胞分離培養的整個過程中溫度的控制非常重要。0.1%胰酶消化4℃過夜目的是降低胰酶的消化強度,使胰蛋白酶緩慢滲透到心肌組織內部,較溫和地將細胞消化下來而又不傷害細胞膜和破壞細胞的結構[10-11]。以此方法預處理后所得的心肌細胞存活率及活性要高于37℃消化預處理。由于分離下來的心肌細胞對外界環境較敏感,本實驗將完全培養液37℃水浴預熱,使心肌細胞所處環境溫度保持穩定,降低了外界溫度變化對心肌細胞引起的傷害。
3.4消化酶的選擇目前最常用于心肌細胞分離培養的消化酶有胰蛋白酶和膠原酶[8-13]。胰蛋白酶主要用于分解組織間的蛋白成分,作用較強,使用時要把握好消化的濃度以及時間,消化過度會分解細胞膜表面蛋白破壞細胞膜,進而破壞細胞的結構和功能[14-15]。膠原酶能特異性地分解組織間的膠原纖維以釋放心肌細胞,作用較溫和,不會對心肌細胞造成傷害[2-5]。本研究選擇低濃度0.1%胰酶4℃過夜預處理心肌組織,目的是使胰蛋白酶緩慢滲透到心肌組織內部,分解組織間質蛋白,使組織變疏松,之后再用Ⅱ型膠原酶多次消化。Ⅱ型膠原酶的濃度可根據使用乳鼠的心臟組織的個數來調整,少于10個心臟組織時Ⅱ型膠原酶濃度用0.08%,多于10個心臟組織可將濃度提高到0.1%。由于膠原酶消化能力較為緩和,可適當提高膠原酶濃度。
3.5差速貼壁及化學藥物抑制成纖維細胞不同的細胞種類貼壁的時間不同,所分離的細胞中成纖維細胞較心肌細胞貼壁能力強,較早即可貼壁,因此可用差速貼壁法來分離心肌細胞與成纖維細胞。傳統的方法差速貼壁1次,貼壁90 min,但由于細胞平鋪于皿底,很多漂浮在培養液上層的成纖維細胞接觸不到皿底,不能使成纖維細胞與皿底充分接觸。本實驗采用2次差速貼壁方法,加大了成纖維細胞與皿底接觸的機會,有利于提高心肌細胞的純度。Brdu的作用機理是代替胸腺嘧啶核苷參與DNA的合成,從而抑制生長細胞的增殖。研究表明,Brdu不會對心肌細胞造成影響[16]。本實驗在培養液中加入Brdu,可在細胞長期培養中抑制成纖維細胞的增殖,保證心肌細胞的純度。
本研究通過胰酶4℃過夜緩慢消化以及膠原酶溫和特異性消化,并且控制液體的pH值和溫度來提高細胞的存活率,用不含谷氨酰胺的完全培養液,2次差速貼壁以及化學藥物來抑制成纖維細胞生長提高心肌細胞純度。通過以上這些改進可得到純度高、活性好且存活率高、結構功能完整的心肌細胞,為后續的實驗研究創造了條件。
參考文獻:
[1]Harary L, Farley B. In vitro studies of single isolated beating heart cells [J]. Science, 1960, 131:1674-1675.
[2]張曉京,張建東,來麗娜,等. SD乳鼠原代心肌細胞培養方法的改進[J]. 長治醫學院學報,2012,3(26):171-173.
[3]柳梅,張剛成,姚藝,等. 乳鼠心肌細胞的體外培養[J]. 臨床和實驗醫學雜志,2009, 1(8):3-4.
[4]張麗娜, 金國琴, 郭煒,等. 原代乳鼠心肌細胞的培養方法[J]. 中藥藥理與臨床,2010, 26(5):148-150.
[5]伍長學,范英,李新,等. 新生大鼠心肌細胞原代培養方法的改進[J]. 瀘州醫學院學報,2009, 1(32):1-4.
[6]張琳,李東野,王志榮,等. 新生大鼠心肌細胞原代培養方法的改良[J]. 徐州醫學院學報,2008,28(5):303-306.
[7]李博,吳慧穎,樸虎林,等. 新生大鼠心肌細胞原代培養方法的改良[J]. 中國實驗診斷學,2012,2(16)200-203.
[8]龐勇軍,孫莉,謝文君,等. 新生大鼠心肌細胞分離、純化及培養方法的改進[J]. 上海交通大學學報,2014,4(31):520-523.
[9]施雨露,李曉轅,曹美娜,等. 新生大鼠心肌細胞和心肌成纖維細胞的同時分離[J]. 中國組織工程研究,2013,24(14):4414-4417.
[10]李志軍,曹雪濱. 新生大鼠原代心肌細胞的培養[J]. 新鄉醫學院學報,2012,1(29):11-17.
[11]陶靜,馬依彤,李曉梅,等. 原代乳鼠心肌細胞培養方法的改進[J]. 中華心血管病雜志,2014,42(1):53-56.
[12]娜幾娜,王凌鵬,馬艷,等. 小鼠乳鼠心肌細胞的原代培養[J]. 新疆醫科大學學報,2008, 31(7):786-787.
[13]楊瑞豐,潘偉. 心肌細胞培養進展. 中國心血管病研究雜志[J],2005,8(3):634-636.
[14]Kong C R, Bursac N. Mechanoelectriacl excitation by fluid jets in monodayers of cultured myocytes [J]. J Appl Physiol, 2005,98(6):2328-2336.
[15]李志勇. 細胞工程[M].2版. 北京:科學出版社, 2010:43-44.
[16]Simpson P, Savion S.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells. Cross-striations, ultrastructure, and chronotropic response to isoproterenol[J]. Circ Res, 1982,50(1):101-116.
(本文編輯楊晨晨)
通信作者:田樹革, 男,博士, 教授, 博士生導師, 研究方向: 中藥質量控制及評價, E-mail: tsgyz@sina.com。
通信作者:劉濤(1974-),女,博士,教授,碩士生導師,研究方向:食品毒理學,E-mail:xjmult@163.com。

