青魚(Mylopharyngodon piceus)新發病病原類志賀鄰單胞菌(Plesiomonas shigelloides)的分離鑒定*
葉 鍵 劉曉寧 王 曉 徐 慧 沈文英 高敏杰 章曉棟①
(1. 紹興文理學院生命科學學院 紹興 312000; 2. 杭州市水產技術推廣總站 杭州 310001; 3. 杭州大江東產業集聚區農業局 杭州 311222; 4. 紹興出入境檢驗檢疫局 紹興 312000)
青魚(Mylopharyngodon piceus)亦稱黑鯇、螺螄青, 屬硬骨魚綱、鯉科魚類。個體大, 生長迅速, 最大個體可達70kg, 肉味美。分布于中國各大水系, 主產于長江以南平原地區, 為中國主要淡水魚類養殖對象, 是我國淡水養殖的“四大家魚”之一(Li et al,1995)。近年來由于環境、飼料、養殖管理等因素導致的青魚病害問題不斷, 已經報道的可引發青魚大規模病害的主要病原菌有嗜水氣單胞菌(Aeromonas hydrophila)、熒光假單胞菌(Pseudomonas fluorescens)等(Wang et al, 2009; 張波等, 2010), 尤其是前者容易引起急性暴發, 造成青魚大規模死亡。由于兩者均可引發其它大宗淡水魚類死亡, 因而對青魚的感染及致病機理研究不深入。目前專門針對青魚病害的研究涉及較少, 由類志賀鄰單胞菌引發的青魚病害也未見報道。
2015年8月, 杭州市一養殖場青魚暴發病情, 發病魚不分個體大小, 行動緩慢, 反應遲鈍, 常離群獨游; 體表出現潰爛, 位置不一; 解剖可見腸道充血,腎臟腫大, 呈紫紅色, 日死亡率達5%以上。本實驗自病癥典型患病魚體內分離到1株可疑菌株, 經生化和分子生物學方法鑒定其為類志賀鄰單胞菌, 并進一步通過回歸感染確定了其病原性, 同時檢測了其毒力和藥物敏感性, 為生產中正確預防及治療該菌的感染提供了科學參考。
1 材料與方法
1.1 材料
藥敏紙片購自杭州天和微生物試劑有限公司;Premix Ex Taq, PCR產物純化試劑盒購自TaKaRa公司(日本); 細菌基因組抽提試劑盒購自 Qiagen公司(德國); 健康青魚(1000—1200g)購自杭州市某青魚養殖場, 體表無傷, 隔天喂食, 養殖一周確認健康后用于致病性實驗; 40日齡SPF級BALB/c雌性小鼠購自浙江中醫藥大學實驗動物中心。
1.2 病原菌分離及保存
將患病的青魚用 75%的酒精進行體表消毒處理,用手術刀刮除潰爛處腐肉后, 從肌肉處分離接種于LB瓊脂培養基上; 解剖后從肝臟、腎臟處分離接種于LB瓊脂培養基上。將培養基置于37°C培養36 h,挑取優勢菌群進行分離純化, 然后接種至營養瓊脂上培養。同時將純化后的菌液加入等體積的20% (V/V)甘油, 于–80°C超低溫冰箱中保存備用。
1.3 病原菌形態及生理生化特性檢測
將細菌菌株純化培養后, 經涂片、固定和革蘭氏染色后, 使用光學顯微鏡觀察。用等滲的無菌生理鹽水洗下菌苔, 在JSM-6360LV掃描電鏡進行觀察。對分離菌株用 API ID32E系統(Biomerieux, 法國)進行生化鑒定。
1.4 16S rDNA的PCR 擴增、測序和分析
以細菌基因組為模板, 應用16S rRNA通用引物(8F: 5′-AGAGTTTGATCCTGGCTCAG-3′; 1492R: 5′-AAGGAGGTGATCCAGCCGCA-3′)進行 PCR 擴增。PCR產物用 PCR產物純化試劑盒回收后, 交Invitrogen公司測序。將測序所得到菌株 16S rRNA序列通過NCBI的Blast檢索系統進行序列同源性分析。選取同源性較高的同種菌株的 16S rRNA序列,設置外群, 使用 MEGA4.0軟件, 采用鄰接法構建系統發育樹。通過自舉分析進行置信度檢測, 自舉數集1000次。
1.5 藥敏實驗
采用紙片擴散法(K-B法)進行細菌藥敏性試驗,培養24h的細菌以無菌生理鹽水洗下, 制備成濃度約1×107CFU/mL, 均勻涂布于LB固體培養基上, 用無菌鑷子將藥敏紙片均勻貼在平板上, 37°C培養24h后測量抑菌圈直徑。
1.6 動物實驗
取純化的菌株劃線接種于LB平板, 30°C下培養18h。用生理鹽水將菌苔洗下, 稀釋成四個濃度的細菌懸液: 1.0×106、1.0×107、1.0×108、1.0×109CFU/mL,用于感染試驗。
1.6.1 細菌回歸實驗 實驗用青魚在實驗開始前48h停食。將青魚分為兩組, 每組10條。陽性組每條青魚注射0.1mL菌液; 陰性組每只注射0.1mL生理鹽水。控制水溫為28°C, 期間充氧, 不換水。感染后記錄發病死亡情況。死亡魚進行解剖, 隨機選取兩條進行病原菌分離鑒定。
1.6.2 毒力實驗 健康小鼠25只平均分成5個組。4個陽性組每只小鼠腹腔注射0.1mL菌液, 菌液濃度分別為 1.0×106、1.0×107、1.0×108、1.0×109CFU/mL。陰性對照組小鼠每只注射0.1 mL無菌生理鹽水。觀察記錄發病和死亡情況, 并用改良寇氏法計算LD50值。
2 結果
2.1 菌株形態
分離菌株培養18h后形成的菌落低凸, 圓形, 直徑 1—2mm, 邊緣光滑, 表面濕潤(圖 1), 有刺激性氣味。光鏡檢測發現分離菌株革蘭氏染色為陰性, 短鏈狀桿菌, 呈單個或成對分布。透射電鏡觀察, HZ2015菌株呈末端圓形直桿狀, 無芽孢和莢膜, 兩端有叢生鞭毛, 大小(短徑×長徑)為 0.7—0.9μm×1.5μm (圖 2)。
圖1 營養瓊脂上菌落形態Fig.1 Arrangement of the colonies shown on nutrient agar

圖2 菌株透射電鏡圖像Fig.2 TEM image of the strain
2.2 病原菌的生化鑒定
ATB ID 32E生化鑒定系統表明(表1), HZ2015屬于類志賀鄰單胞菌屬, 準確率為99.9%。

表1 病原菌的生化特征Tab.1 Major biochemical characteristics of the pathogenic bacteria strains
2.3 分離菌株的16S rRNA基因序列測定與分析
將測序所得序列輸入到 NCBI進行 Blast檢索,發現菌株HZ2015與類志賀鄰單胞菌自然聚類, 同源性百分比 98.5%—99.9%。選取同源性較高的類志賀鄰單胞菌的16S rRNA基因序列, 并以腸桿菌科的沙門氏菌屬(Salmonella)、愛德華氏菌屬(Edwardsiella)和腸桿菌屬(Enterobacter)等菌株為外群, 進行分子系統發育分析, 結果如圖3所示。
2.4 藥敏實驗
對29種藥物的敏感性試驗結果顯示(表2), 菌株HZ2015對頭孢哌酮、頭孢呋辛、慶大霉素、卡那霉素、先鋒霉素 5、先鋒霉素 6、復達欣、新霉素、強力霉素、美滿霉素、多粘霉素B和呋喃唑酮高度敏感;對青霉素、苯唑西林、氨芐西林、頭孢曲松、萬古霉素、羧芐西林、和頭孢氨芐耐藥。
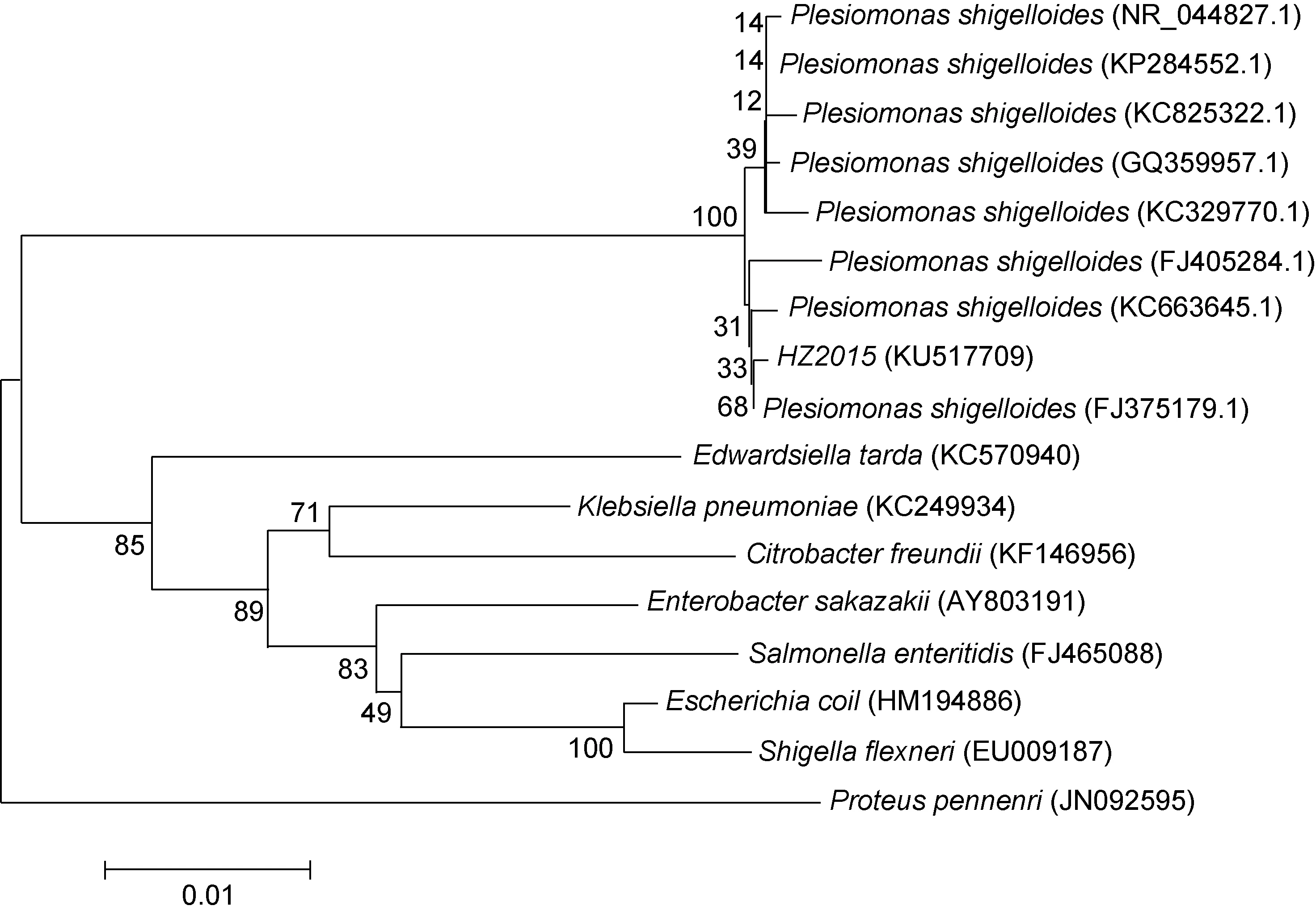
圖3 菌株HZ2015 16S rDNA基因序列系統發育樹Fig.3 Phylogenetic tree of strain HZ2015 based on 16S rRNA gene sequence
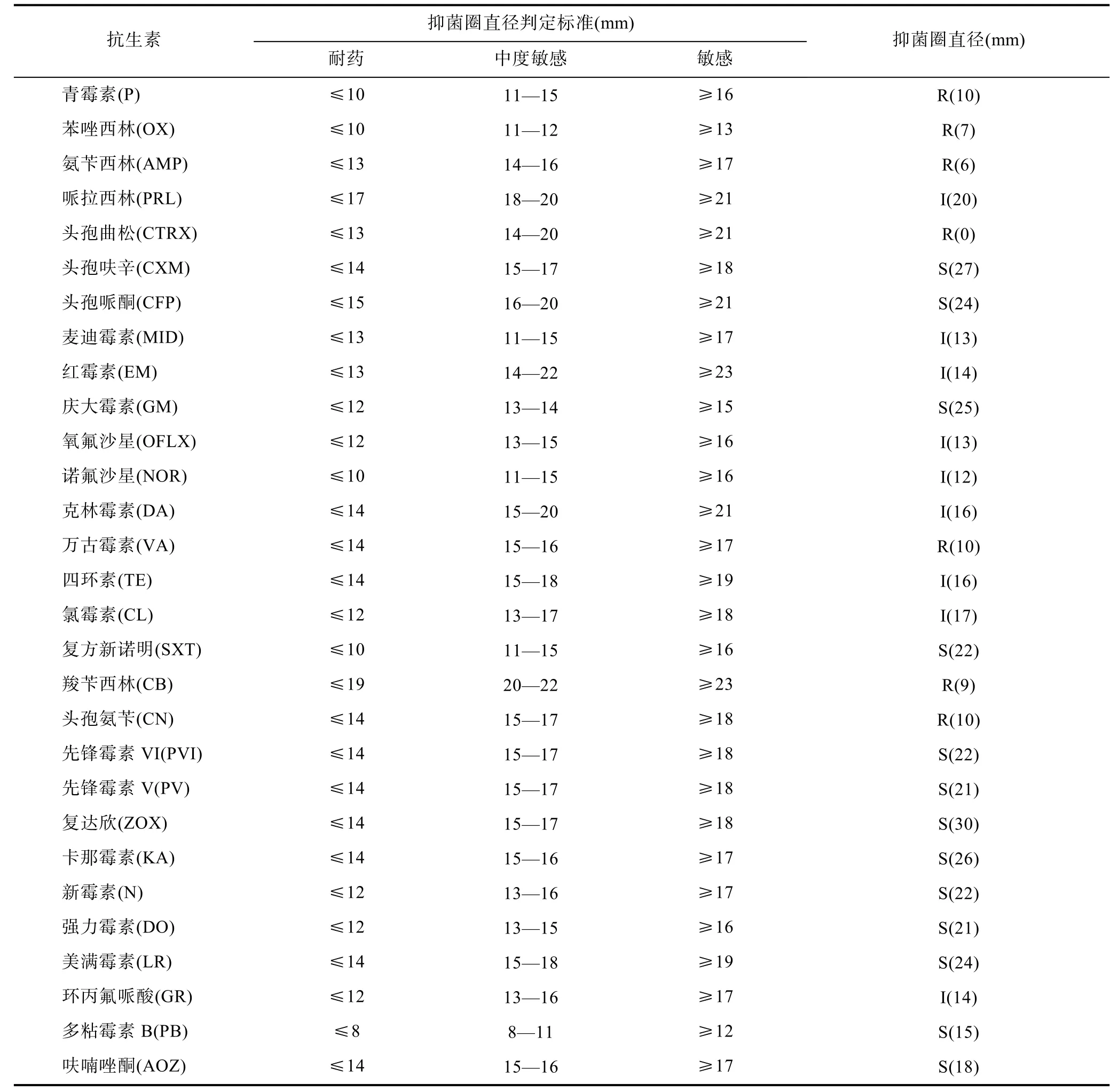
表2 藥物敏感性試驗Tab.2 Results of test for antibiotic susceptibility
2.5 動物實驗
2.5.1 細菌回歸實驗 結果顯示, 水溫升高至28°C, 感染后 36h, 開始出現死亡, 到第 48小時, 死亡率最高達 100%, 而對照組死亡率均為 0(表 3), 病死魚呈現出與自然發病類似的癥狀(圖 4), 表現為體表潰爛, 腸道充血腫脹, 腎臟腫大。從死亡青魚的肝臟、肌肉等組織均能分離到形態一致的菌落, 對其進行生化鑒定和16S rDNA同源性比對, 結果顯示為同一菌株。
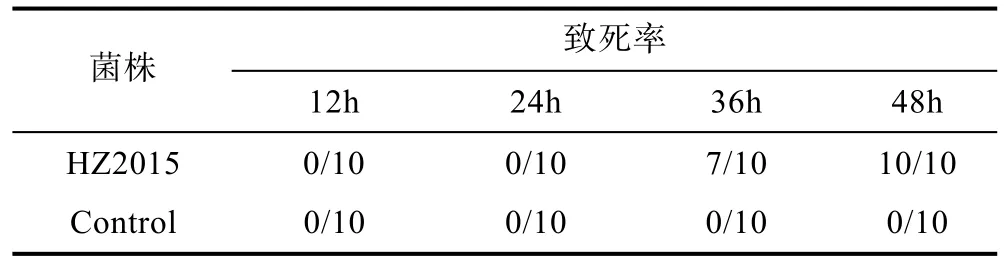
表3 回歸感染試驗Tab.3 Results of artificial infection test
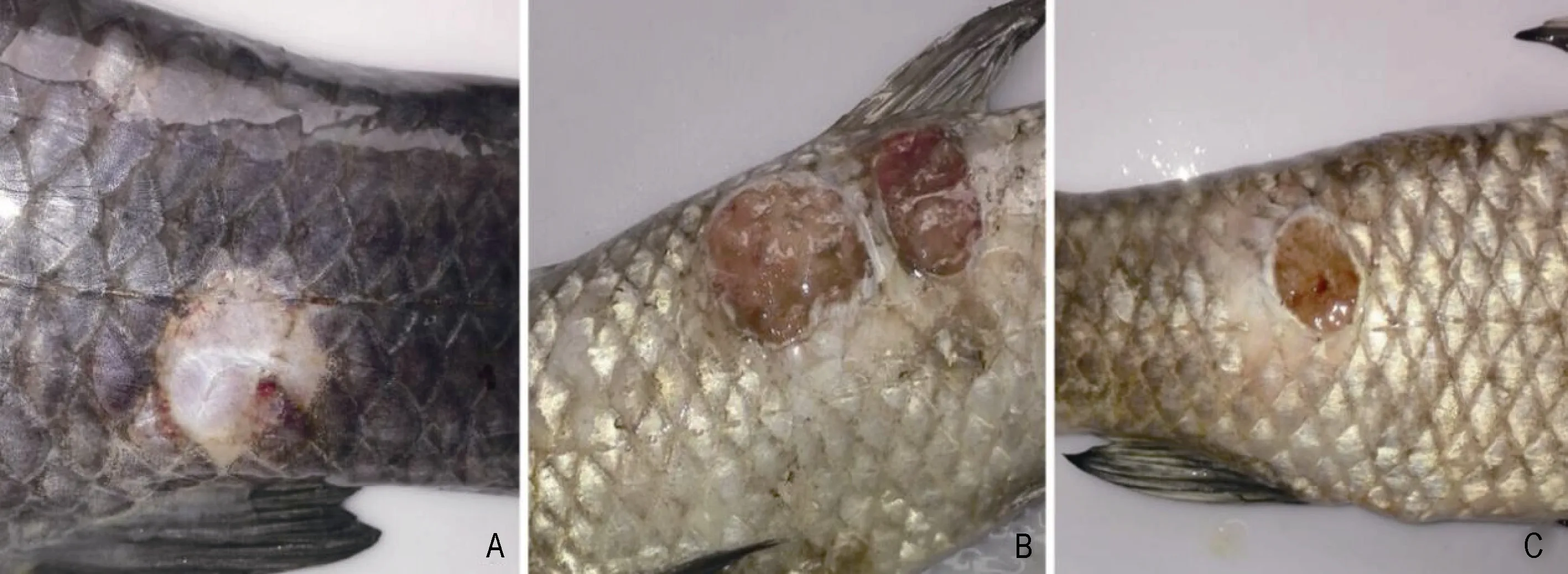
圖4 病魚體表潰爛Fig.4 Ulcerated body surface of diseased fish
2.5.2 毒力實驗 小鼠于接種菌液后 12h開始出現臨床癥狀, 高劑量組小鼠在接種后 24h大量死亡,其它組死亡高峰出現在接種后48h (表4)。根據改良寇氏法計算, 菌株HZ2015 LD50值為106.6CFU/mL。
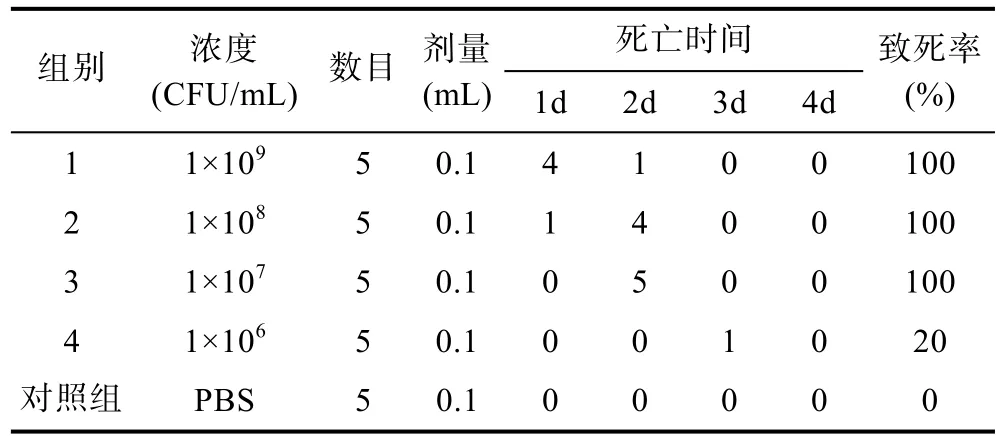
表4 HZ2015細菌毒力實驗Tab.4 Pathogenic test of strain HZ2015 in mice
3 討論
青魚屬大宗淡水性魚類, 肉厚且嫩, 味鮮美, 富含脂肪, 刺大而少, 是淡水魚中的上品。目前青魚的研究結果主要集中于養殖及繁育技術、營養需求等,而疾病學研究方面涉及較少, 已經明確的病害, 很多也是作為與其它大宗淡水魚類共有的疾病來研究,此次青魚的病害事件表明, 類志賀鄰單胞菌對青魚的危害極大, 無論幼魚、成魚都無法幸免, 一定程度上威脅著青魚養殖業的發展。本研究從具有典型臨床癥狀的發病青魚腎臟分離到菌株 HZ2015, 經過形態學和生理生化鑒定顯示該菌株為類志賀鄰單胞菌,同時通過16S rDNA序列同源性分析, 構建了系統發育樹, 發現與類志賀鄰單胞菌的同源性為 98.5%—99.9%。人工感染實驗表明其對青魚具有較強的致病性, 感染魚體表潰爛, 體內各器官不同程度損傷, 癥狀與自然發病魚類似, 并能從肌肉和腎臟中分離到與注射菌形態及生化特性完全相同的細菌, 生化鑒定及16S rDNA同源性匹配表明為同一菌株, 從而確定該菌株HZ2015為青魚體表潰爛的致病菌。本文系類志賀鄰單胞菌致青魚發病的首次報道。
類志賀鄰單胞菌是一種廣泛分布在淡水環境中的細菌, 隸屬腸桿菌科, 鄰單胞菌屬, 能引起人的腹瀉, 是一種重要的腸道致病菌(Brenneretal, 2005),對3536例急性腹瀉患者的研究表明(Chenetal, 2013),7.3%的細菌性病例與類志賀鄰單胞菌有關。類志賀鄰單胞菌對鸕鶿的感染率較高(Matsuyamaetal, 2015),對水生動物亦具有一定的致病力, 能引發暗紋東方鲀(Takifaguobscurus)、草魚(Ctenopharygodonidellus)、中華鱉(Trionyxsinensis)、黃顙魚(Pelteobagrus fulvidraco)、雜交鱘(Husohuso♀ ×Acipenserbaeri♂)、尼羅羅非魚(Tilapianilotica)、異育銀鯽(Carassius auratusgibelio♀ ×Cyprinuscarpio♂)、羅氏沼蝦(Macrobrachium rosenbergiideman)、斑點叉尾(Ietaluruspunetaus)、亞洲龍魚(Scleropages macrocephalus)、革胡子鲇(Clariasleather)、鰻鱺(Anguillajaponica)及虹鱒(Oncorhynchusmykiss)的發病及死亡(Milleretal, 1986; 吳惠仙等, 2004; 楊鳶劼等, 2005; 潘璠等, 2007; 陸文浩等, 2009; 陳林等,2009; Salgado-Mirandaetal, 2010; Junetal, 2011;Parvezetal, 2011; Johetal, 2012; Linghametal, 2012;王小亮等, 2013; 左躍等, 2013; 胡錢東等, 2014; 劉志剛等, 2015)。尤其是對草魚, 在夏秋季能引發類似癥狀即體表潰爛(胡錢東等, 2014), 由于兩者同屬鯉形目鯉科雅羅魚亞科, 分布與赤眼鱒一起同屬東亞的單元群, 親緣關系較近, 具有較強的借鑒意義。該菌是否容易引發雅羅魚亞科魚類的體表潰爛, 還需進一步研究。
類志賀鄰單胞菌在35—38°C溫度范圍內生長最佳(Lingham et al, 2012)。該菌對鹽度和酸堿度的適應范圍較廣, 能在多種水體中存活, 往往在水溫較高時流行。回歸實驗表明, 水溫在25°C時, 該菌不具備對青魚的致病性, 但水溫升高到 28°C 時, 對青魚具有極強的毒力。我們在調查中發現, 該菌引起的疾病主要發生在夏季高溫季節, 這一點與回歸實驗的結論相一致。因此, 應該尤其注重在高溫季節加強預防和控制, 合理控制飼料投喂, 改良底質和水質, 做好水體的消毒工作。
本研究分離得到的類志賀鄰單胞菌對頭孢哌酮、頭孢呋辛、慶大霉素、先鋒霉素、強力霉素等高度敏感; 對青霉素、氨芐西林、萬古霉素、羧芐西林和頭孢氨芐等耐藥。這與以往從不同物種中得到的分離株不一致(吳惠仙等, 2004; 陸文浩等, 2009; Matsuyama et al, 2015)。尤其是從人身上分離的菌株對除氨芐青霉素外的大多數抗菌藥物敏感(Chen et al, 2013)。這可能由于地區、環境不同及接觸的藥物不同, 導致菌株的耐藥譜存在差異。因此, 正確治療因該菌引發的青魚疾病, 還應在遵守《漁用藥物使用準則》的同時根據藥敏試驗得出的結果進行施藥, 避免根據經驗盲目用藥。
王小亮, 徐立蒲, 曹 歡等, 2013. 鱘致病性類志賀鄰單胞菌的鑒定及藥物敏感性. 微生物學報, 53(7): 723—729
左 躍, 易 弋, 夏 杰等, 2013. 2株黃顙魚源類志賀鄰單胞菌的分離與鑒定. 江蘇農業科學, 41(9): 199—201
劉志剛, 可小麗, 盧邁新等, 2015. 尼羅羅非魚致病性類志賀鄰單胞菌(Plesiomonas shigelloides)的分離鑒定及其病理學觀察. 微生物學報, 55(1): 96—106
楊鳶 劼 , 陳 輝, 方 蘋等, 2005. 工 廠化養殖暗紋東方 鲀 致病菌的分離和鑒定. 湛江海洋大學學報, 25(4): 18—21
吳惠仙, 薛俊增, 2004. 中華鱉出血性腸道壞死癥病原及其藥敏性. 中國獸醫學報, 24(4): 343—345
張 波, 曾令兵, 羅曉松等, 2010. 青魚腸道出血癥病原菌的分離與鑒定. 華中農業大學學報, 29(5): 607—612
陸文浩, 楊家新, 陳 輝等, 2009. 異育銀鯽類志賀鄰單胞菌的鑒定. 淡水漁業, 39(2): 48—53
陳 林, 譚愛萍, 鄒為民, 2009. 斑點叉尾致病菌株的鑒定及特性. 大連水產學院院報, 24(3): 200—205
胡錢東, 林 強, 石存斌等, 2014. 草魚致病性類志賀鄰單胞菌的分離與鑒定. 微生物學報, 54(2): 229—235
潘 璠, 方 蘋, 陳 輝, 2007. 羅氏沼蝦幾種病原菌防治藥物的篩選. 水產養殖, 28(6): 39—41
Brenner D J, Krieg N R, Staley J T, 2005. Bergey’s Manual of Systematic Bacteriology (Vol. 2): The Proteobacteria, Part B:The Gammaproteobacteria. New York, US: Springer,740—744
Chen X, Chen Y, Yang Q et al, 2013. Plesiomonas shigelloides infection in Southeast China. PLoS One, 8(11):e77877
Joh S J, Ahn E H, Lee H J et al, 2012. Bacterial pathogens and flora isolated from farm-cultured eels (Anguilla japonica)and their environmental waters in Korean eel farms.Veterinary Microbiology, 163(1—2): 190—195
Jun J W, Kim J H, Choresca Jr C H et al, 2011. Isolation and molecular detection of Plesiomonas shigelloides containing tetA gene from Asian arowana (Scleropages formosus) in a Korean aquarium. African Journal of Microbiology Research,5(28): 5019—5021
Li S F, Lu G Q, Zhou B Y, 1995. Evaluation on the potential capacity of the swan oxbow for the conservation of the major Chinese carps. Aquaculture, 137(1—4): 46—47
Lingham T, Besong S, Ozbay G et al, 2012. Antimicrobial activity of vinegar on bacterial species isolated from retail and local channel catfish (Ictalurus punctatus). Journal of Food Processing & Technology, 4(S11): S11-001
Matsuyama R, Kuninaga N, Morimoto T et al, 2015. Isolation and antimicrobial susceptibility of Plesiomonas shigelloides from great cormorants (Phalacrocorax carbo hanedae) in Gifu and Shiga Prefectures, Japan. Journal of Veterinary Medical Science, 77(9): 1179—1181
Miller M L, Koburger J A, 1986. Tolerance of Plesiomonas shigelloides to pH, Sodium chloride and temperature.Journal of Food Protection, 49(11): 877—879
Parvez N, Rathore G, Swaminathan T R et al, 2011. Isolation and characterization of bacteria associated with ulcerative disease of the fish, Clarias gariepinus. Bulletin of Pure &Applied Sciences-Zoology, 30(2): 85—92
Salgado-Miranda C, Palomares E, Jurado M et al, 2010. Isolation and distribution of bacterial flora in farmed rainbow trout from Mexico. Journal of Aquatic Animal Health, 22(4):244—247
Wang H R, Hu Y H, Zhang W W et al, 2009. Construction of an attenuated Pseudomonas fluorescens strain and evaluation of its potential as a cross-protective vaccine. Vaccine, 27(30):4047—4055

