化學探究實驗與教學實際的有機結合
諸葛強 劉成坤
從近年來教學調研情況看,有些教師對探究實驗教學產生了倦怠情緒,進行探究實驗教學的熱情漸漸冷淡了,一方面是有些教師認為適合探究實驗的素材太貧乏,很難選題,另一方面是有些教師認為探究實驗教學占用課時不說,既麻煩又沒有多少實用價值,對學生的學習尤其是考試成績作用不大。那么,怎樣才能引起教師的足夠重視呢?實踐證明,把探究實驗與教學實際有機結合起來,可使探究實驗在教學實際的良好環境中孕育產生并茁壯成長,進而使探究實驗教學充滿旺盛的生命活力。
一、探究實驗與概念理論教學實際相結合
化學概念的建立和鞏固以及化學原理的應用和熟習,在探究實驗中體現得淋漓盡致。
案例1 探究原電池電流強度的影響因素
學生在《化學》(選修4)《化學反應原理》中學完原電池原理后,已初步具備了自行設計和改進原電池的能力,該課題是基于以上前提繼續從定性研究提升到準定量研究而設計和實施的。提供的儀器用品:教師預先準備好的實驗模具(見圖1,玻璃片大小各一片,提示:大的用作載玻片,小的用作壓板)、濾紙、金屬片(鋅、鐵、銅,規格1×4cm,各兩片)、碳棒、靈敏電流計、導線、硫酸銅溶液濃稀各一瓶(0.1mol·L-1、0.033 mol·L-1)、盛有稀高錳酸鉀溶液的滴瓶、盛有蒸餾水的洗瓶、小燒杯、玻璃棒、膠頭滴管(附標簽)、鑷子、砂紙、直尺等。首先通過小組協作選擇合適儀器和藥品組裝一個微型原電池,測其電流并對所得數據及時記錄。然后交流,并匯報實驗現象和數據,發現小組間電流數據有差異(發現問題),教師適時提出問題:哪些因素可能影響電流大小?——探究原電池電流強度的影響因素(確定課題)。每個小組選擇一個或兩個研究方向進行探究,例如:兩極材料、兩極間距、電解質種類、電解質溶液的濃度等等。并將實驗研究的方向、方案的設計、實驗現象、數據和結論逐一匯報,全體學生討論評價并匯總結論,整個過程中教師注意觀察和調控,并適時評價和引導。

學生在不斷的“猜想假設→實驗→反思修正→再實驗”中綜合使用了變量控制、對比實驗等實驗思路和方法,大大提升了學生的綜合實驗素養,體會了科學探究實驗的一般過程和方法,學會了反思和評價,加深了學生對電池工作原理的認識和應用,有利于教學中重難點知識的再認識和再升華,又適度從準定量角度對影響電池效率的幾個因素進行了簡要分析、驗證、評價和總結,為后續了解常見化學電源以及對電池優劣的判斷和改進埋下了伏筆,一舉多得。
探究實驗與概念理論的教學實際相結合的優秀案例還有不少。例如可以在學完水溶液中的離子平衡之后再對離子反應發生的條件進行綜合的實驗探究;學完硝酸和硫酸之后可以進行氧化性影響因素的探究,主要集中在濃度、溫度、酸堿性等角度;再如有關鹽橋或離子交換膜的電化學裝置的探究實驗等等。
二、探究實驗與元素化合物教學實際相結合
探索實驗與元素化合物性質的教學相結合的案例選材非常廣泛。
案例2 過氧化鈉與水反應實驗的再探究
過氧化鈉與水反應是高一階段的一個重要實驗,在此基礎上進行適當的舊知延伸,對該反應進行再探究,一方面能夠鞏固學生對過氧化鈉性質的掌握,另一方面還能加強他們變量控制、反思評價、尊重客觀事實的科學探究方法和素養。
課題的引入:先讓學生回顧并書寫過氧化鈉與水反應的化學方程式。然后教師演示實驗,向盛有250mL水的大燒杯中加入約32g的過氧化鈉粉末,發現立即有大量的氣體生成并放出大量的熱。然后取少量溶液于試管中滴加2滴酚酞后溶液突然出現了紅色,但很快又消失了。
課題的確立:向Na2O2與水反應的溶液中滴加酚酞后紅色褪去的原因。
學生分組討論紅色褪去的原因,并提出了如下猜想。猜想1:有可能是產物O2的氧化性使溶液褪色;猜想2:有可能是反應產生的熱量導致溫度升高,使紅色褪去;猜想3:有可能是熱量和產物O2共同作用的結果。教師根據學生上述猜想,演示如下兩個實驗。
教師演示實驗1:從大燒杯中再取1~2mL反應后的溶液于試管中,用水浸泡使其冷卻至室溫,再滴加酚酞并觀察。實驗發現仍然是先變紅后褪色。
教師演示實驗2:取約10mL 0.01mol·L-1
NaOH溶液中滴入4滴酚酞,溶液變紅,將其再分為四等份,其中一份只通入氧氣(事先準備好用雙氧水和二氧化錳制備氧氣的裝置),第二份只加熱,第三份加熱后,再通入氧氣,第四份作參照。觀察到的實驗結果是均不褪色。

通過上述實驗,學生得出結論:褪色的原因與反應放熱以及產物氧氣均無關。教師順勢引導:說明我們之前的猜想并不全面,反思一下還有沒有其他的可能原因呢?學生自發討論起來,提出猜想4:“Na2O2與水反應可能產生了具有漂白性的其他物質。”此時,教師適時點撥學生:你們知道哪些物質具有漂白性?并讓他們結合物質的元素組成預測出H2O2。
教師演示實驗3:向實驗2中的第四份溶液中滴加少量雙氧水,發現紅色褪去。結論:H2O2有漂白性,可使滴加酚酞變紅的氫氧化鈉溶液褪色。
Na2O2與水反應后的溶液中究竟有沒有H2O2生成呢?學生分組討論并設計實驗方案。
學生實驗:從大燒杯中取出約3~5mL溶液于大試管中,將大試管放在試管架上,然后向其中加入半匙二氧化錳,立即發現有氣體產生,并將準備好的帶火星的木條伸入到試管中央發現復燃。驗證了猜想4。
教師引導學生進一步理論分析,類比復分解反應,嘗試著書寫出反應Na2O2+2H2O=2NaOH+H2O2,認識到過氧化鈉與水的反應方程式:2Na2O2+2H2O =4NaOH+O2不夠完善,過程中同時還發生了反應:Na2O2+2H2O=2NaOH+H2O2,過氧化鈉與水反應放出的熱量使部分H2O2分解,有氧氣產生其實是兩步反應的總結果,而部分未分解的H2O2具有漂白作用。
等到大試管中不再冒氣泡時,教師要求學生將大試管中的混合物倒入過濾器中過濾,并用小燒杯取濾液。然后讓學生思考已經除去H2O2的濾液滴加酚酞后實驗現象又會如何?學生普遍認為變紅之后不會再褪色,教師組織學生動手實驗:從小燒杯中取1~2mL濾液于試管中,滴加2滴酚酞,振蕩,觀察,結果發現仍然先變紅后褪色,學生驚訝了,問題又出現了:這次褪色的原因又是什么?通過分析,學生把問題的焦點集中在產物NaOH及其濃度上了,此時教師再次引導學生進行理論分析,計算出總反應后的濾液中NaOH的濃度約為3.2mol·L-1,然后學生根據提供的藥品,設計并實施了對比實驗:各取1mL的0.01mol·L-1NaOH與3mol·L-1NaOH溶液,分別滴加2滴酚酞,振蕩,觀察,實驗發現3mol·L-1NaOH溶液滴加酚酞后先變紅又褪為無色,而0.01mol ·L-1NaOH溶液則變紅后一直不褪色。初步結論是酚酞在稀堿性溶液中才能穩定地顯示紅色,而在濃堿性溶液中會先變紅后褪色,這個結論令學生吃驚不小。結合前面的實驗,學生最終認識到:向Na2O2與水反應的溶液中滴加酚酞,一是由于反應分步進行,過程中有H2O2產生,二是由于產物NaOH的濃度太大,最終使酚酞先變紅后褪色。
最后教師再讓學生反思探究過程中自己存在哪些優點和不足,為今后科學探究的提高和完善增力發熱。
實際上,探究實驗與元素化合物性質的教學相結合的案例選材既可以從教材內容中尋找,又可以從生產生活中尋找,還可以從高考熱點中尋找。例如:氯水成分及其性質的探究、鋁鹽或鐵鹽的性質及應用探究、補鐵劑中鐵元素價態的確定及含量的測定、鐵及其化合物氧化性和還原性的探究、不同價態硫元素間的轉化、亞硝酸鹽的性質探究等等。值得注意的是,這些案例在探究的內容、深度、廣度方面往往具有階段性,望讀者注意挖掘它們在高中教材不同階段的教學功能。
三、探究實驗與化學實驗教學實際相結合
化學是一門以實驗為基礎的自然學科,探究實驗與化學實驗的教學實際相結合的案例最為常見,其中對教材實驗的改進或是進一步深入探究的案例在實際教學中很受教師們的歡迎。
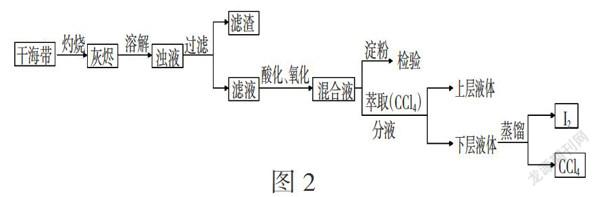
案例3 海帶中碘元素的分離及檢驗
海帶提碘的實驗涉及很多的實驗儀器和基本實驗操作,這些基本操作主要有:灼燒、溶解、過濾、萃取、分液、蒸餾等,幾乎涵蓋了整個中學化學中的基本操作。這也是人教版教材把它編排在必修2最后一章的一個重要原因。我們采用任務驅動式,對海帶提碘進行了探究(需注意:灼燒時需用到乙醇,且氣味很大,因此教師事先準備好海帶灰;另外,蒸餾碘的CCl4溶液太耗時且分離效果也不佳,一節課45分鐘進行不完,學生也只需回顧這部分操作的儀器和操作要點即可)。
任務一:討論并總結完善教材中“從原料干海帶檢驗并獲取單質碘”的實驗流程。(結果參見圖2)
任務二:已知海帶中碘元素的存在形式為:99.2%水溶性碘、10.3%有機碘、1.4%IO3-(注:這不是碘元素的百分含量);經灼燒灰化后,再將海帶灰用熱水充分浸取并過濾,濾液中碘元素的主要存在形式為I-。教材中特別強調海帶在灼燒之前不能用水沖洗,如果將海帶用水浸泡一段時間究竟會怎樣?請根據提供的試劑和幾小片干海帶,設計并實施實驗獲取實驗結果。
當學生完成任務二后,認識到用清水浸泡海帶后會損失大量碘,生活中長時間用水浸泡海帶是不明智的,更可貴的是學生認識到教材中關于驗證海帶中存在碘元素的實驗太過于靠后,其實也可以優化為將海帶用水浸泡后再實驗檢驗之。
任務三:為何不直接蒸餾碘水?利用“萃取→分液→蒸餾”對你有何啟發?
師生總結:1.能直接用于分離或提純的方法,往往是借助于某些物理性質有明顯的差異;2.用其他物理方法將它們的物理性質差異拉大,或用化學方法將它們轉化為物理性質相差較大的物質,相當于降低了分離或提純的難度,從而間接方便地分離或提純;3.若有多種方法,則需選擇簡單、經濟、易行、環保的。在總結之后,教師適當拓展延伸,引出“用反萃法分離碘的四氯化碳溶液”(見圖3),優化了前面圖2的實驗流程。
課堂的最后一個環節,提出任務四:除了反萃法外,你能想到更好的方法回收四氯化碳嗎?聯系活性炭的吸附色素以及沙石的凈水機理,請設計實驗方案。
任務四的目的是讓學生對實驗改進提出其他更好的建議。最后教師展示圖4,然后將各小組獲得的碘的四氯化碳溶液用圖4中的裝置集中處理,回收四氯化碳。
隨后學生進行探究討論、設計實驗、分組實驗、優化實驗。過程中教師巡視、指導學生實驗,并及時糾正學生的錯誤操作,一節課學生既鍛煉了基本的實驗操作能力,又得出了從物質中提取元素的一般思路:確定元素的存在形式→尋找轉化方案→確定實驗方案→優化實驗方案→分組實驗→得出結論。
四、探究實驗與復習課的教學實際相結合
實踐證明,復習課中引入探究實驗,既鞏固了舊知,還能適當將所學知識網絡化,側重于知識應用和挖掘新知。這樣的案例實施起來往往事半功倍。
案例4 關于某些離子的檢驗探究
在高三復習離子反應、離子共存和離子檢驗的時候,可以借用像人教版《高中化學(必修1)》教材第43頁第11題“現在有NaOH、Na2CO3和Ba(OH)2三種無色溶液,選用一種試劑把它們鑒別出來,并寫出反應的化學方程式和離子方程式”這一類的試題,我們可以把它設計成一個探究實驗。首先讓學生設計實驗方案,然后從中選擇快速簡便的方法,進行實驗驗證。人教版這個題有點特殊性的是一旦碳酸鈉和氫氧化鋇中任何一種被鑒別出來后,另一種即可被鑒別。除了硫酸、硫酸鈉等試劑,更有意思的是一些學生的答案中出現了鋁鹽(其他學生則由此聯想到鐵鹽、銅鹽等),而針對氯化鋁、硫酸鋁或明礬等是否可行時產生了討論的小高潮,一方面是用量或滴加順序的討論,另一方面涉及了雙水解反應現象(鋁離子與碳酸根離子)的討論。教師結合學生的課堂表現,課后進行了及時反思:如果把這個題的限制條件“一種試劑”去掉,那么學生的探究舞臺將變得更為廣闊和有趣。
不難發現,優秀的探究實驗課題以及教學的設計實例,都是緊密聯系了教學實際,適時提出值得探究的課題,讓學生運用已學知識和相關信息,結合探究實驗自主解決問題。高中化學探究實驗的素材相當豐富,它可以廣泛地生發于教材與實際教學體例中,但關鍵在于我們是否做到了認真研究與發掘。實踐證明,教學中適時開展的探究實驗教學,課堂氣氛活躍,學生學習的積極性和主動性顯著提升,學生對化學知識的理解和應用得到鞏固,教學效果顯著提高。特別是它還能持續地影響今后化學課堂的順利開展,極大地增強他們對化學學習的興趣和熱愛,更會對學生今后的學習、成長和生活產生深遠的影響。何樂而不為呢?

