布氏菌病活疫苗活菌計數項目能力驗證結果分析
王楠,李旭妮,于曉輝,徐磊,張媛,劉博,李建,毛開榮,蔣玉文
(中國獸醫藥品監察所,北京 100081)
布氏菌病活疫苗活菌計數項目能力驗證結果分析
王楠,李旭妮,于曉輝,徐磊,張媛,劉博,李建,毛開榮,蔣玉文*
(中國獸醫藥品監察所,北京 100081)
為了解全國布氏菌病活疫苗生產企業活菌計數能力,2015年對該項目進行了能力驗證分析,每名參比企業發放布氏菌活疫苗(S2株)樣品3份,要求在規定時間內對其進行活菌計數并提交結果報告。結果顯示,參比的17家企業中,15家結果“滿意”,2家企業結果“不滿意”,表明全國大部分布氏菌病活疫苗生產企業具備可信任的布氏菌病活疫苗活菌計數檢測能力。
布氏菌病活疫苗;活菌計數;能力驗證;結果分析
布氏菌病是一種嚴重威脅人類健康的動物源性人畜共患病,進入21世紀以來,布病疫情在我國快速反彈,防控形勢十分嚴峻。動物布氏菌病防治以預防為主,因此布氏菌病疫苗質量的優劣直接影響布氏菌病的防控效果。截至2012年,我國具有布氏菌病活疫苗生產文號的企業有14家,年產量超過2.5億頭份[1]。為了解全國布氏菌病活疫苗生產企業活菌計數能力,中國獸醫藥品監察所組織實施了布氏菌病疫苗生產企業活菌計數項目能力驗證。
1 材料與方法
1.1 測試樣品
1.1.1 樣品制備 委托生產企業制備布氏菌病活疫苗(S2株)240瓶,制備方法同《中華人民共和國獸用生物制品規程》[2]。樣品密封、粘貼標簽,于-18 ℃以下保存。
1.1.2 樣品均勻性檢驗 按照CNAS-GL03:2006《能力驗證樣品均勻性和穩定性評價指南》[3]要求進行。樣品均勻性檢驗按5%比例從樣品中隨機抽取12瓶,每個樣品分別在同一試驗條件下進行檢驗,重復兩次。
1.1.3 樣品穩定性檢驗 考慮到本測試樣品可能受溫度影響較大,所以,穩定性檢驗包括靜置狀態和郵寄狀態。
1.1.3.1 靜置狀態檢驗 樣品在-18 ℃以下保存的穩定性檢測:檢測周期為21 d,每隔7 d檢測一次,連續檢測3次,每次隨機檢測3瓶樣品。
1.1.3.2 郵寄狀態檢驗 選擇距離最遠的3個實驗室分別郵寄1份樣品,3瓶/份,實驗室收到樣品后反饋樣品狀態并原樣寄回,收到返回的郵寄樣品后立即開封檢測。
1.1.4 樣品發放 按照隨機抽取樣品的原則,采用隔熱泡沫塑料盒內置樣品3瓶和2個生物冰袋,最外層包裝為紙箱,由EMS快遞至各實驗室,同時將樣品狀態確認表、作業指導書和結果報告等文件隨樣品同時郵寄。
1.2 參加單位 報名參加單位包括具有布氏菌病活疫苗生產文號的獸用生物制品生產企業共計17家,各參加實驗室擁有唯一性代碼,結果統計中用唯一性代碼代替實驗室名稱,結果評價結束后發放能力驗證合格實驗室證書。
1.3 試驗方法 本次實驗室間比對采用《中國獸藥典》活菌計數的方法[4]。
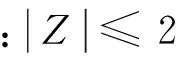
Z比分值計算公式:Z=(X-XM)/NormIQR,式中:Z為穩健比分值;X為檢驗數據;XM為中位值;NormIQR為標準化四分位距,NormIQR =0.7413×四分位間距(IQR)。
1.5 結果評價依據 本次能力驗證采用綜合評價方式,既重結果,也重過程。統計結果僅作為評價依據之一,評判依據還包括檢測思路是否清晰、報告填寫是否規范、原始記錄是否符合要求、檢測結果是否準確等。
2 結果與分析
2.1 樣品的均勻性檢驗 采用單因子方差分析法進行樣品均勻性檢驗,結果表明:計算得到F值=0.75,該值小于臨界值F0.05(11,12)=2.72,表明在0.05的顯著性水平下,該樣品是均勻的。
2.2 樣品的穩定性檢驗 采用t檢驗法統計分析樣品穩定性檢驗。靜置狀態檢驗結果表明:計算得到的t值=1.22,該值小于臨界值t0.05(5)=2.57,表明在0.05的顯著性水平下,該樣品在靜置狀態下,21 d內是穩定的。郵寄狀態檢驗結果表明:計算得到的t值=0.48,該值小于臨界值t0.05(5)=2.57,表明在0.05的顯著性水平下,該樣品在郵寄狀態下是穩定的。
2.3 檢驗結果及統計分析
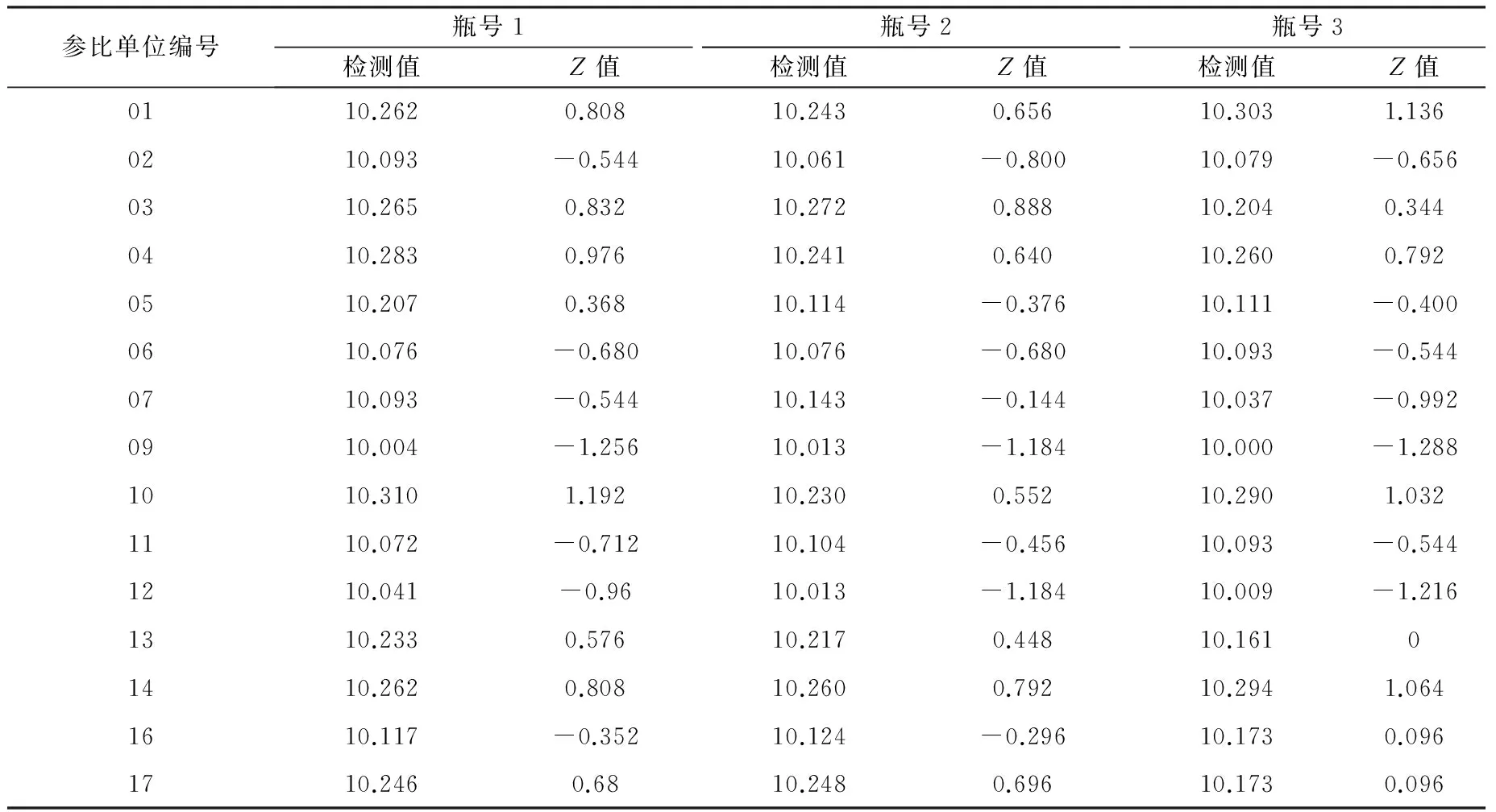
2.3.1 檢驗結果 各參比企業均能在規定的時間內按照《作業指導書》的檢驗要求,將能力驗證結果報告和原始檢驗記錄及時反饋,匯總17家參比企業的檢驗結果見表1。
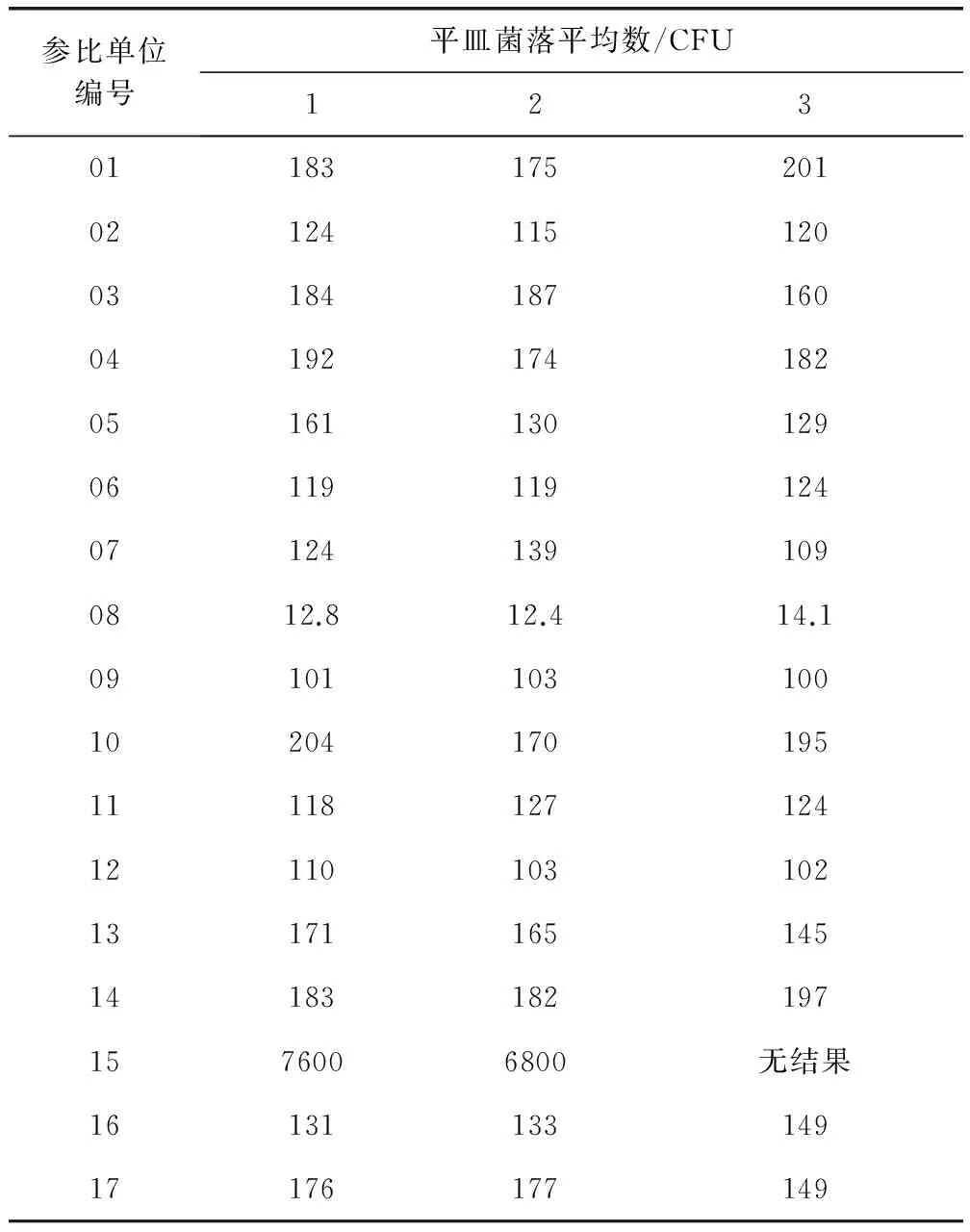
表1 參比單位檢驗結果匯總表
2.3.2 檢驗結果的參數及統計結果 結果統計處理參照CNAS-GL02:2014《能力驗證結果的統計處理和能力評價指南》[6],檢測結果中編號為08和15的參比單位平皿菌落平均數出現極端值(平皿菌落平均數大于200CFU或小于40 CFU),為了避免極端值對其他檢驗結果的統計分析產生影響,實際統計中將其剔除,其余15家參比單位給予的3瓶樣品的檢測結果均參與統計分析。根據Z比分數計算公式,統計參數值結果見表2,Z比分數統計結果見表3,各參比單位的Z比分數序列圖見圖1。結果表明,15家企業的ΙZΙ值均≤2,統計結果為“滿意”。
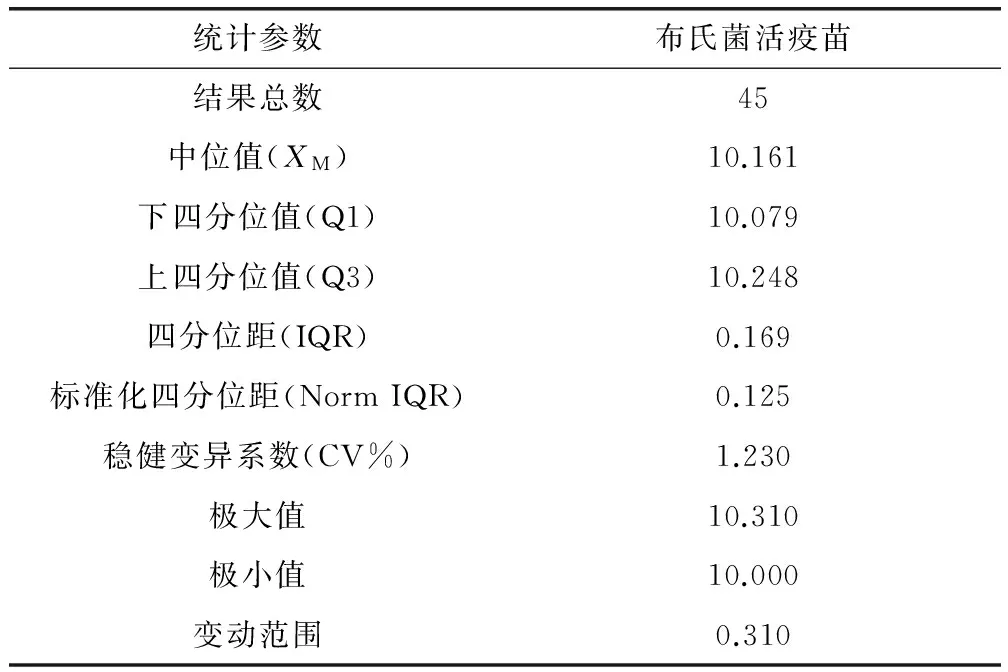
表2 參比單位檢驗結果穩健統計參數
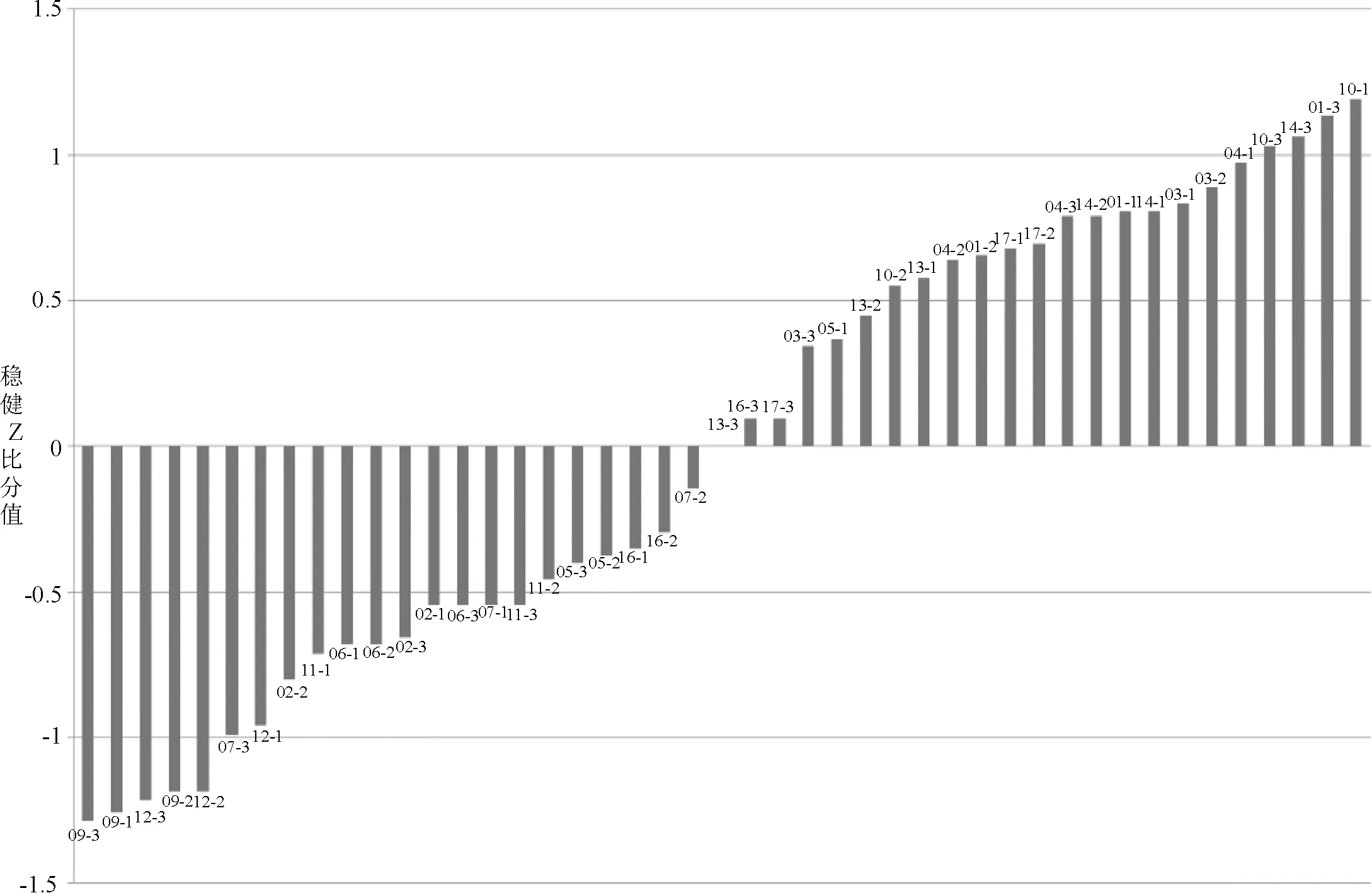
圖1 活菌計數結果Z比分數序列圖
參比單位編號瓶號1瓶號2瓶號3檢測值Z值檢測值Z值檢測值Z值0110.2620.80810.2430.65610.3031.1360210.093-0.54410.061-0.80010.079-0.6560310.2650.83210.2720.88810.2040.3440410.2830.97610.2410.64010.2600.7920510.2070.36810.114-0.37610.111-0.4000610.076-0.68010.076-0.68010.093-0.5440710.093-0.54410.143-0.14410.037-0.9920910.004-1.25610.013-1.18410.000-1.2881010.3101.19210.2300.55210.2901.0321110.072-0.71210.104-0.45610.093-0.5441210.041-0.9610.013-1.18410.009-1.2161310.2330.57610.2170.44810.16101410.2620.80810.2600.79210.2941.0641610.117-0.35210.124-0.29610.1730.0961710.2460.6810.2480.69610.1730.096
表中的“檢測值”為檢驗結果對數值
2.3.2 綜合評價結果 對原始檢驗記錄,檢驗報告和統計結果的進行綜合分析后認為:15/17家參比企業能夠按照《中國獸藥典》和《作業指導書》的規定完成檢驗,結果滿意。但是,仍發現存在的一些問題(表4),經過綜合評價后,15家企業在本次能力驗證中獲“滿意”結果,2家企業獲“不滿意”結果。
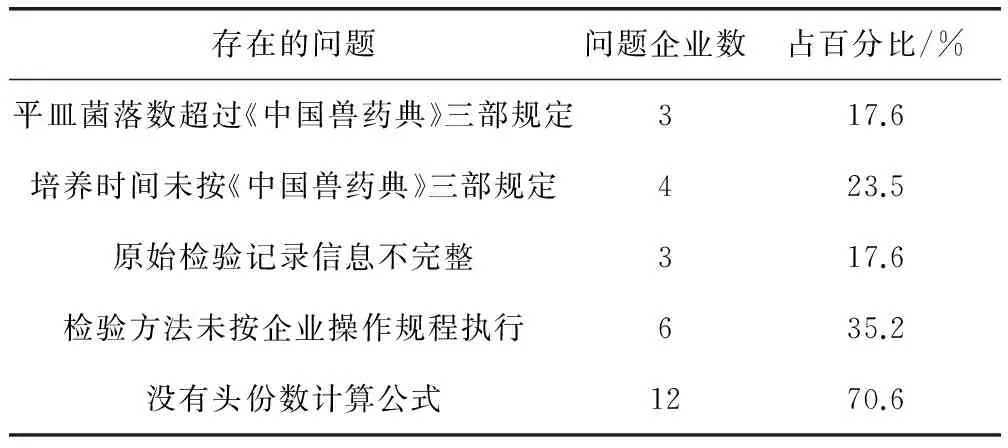
表4 綜合評價存在的問題匯總表
3 討論
本次能力驗證的樣品為活微生物,考慮到其特殊性質,樣品穩定性檢驗中增加郵寄狀態的穩定性檢驗。樣品郵寄正值夏季氣溫較高,三個地點的郵寄天數為3~5 d,郵寄過程中樣品的活菌數雖有一定下降,但是經過統計學分析,不同郵寄地點和郵寄天數的樣品檢測結果差異并不顯著,說明采用隔熱泡沫塑料盒內置樣品和生物冰袋,外層包裝為紙箱,由EMS快遞至各實驗室的方法可行。
本次能力驗證的結果評價采用綜合評價的方式,目的是在對結果數據進行科學統計分析的基礎上,全面考察企業布氏菌病活疫苗活菌計數項目的檢測能力。通過綜合評價的方式,我們發現布病活疫苗在活菌計數的質量控制過程中存在一些問題,例如①不能有效控制菌落計數的稀釋度。3/17(17.6%)家企業存在布病活疫苗活菌計數的平皿菌落數超過《中國獸藥典》規定(>200 CFU/個)導致單個平皿菌落數過多,無法計數。②未嚴格執行企業內部操作規程中規定的培養時間進行檢驗。由于布氏菌菌落特性是生長緩慢,培養時間應至少72 h以上否則無法用肉眼清晰辨認菌落,4/17(23.5%)家企業培養時間僅為48 h左右。③相關檢驗記錄不完整,檢驗信息無法溯源。如原始檢驗記錄中缺失培養基種類,名稱和批次、稀釋液種類和批次、稀釋過程等相關信息。又如,檢驗中發現6/17(35.2%)家企業檢驗報告中試驗步驟十分簡單,反映出檢驗人員在檢驗過程中未按照企業操作規程執行,或是企業制定操作規程不夠詳細。④原始檢驗報告中沒有明確注釋頭份數的計算過程和公式,頭份數的計算結果對于指導臨床用藥至關重要,如果頭份數計算偏大,疫苗無法達到免疫效果;反之,頭份數計算偏小,疫苗安全性存在隱患。本次能力驗證中發現,12/17(70.6%)家企業未能在原始檢驗報告中清晰注釋頭份數的計算過程和公式,如果頭份數結果錯誤,將無法確定是否由計算過程導致。由于不同企業和不同批次的半成品加入稀釋液的數量不同和稀釋的方法也不同,應將各種變量(平板菌落數的平均數、溶解液量、稀釋倍數和平皿滴加菌液量)代入頭份數計算公式,從而得出的布病活疫苗頭份數更為科學準確。由此可見,僅僅將活菌計數統計結果作為細菌活疫苗活菌計數能力驗證的評價依據尚不夠全面,需采用綜合評價的方式,客觀、具體的反映出企業檢驗能力和質量控制中存在的問題。如何制定更科學、合理的綜合評價方式,是我們今后組織能力驗證活動中需要進一步思考的問題。
[1] 王楠,程君生,丁家波,等.布氏菌病活疫苗的生產現狀與質量分析[J].中國獸藥雜志,2013,47(4): 49-50.
[2] 農業部獸用生物制品規程委員會.中華人民共和國獸用生物制品規程[M].化學工業出版社,2000: 157-158.
[3] 中國合格評定國家認可委員會.CNAS—GL03:2006能力驗證樣品均勻性和穩定性評價指南[S]. 2006.
[4] 中國獸藥典委員會.中華人民共和國獸藥典[M].中國農業出版社,2010:附錄19-20.[5] 張媛,張磊,李建,等.穩健統計方法及t檢驗法在活菌技術能力比對中的應用[J]. 中國獸藥雜志,2013,47(4): 19-20.
[6] 中國合格評定國家認可委員會.CNAS GL 02:2006能力驗證結果的統計處理和能力評價指南[S]. 2006.
(編輯:李文平)
Analysis of the Proficiency Testing of Live Bacteria Counting of Brucellosis Vaccine
WANG Nan, LI Xu-ni, YU Xiao-hui, XU Lei, ZHANG Yuan, LIU Bo,LI Jian, MAO Kai-rong, JIANG Yu-wen*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
In order to ensure the product quality of brucellosis vaccine, proficiency testing of brucellosis vaccine live bacteria counting has been organized by China Institution of Veterinary Drug Control,further investigate and compare the companies' testing capabilities. The samples of brucellosis vaccine have been sent to the companies, and then they should submit the test result paper within the given time. 17 national veterinary biologics companies have participated in the proficiency testing. Results of 15 companies were determined as satisfactory while results of the other 2 companies were determined as unsatisfactory after comprehensive evaluation. In conclusion, the result shows that most national manufacturers own trusted brucellosis vaccine testing capabilities.
brucellosis vaccine; live bacteria counting; proficiency test; result analysis
北京市科技新星計劃(Z141107001814013)
王楠,副研究員,從事人畜共患類獸用生物制品檢驗和研究工作。
蔣玉文。E-mail:jiangyuwen@ivdc.org.cn
2016-01-14
A
1002-1280 (2016) 05-0015-04
S855.12

