早產兒低血糖臨床干預閾值的探討
陳艷玲 李 薇 陳葵帶 王義烔 洪玉玲 李曼莎暨南大學醫學院附屬東莞醫院新生兒科,廣東東莞 523900
早產兒低血糖臨床干預閾值的探討
陳艷玲 李 薇▲陳葵帶 王義烔 洪玉玲 李曼莎暨南大學醫學院附屬東莞醫院新生兒科,廣東東莞 523900
目的探討早產兒低血糖的臨床干預閾值。方法早產兒共107例,入院后連續監測血清葡萄糖及振幅整合腦電圖(aEEG)6h。根據血糖水平分為4組,正常對照組:血糖維持在3.30~6.10mmol/L;Ⅰ組:監測期間至少一次血糖處于2.60~3.29mmol/L;Ⅱ組:至少一次血糖處于2.20~2.59mmol/L;Ⅲ組:至少一次血糖<2.20mmol/L。利用aEEG評分系統進行評分,將相應胎齡及校正胎齡早產兒總分的平均值減去原始分得校正后總分(ATS),以消除不同胎齡及校正胎齡所致差異,該值越大提示腦損傷越重。結果(1)Ⅰ、Ⅱ、Ⅲ組間低血糖持續時間比較,差異無統計學意義;(2)與對照組[(0.03±0.85)分]比較,Ⅱ組[(0.58±0.90)分]和Ⅲ組[(1.08±1.31)分] ATS較大,差異有統計學意義(P<0.05),而Ⅰ組[(0.07±0.87)分]與對照組差異無統計學意義;(3)與Ⅰ組比較,Ⅱ組和Ⅲ組的ATS較大,差異有統計學意義(P<0.05);(4)Ⅲ組的ATS比Ⅱ組大,組間差異無統計學意義(P>0.05)。結論可能引起腦功能受損的血糖閾值,即應考慮采取臨床干預的血糖閾值是<2.6mmol/L,無論是否伴有臨床癥狀。
早產兒;低血糖;干預閾值;振幅整合腦電圖;低血糖性腦損傷
低血糖癥(hypoglycemia)是早產兒常見的代謝性疾病,如未及時發現和處理,有可能導致低血糖性腦損傷(hypoglycemic brian injury,HBI),遺留癲癇、視力障礙、精神運動發育遲緩等后遺癥,應引起高度重視[1-2]。準確識別可能引起腦功能障礙的血糖水平,及時采取臨床干預措施,對預防HBI至關重要。現多主張不論胎齡和日齡,<2.2mmol/L診斷為低血糖癥,但該值并不能代表致大腦功能障礙的低血糖閾值。WHO目前推薦,不論是否伴有臨床癥狀,血清葡萄糖2.6mmol/L為足月兒和早產兒的低血糖干預閾值,但該值仍需更多的臨床研究證實或修正。
振 幅 整 合 腦 電 圖(amplitude integrated electroencephalogram,aEEG)是腦電連續記錄簡化形式,具有簡便、容易識別、可床旁動態監測等優點[3]。本研究對107例早產兒進行aEEG監測,參照Burdjalov等[4]創建的評分系統對aEEG圖形評分,探討較適宜的早產兒低血糖干預閾值。
1 資料與方法
1.1 一般資料
選擇2014年9月~2016年1月暨南大學醫學院附屬東莞醫院新生兒科收住的早產兒107例。入選標準:(1)日齡≤1d,外觀無畸形;(2)排除明顯圍產期缺氧病史,顱內出血,顱內感染,腦發育異常,敗血癥,先天性代謝性疾病及內分泌疾病者。所有研究均獲得本院醫學倫理委員會審核通過及患兒家屬的知情同意。
1.2 研究方法
1.2.1 血糖監測及處理 應用瑞士羅氏全自動生化分析儀檢測血清血糖。血糖的正常參考值為3.30~6.10mmol/L。血清血糖<2.6mmol/L即采取干預措施,包括喂哺母乳或配方奶、持續靜脈輸注葡萄糖液等;如血清血糖<2.2mmol/L,10min內靜脈緩慢推注10%葡萄糖液2mL/kg,然后按8mg/(kg·min)持續靜脈輸注。所有研究對象每h復測一次血糖至生后3h,如出現低血糖每0.5~1小時復測1次血糖,如血糖正常每2小時復測1次,共監測6h。
1.2.2 研究分組 根據入院后6h內監測的血清血糖分成4組。正常對照組(30例):監測期間血糖穩定在3.30~6.10mmol/L;Ⅰ組:監測期間至少一次血糖處于2.60~3.29mmol/L;Ⅱ組:監測期間至少一次血糖處于2.20~2.59mmol/L;Ⅲ組:監測期間至少一次血糖<2.20mmol/L。
1.2.3 aEEG的記錄 采用美國Nicolet-one腦功能監護儀。電極放置于雙側頂骨(相當于10/20國際電極安放法電極位置的P3、P4處,參考電極在距頭頂中央25mm額中線上),腦電信號以半對數形式記錄。所有研究對象于入院后即行aEEG描記6h。
1.2.4 aEEG圖形分析盲法判讀 參照早產兒aEEG評分系統[2]對各參數進行評分,求出總分,將相應胎齡及校正胎齡早產兒總分的平均值減去原始分得校正后總分(ATS),以消除不同胎齡及校正胎齡所致差異。ATS越大,提示aEEG異常程度越明顯。
1.3 統計學方法
應用SPSS 19.0軟件進行分析。計量資料以(x±s)表示,經方差齊性分析后,組間比較采用t檢驗;計數資料以百分比表示,采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組一般情況比較
4組早產兒在胎齡、性別、出生體重等方面比較,差異均無統計學意義(P>0.05),具有可比性。Ⅰ、Ⅱ、Ⅲ組間低血糖持續時間比較,差異無統計學意義(P>0.05)。見表1。
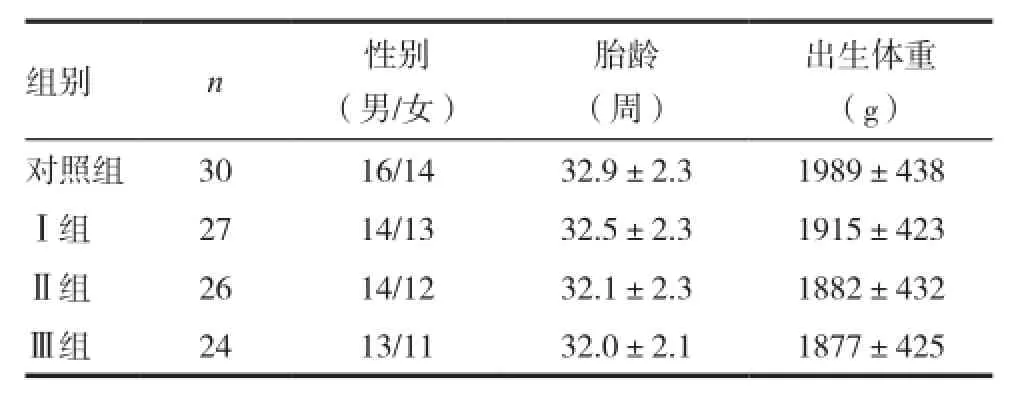
表1 4組新生兒的臨床資料比較
2.2 各組aEEG圖形的ATS比較
四組aEEG圖形的ATS比較,F=6.322,P<0.05,具有統計學意義。對照組與Ⅰ組間差異無統計學意義(t=-0.178,P>0.05),而Ⅱ組、Ⅲ組的ATS均高于對照組,差異有統計學意義(t= -2.319,-3.384,P<0.05)。Ⅱ組、Ⅲ組的ATS均高于Ⅰ組,差異有統計學意義(t=-2.061,-3.185,P<0.05), Ⅲ組的ATS比Ⅱ組高,差異無統計學意義(t=-1.574,P>0.05)。見表2、3。
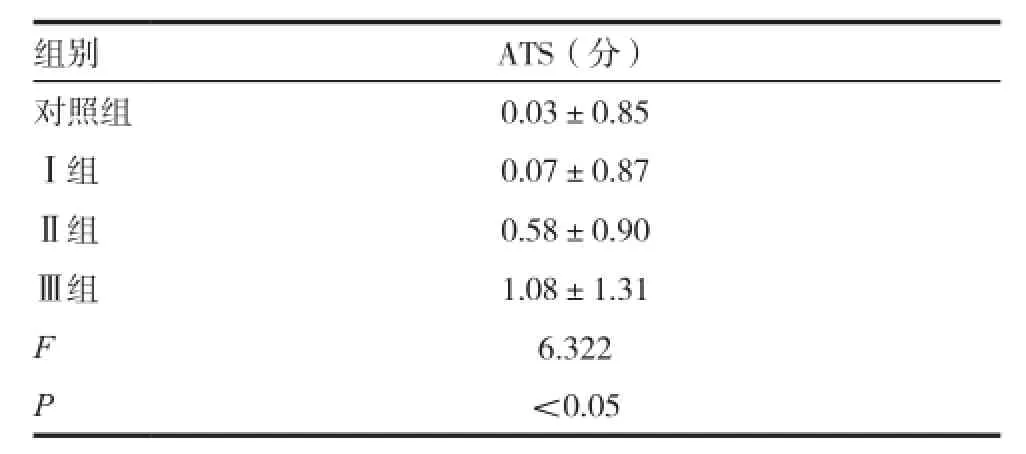
表2 4組新生兒ATS分值
3 討論
低血糖的臨床干預閾值(operational thresholds)[5],即臨床工作者需考慮采取臨床干預的血糖水平尚無統一定論。干預閾值應選取可能引起腦功能障礙的血糖值,無論是否伴有臨床癥狀。常用研究途徑主要包括檢測腦血流[4]、內分泌激素[6]、感官誘發電位[7]、頭顱影像學(MRI、DWI等)[8]、NBNA評分[9]等。綜合以往研究,WHO推薦血漿血糖2.6mmol/L為足月兒和早產兒的低血糖干預閾值,無論是否伴有臨床癥狀,該值仍需更多的臨床研究以證實或更新。廖景文等[10]通過比較128例新生兒閃光視覺誘發電位主波潛伏期變化,提出引起腦功能障礙的血糖閾值是<2.6mmol/L。本研究采用aEEG檢測腦功能改變,以探索引起腦功能障礙的血糖范圍,用于指導臨床工作。郭志梅等[11]報道,aEEG在診斷低血糖腦損傷與MRI一致,aEEG異常可出現在低血糖發生當天,較MRI能更早發現腦損傷并可動態監測。祝偉等[12]報道,低血糖腦損傷新生兒的腦電生理功能異常程度與臨床預后密切相關,腦電生理功能測定能直觀、準確地反映神經損傷狀態,利于臨床預后早期評估。
aEEG的主要參數包括背景活動的連續性(cuntinuity)、睡眠覺醒周期(sleep-wake cycling,SWC)、下邊界振幅(amplitude of lower border)、波譜帶寬度(bandwidth)及癲癇樣電活動。SWC反映了較高級中樞神經系統的功能,它的出現和穩定是新生兒腦功能狀態良好的重要表現;SWC的逐步恢復也提示受損腦功能的逐步恢復[13]。Burdjalov等[4]綜合以往的研究資料創建了一個aEEG評分系統,綜合各參數的變化,并對其進行量化。據報道,該評分系統客觀反映新生兒不同的腦電活動,有助于對腦損傷患兒aEEG圖形進行客觀評價,便于不同患兒間aEEG圖形的比較和同一患兒不同時間點的比較[14]。
本研究參照該評分系統,對不同血糖范圍早產兒的aEEG圖形進行分析。Ⅰ、Ⅱ、Ⅲ組間低血糖持續時間比較,差異無統計學意義,可排除低血糖持續時間不同對結果的干擾。研究結果提示,血糖<2.6mmol/L即可能出現aEEG異常,即血糖<2.6mmol/L可能引起腦細胞功能障礙,且血糖越低,對腦的損害越大。
對所有新生兒采取同一個干預閾值是不盡合理的,因為低血糖是否引起腦損傷及其嚴重程度還需考慮患兒本身是否同時合并早產、圍產期缺氧缺血、感染等諸多病理因素[15-19]。綜上,臨床工作者應將血糖<2.6mmol/L作為臨床干預的參考值,同時需結合實踐靈活調整。
[1]龔華,孫玲.新生兒低血糖發生情況及其影響因素分析[J].中國婦幼保健,2014,29(20):3268-3269.
[2]Adamkin DH.Postnatal glucose homeostasis in late-preterm and term infants[J].Pediatrics,2011,l27(3):575-579.
[3]劉芳.振幅整合腦電圖監測新生兒腦功能的評價[J].中國實用兒科雜志,2006,21(11):875-877.
[4]Burdjalov VF,Baumgart S,Spitzer AR.Cerebral function monitoring: A new scoring system for the evaluation of brain maturation in neonates[J].Pediatrics,2003,112(4):855-861.
[5]Cornblath M,Hawdon JM,Williams AF,et al.Controversies regarding definition of neonatal hypoglycemia: Suggested operational thresholds[J].Pediatrics,2000,105(5):1141-1145.
[6]Van De Ven KC,De Galan BE,Van Der Graaf M,et al.Effect of acute hypoglycemia on human cerebral glucose metabolism measured by 13C magnetic resonance spectroscopy[J].Diabetes,2011,60(5):1467-1473.
[7]Koh TH,Aynsley-Green A,Tarbit M,et al.Neural dysfunction during hypoglycaemia[J].Arch Dis Child,1988,63(11):1353-1358.
[8]關文華,孫新峰,史展,等.新生兒低血糖腦損傷早期DWI表現與臨床相關因素分析[J].中國婦幼保健,2015,30(28):4882-4884.
[9]尤金英,梁志明,李建國,等.新生兒低血糖腦損傷的預后觀察[J].中國婦幼保健,2014,29(30):4943-4945.
[10]廖景文.新生兒低血糖臨床干預閾值探討[J].中國小兒急救醫學,2012,19(1):64-66.
[11]郭志梅,劉芳,周春風,等.新生兒低血糖腦損傷振幅整合腦電圖特征研究[J].臨床兒科雜志,2013(11):1019-1023.
[12]祝偉,張成云.新生兒低血糖腦損傷時腦電生理功能改變與臨床預后的關系[J].中國婦幼保健,2014,29(8):1201-1203.
[13]劉曉燕,吳遜.臨床腦電圖學[M].北京:人民衛生出版社,2006:541-575.
[14]程國強,施億赟,邵肖梅,等.振幅整合腦電圖評分系統評價新生兒腦發育的臨床價值[J].中華圍產醫學雜志,2012,15(4):234-237.
[15]周彩玲,林丹,郟麗娜,等.新生兒低血糖的臨床表現及高危因素分析[J].中國現代醫生,2016,54(8):53-56.
[16]趙惠琴.新生兒低血糖的病因分析與治療體會[J].現代診斷與治療,2015,26(12):2806-2807.
[17]黃笑群,翁志媛,宋敏.家長參與式技能訓練對新生兒低血糖腦損傷預后的影響[J].現代醫院,2015,15(5):155-156.
[18]田瑾 ,劉艷云.美國新生兒低血糖管理指南在基層醫院臨床應用的可行性和必要性[J]. 中外醫學研究,2016,14(14):31-32.
[19]霍潔玲.妊娠期糖代謝異常孕婦產程中血糖水平管理與新生兒低血糖的關系研究[J].現代診斷與治療,2015,26(7):1545-1546.
Clinical intervention threshold of premature hypoglycemia
CHEN Yanling LI Wei CHEN Kuidai WANG Yitong HONG Yuling LI Mansha Department of Neonatology, Ji'nan University Medical College Affiniated Dongguan Hospital, Dongguan 523900,China
ObjectiveTo search clinical intervention threshold of premature hypoglycemia.MethodsSerum glucose and continuous aEEG was monitored for 6h immediately after admission.107 premature infants in our hospital were divided into 4 groups: normal control group (serum glucose ranged 3.30~ 6.10mmol/L during monitoring),groupⅠ (serum glucose ranged 2.60~ 3.29mmol/L at least once during monitoring), groupⅡ (serum glucose ranged 2.2~ 2.59mmol/L at least once during monitoring), group Ⅲ (serum glucose <2.2mmol/L at least once during monitoring). aEEG recordings scoring system were used to record continuity, sleep-waking cycle, degree of voltage amplitude depression and bandwidth. All variables were summed to yield a total score. The total scores were correlated with gestational and postconceptional ages, called adjusted total score(ATS). Higher ATS suggests severer brain injury.ResultsThere were no significant differences in duration of hypoglycemia between group Ⅰ, group Ⅱand group Ⅲ(P>0.05). The ATS in group Ⅱ(0.58±0.90 points) and group Ⅲ (1.08±1.31points) were significantly higher than that in groupⅠ (0.07±0.87points) and the normal control group (0.03±0.85 points) respectively(P< 0.05), and there were no significant differences in group I as compared with the normal control group. The ATS in group Ⅲ were higher than that in group Ⅱ(P<0.05).ConclusionWhether the premature has any clinical manifestations or not, it appears that the threshold of serum glucose for clinical intervention of neonatal hypoglycemia is less than 2.6mmol/L.
Hypoglycemia; Premature; Intervention threshold; Amplitude integrated electroencephalogram;Hypogly cemic brian injury
R722
B
2095-0616(2016)22-45-03
2016-09-05)
廣東省東莞市醫療衛生科技計劃(2014105101249 )。
▲通訊作者

