瘤內無水乙醇注射聯合高頻熱療治療原發性肝細胞癌的療效分析*
劉 佳,周 麟,田 清,白 健,程印蓉,崔西振,戴宗耀,段 萍△
(1.成都市第一人民醫院腫瘤一科,成都610041;2.四川大學華西醫院胸部腫瘤科,成都610041;3.成都市第一人民醫院超聲科,成都610041)
瘤內無水乙醇注射聯合高頻熱療治療原發性肝細胞癌的療效分析*
劉 佳1,周 麟2,田 清1,白 健1,程印蓉3,崔西振3,戴宗耀3,段 萍1△
(1.成都市第一人民醫院腫瘤一科,成都610041;2.四川大學華西醫院胸部腫瘤科,成都610041;3.成都市第一人民醫院超聲科,成都610041)
目的:回顧性分析瘤內無水酒精注射聯合體外高頻熱療治療原發性肝細胞癌的療效及毒副反應。方法:納入經確診的瘤灶最大徑≤5cm、總數≤3個且無肝外病灶的原發性肝細胞癌患者42例。各病灶行B超引導下無水酒精注射共3~4次(1次/周),注射后隔日行局部高頻熱療1小時,溫度41℃~43℃。結果:全組中位隨訪時間32個月,療后AFP下降率為95.2%、總客觀緩解率為61.9%、中位無疾病進展生存期34個月、中位生存期40個月。肝內單發病灶較2~3個病灶的患者有生存優勢(P<0.05)。全組治療后1度及2度肝功能損傷發生率為42.8%,1度及2度疼痛為38%,1度發熱為31%。結論:該聯合方案對治療瘤灶最大徑≤5cm、總數≤3個且無肝外病灶的原發性肝細胞癌的療效較好且毒副反應較小。
原發性肝細胞癌;無水酒精注射;高頻熱療
原發性肝細胞癌(hepatocellular carcinoma,HCC)是我國的高發瘤種之一,其惡性程度高、起病隱匿、進展快、預后差。早期腫瘤負荷較小的HCC以手術切除及肝移植治療為主,局部晚期不能手術或有遠處轉移患者可以選擇局部消融治療、肝動脈栓塞化療、放療及索拉非尼治療[1]。局部消融治療是臨床治療HCC的常用治療方式,主要包括射頻消融、微波消融、冷凍消融及經皮無水乙醇注射(percutaneous ethonal injection,PEI)等,其中PEI臨床應用時間長,操作相對簡單,技術成熟、副作用較小,治療費用相對較低。PEI單獨應用可治療病灶最大徑≤3cm、病灶總數≤3個的HCC患者,聯合其它局部治療手段對病灶最大徑3~5cm的中等大小乃至5~7cm的巨塊型HCC的患者也可達到較為理想的療效[2-4]。此外,研究顯示聯合治療較單用PEI為患者帶來的生存獲益更大[5-7]。
體外高頻熱療為熱療方式的一種,高頻熱療與放療及化療有協同作用,可在一定程度上提高放化療療效[8-9]。此外,亦有較多臨床報道顯示其與其它局部治療聯合可有效提高不能手術HCC的療效[9-10]。但目前尚無文獻報道單純PEI聯合高頻熱療治療HCC的療效及毒副反應,本文就我科收治HCC患者接受該聯合治療后的相關數據進行了回顧性總結及分析。
1 資料與方法
1.1 臨床資料
納入2011年1月至2014年12月于我院經影像學、血清AFP及病理檢查確診為HCC的初治患者42例,肝臟總瘤灶數63個。患者肝內至少有一個可評價病灶,且無肝外病灶,瘤灶總數≤3個;經外科醫師會診明確無手術指征,或其明確拒絕手術治療。患者ECOG PS評分皆≤2分,皆有血清AFP升高,瘤灶最大徑皆≤5cm,詳見表1。本研究經過醫院倫理委員會討論通過,并征得所有入組患者同意。

表1 42例HCC患者的基線特征[n(%)]
1.2 治療方法
患者基線檢查完成后限期行PEI治療,選用21~22G PTC針頭,于B超引導下經皮穿刺,插入腫瘤深面,緩慢注入無水乙醇,并旋轉針頭逐漸退至腫瘤淺面,同時觀察無水乙醇瘤灶內的彌散程度,每次注入的無水乙醇量(ml)為瘤灶最大徑(cm)的3~5倍。各瘤灶共行PEI 3~4次(1次/周)。PEI后隔日行肝臟局部高頻熱療1小時,熱療溫度為41℃~43℃,采用HG-2000體外高頻熱療儀(和佳,珠海),微波頻率13.56MHz,熱穿透深度25cm。患者接受聯合治療后,每周檢查其癥狀、體征,并復查血常規、肝腎功及血清AFP,評價治療毒副反應,其后每月復查上腹部增強CT明確肝臟病灶退縮情況,每3月行系統檢查明確有無遠處轉移病灶,評價療效。
1.3 治療效果評價
客觀療效評價依據實體瘤療效評價標準(response evaluation criteria in solid tumors,RECIST v1.1)。客觀緩解率(objective response rate,ORR)定義為療后完全緩解(complete response,CR)例數+部分緩解(partial response,PR)例數/總治療例數,無進展生存期(progression free survival,PFS)定義為治療開始至肝內/肝外腫瘤進展或患者死亡,總生存期(overall survival,OS)定義為治療開始至患者死亡。毒副反應評價依據不良事件通用術語標準(national cancer institute-common terminology criteria for adverse events,NCI-CTC AE 4.0)。
1.4 統計學方法
單因素生存分析采用Kaplan-Meier,各臨床因素間比較采用Log-rank,單因素分析中有統計學意義的因素納入多因素分析,多因素生存分析采用Cox regression,P<0.05認為差異有統計學意義。統計軟件采用Spss 22.0軟件包。
2 結 果
2.1 療 效
截至2016年6月,隨訪時間為9~48個月(中位32個月)。全組患者無一例達CR,其近期療效為:AFP下降率(治療后AFP較基線下降)為95.2%(40/42)、PR 61.9%(26/42)、疾病穩定(stable disease,SD)38.1%(16/42)、總ORR為61.9%(26/42);其中瘤灶≤3cm的患者,AFP下降率為100%(20/20)、PR 95%(19/20)、SD 5%(1/20)、ORR為95%(19/20),瘤灶>3cm且≤5cm的患者,AFP下降率為90.9%(20/22)、PR 31.8%(7/22)、SD 68.2%(15/22)、ORR為31.8%(7/22);全組有75%(12/16)的SD患者其瘤灶有所縮小,其中瘤灶≤3cm的患者為100%(1/1),瘤灶>3cm且≤5cm的患者為73.3%(11/15)。全組患者中位PFS 34個月(95%CI:26.3~41.7個月),其1年、2年、3年的PFS分別為73.7%、50.6%、43.4%;中位OS 40個月(95%CI:31.5~48.5個月),其1年、2年、3年的生存率分別為76.2%、73.4%、67.6%。單因素分析中年齡≥60歲、Ⅲ期、Child-Pugh B級、>1個瘤灶、瘤灶最大徑>3cm為預后不良因素,多因素分析中>1個瘤灶為預后不良因素(表2)。截至隨訪結束,全組有28例出現腫瘤進展,其首發進展部位85.7%(24/28)為肝內新發病灶,10.7%(3/28)為肝內原發病灶進展,3.6%(1/28)為出現肝外轉移病灶。
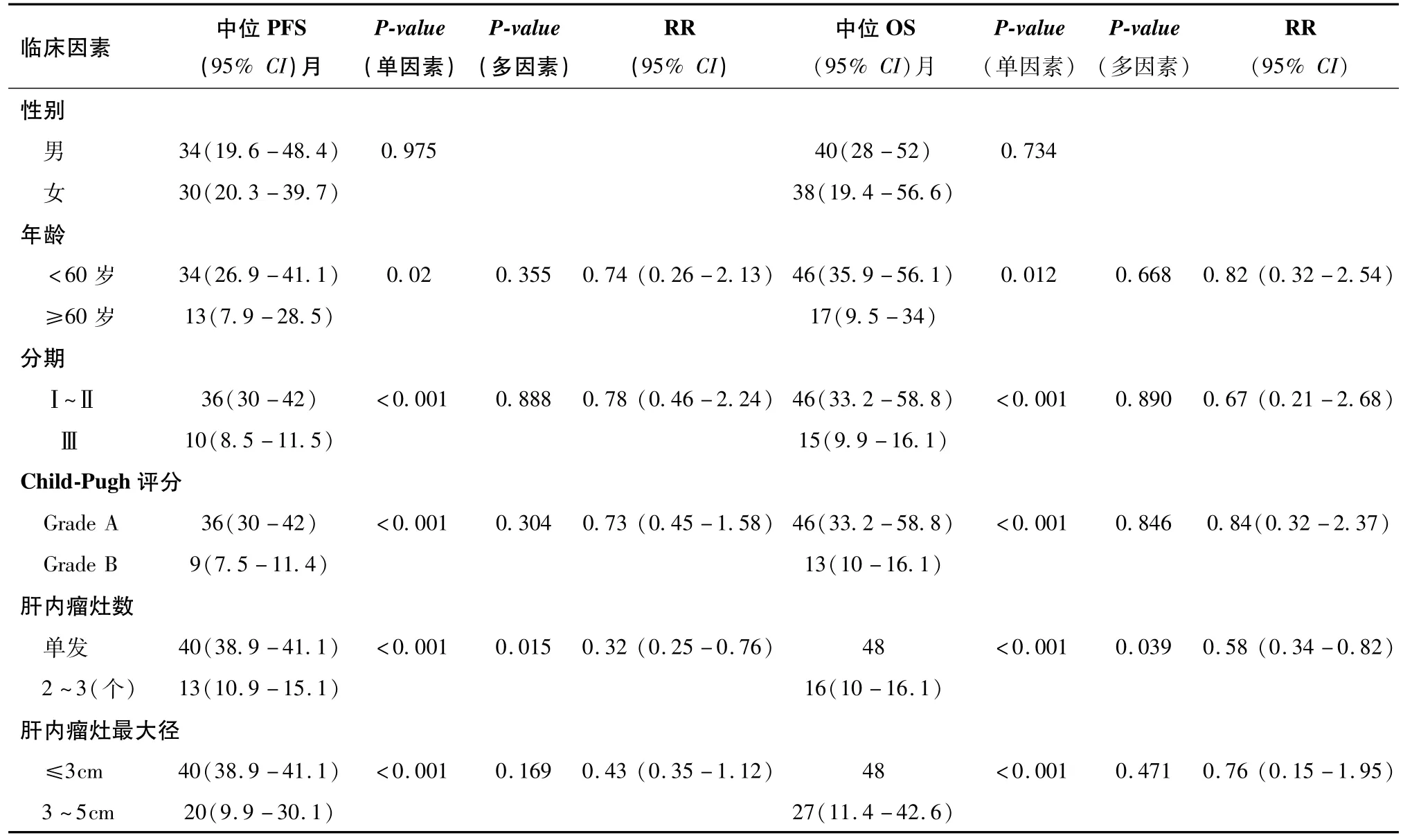
表2 42例HCC患者的生存分析
2.2 毒副作用
全組患者治療后,無3~4度毒副作用發生,其它毒副反應見表3。
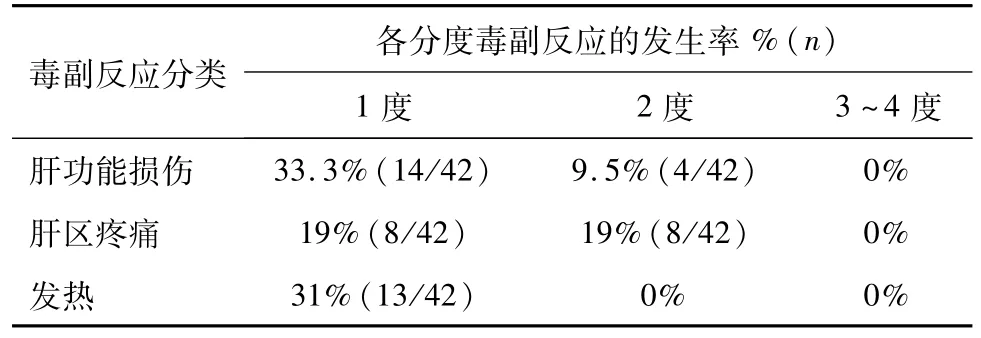
表3 42例HCC患者治療毒副反應
3 討 論
PEI在臨床上應用已超過了30年,其操作簡單,相對安全,并可重復施治。高滲的無水乙醇注入腫瘤后,可導致腫瘤細胞脫水、細胞結構蛋白的變性,腫瘤血管床小血管血栓形成、血流阻斷,最終導致腫瘤壞死。PEI療程通常為4~6周,每周1~2次,瘤灶數≤3個且瘤灶最大徑≤3cm,或單個瘤灶且瘤灶最大徑≤5cm的患者療效較好。本研究納入患者其瘤灶最大徑≤5cm,且瘤灶數≤3個,與其它PEI相關研究類似[11-12]。
熱療可應用于多種實體瘤治療中,根據其加熱范圍可分為局部熱療、區域性熱療及全身熱療,根據加熱方式可分為高頻加熱、微波加熱、激光及高強度超聲聚焦加熱等。熱療可以通過增加腫瘤細胞抗原表達,促進免疫細胞的激活及遷移,釋放白細胞趨化因子,增強免疫細胞的細胞毒性,從而強化機體針對腫瘤的免疫反應[13-15]。此外,熱療還可以抑制腫瘤導致的VEGF表達,從而抑制血管內皮細胞增殖及細胞外基質重塑,起到抗血管生成的作用[16]。臨床上,熱療多與放化療聯合用于腫瘤治療,臨床前及臨床研究皆證實熱療聯合放療、化療及介入治療治療HCC可取的較好療效[17-19]。中等強度的熱療是臨床聯合治療中最常用的熱療方式,研究證實溫度控制在41℃~45℃時,機體免疫反應激活最為明顯[20]。本研究采用局部高頻熱療方式,技術成熟、操作簡單、費用較低,同時將熱療溫度控制于41℃~43℃,以期帶來最大的治療增敏及免疫效應。此外,本研究中患者先行PEI治療,再行熱療,主要也是期望PEI后造成肝臟局部腫瘤壞死,腫瘤抗原釋放,激發機體免疫反應,而后的熱療進一步將免疫效應增強,從而帶來更好的療效。
文獻報道PEI對小肝癌近期療效理想,對于≤2cm的腫瘤ORR為90%~100%、2~3cm的腫瘤ORR達70%、3~5cm的腫瘤ORR為50%[21]。本研究中瘤灶直徑≤3cm的患者,其ORR為95%,優于其它文獻報道;瘤灶直徑>3cm且≤5cm的患者,其ORR為31.8%,但73.3%的SD患者瘤灶有縮小,總體與文獻報道相似。此外,PEI治療肝內單個≤2cm瘤灶患者,其3年的PFS為50%,雖然本研究中42.9%的患者為多發瘤灶,52.4%的患者瘤灶直徑≥3cm,其總體中位PFS仍達到34個月,3年PFS為43.4%,與文獻報道相近,提示了聯合治療在一定程度上提高了整體療效。PEI后患者的主要復發模式為肝內復發,本研究中96.4%(27/28)的患者首次復發出現在肝內,且大多為肝內的新發病灶,與文獻報道一致。此外,本研究中超過1個瘤灶是患者的預后不良因素,而理論上此類患者肝內同時伴有隱匿病灶的可能性也更大。以上數據提示,PEI聯合熱療對瘤灶本身的控制較為理想,但如何有效殺滅潛在的隱匿病灶仍是進一步提高HCC療效的關鍵所在。
綜上所述,PEI聯合高頻熱療治療瘤灶最大徑≤5cm且瘤灶總數≤3個、無肝外病灶的HCC患者療效較好且毒副反應較小,并顯示出較單用PEI療效更佳的趨勢,但該研究結果仍需前瞻性臨床研究加以證實,同時也需相應的基礎研究進一步探索其潛在機制及聯合應用的最佳時序等問題。
作者聲明:本文第一作者對于研究和撰寫的論文出現的不端行為承擔相應責任。
利益沖突:本文全部作者均認同文章無相關利益沖突。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
[1] 謝佳杭,王久惠.索拉菲尼聯合TACE治療進展期原發性肝癌療效及并發癥分析[J].腫瘤預防與治療,2015,28(3):152-154.
[2] Shi F,Tan Z,An H,et al.Hepatocellular carcinoma</=4 cm treated with radiofrequency ablation with or without percutaneous ethanol injection[J].Ann Hepatol,2016,15(1):61-70.
[3] Huang G,Lin M,Xie X,et al.Combined radiofrequency ablation and ethanol injection with a multipronged needle for the treatment of medium and large hepatocellular carcinoma[J].Eur Radiol,2014,24(7):1565-1571.
[4] 張永紅.CT引導下經皮肝穿刺無水乙醇注射聯合肝動脈化療栓塞術治療巨塊型肝癌的臨床療效研究[J].中國全科醫學,2012,15(20):2345-2346.
[5] Li Z,Zhang K,Lin SM,et al.Radiofrequency ablation combined with percutaneous ethanol injection for hepatocellular carcinoma:a systematic review and meta-analysis[J].Int J Hyperthermia,2016,32(1):1-10.
[6] Fu Y,Zhao X,Yun Q,et al.Transarterial chemoembolization(TACE)plus percutaneous ethanol injection(PEI)for the treatment of unresectable hepatocellular carcinoma:ameta-analysis of randomized controlled trials[J].Int J Clin Exp Med,2015,8(7):10388-10400.
[7] Huang H,Liang P,Yu XL,et al.Safety assessment and therapeutic efficacy of percutaneous microwave ablation therapy combined with percutaneous ethanol injection for hepatocellular carcinoma adjacent to the gallbladder[J].Int J Hyperthermia,2015,31(1):40-47.
[8] 劉海波,曹 明,胡大勇,等.熱療聯合FOLFOX4方案治療晚期原發性肝癌的臨床觀察[J].臨床與病理雜志,2016,36(3):247-251.
[9] 吳友義,董曉霞,吳麗麗,等.調強放射治療聯合局部熱療治療中晚期肝細胞肝癌的隨機對照研究[J].重慶醫學,2016,45(19):2671-2673.
[10]李 征,米登海,楊克虎,等.介入化療栓塞術聯合熱療治療原發性肝癌的Meta分析[J].中國循證醫學雜志,2012,12(6):672-678.
[11]Yang B,Zan RY,Wang SY,et al.Radiofrequency ablation versus percutaneous ethanol injection for hepatocellular carcinoma:a meta-analysis of randomized controlled trials[J].World J Surg Oncol,2015,13(1):1-11.
[12]Weis S,Franke A,Berg T,et al.Percutaneous ethanol injection or percutaneous acetic acid injection for early hepatocellular carcinoma[J].Cochrane Database Syst Rev,2015,1(3):CD006745.
[13]Peer AJ,Grimm MJ,Zynda ER,et al.Diverse immune mechanisms may contribute to the survival benefit seen in cancer patients receiving hyperthermia[J].Immunol Res,2010,46(1):137-154.
[14]Ahmed K,Tabuchi Y,Kondo T.Hyperthermia:an effective strategy to induce apoptosis in cancer cells[J].Apoptosis,2015,20(11):1411-1419.
[15]Qin S,Xu C,Li S,et al.Hyperthermia induces apoptosis by targeting Survivin in esophageal cancer[J].Oncol Rep,2015,34(5):2656-2664.
[16]Sawaji Y,Sato T,Takeuchi A,et al.Anti-angiogenic action of hyperthermia by suppressing gene expression and production oftumour-derived vascular endothelial growth factor in vivo and in vitro[J].Br JCancer,2002,86(10):1597-1603.
[17]康靜波,趙向飛,聶 青,等.立體定向放療聯合熱療及索拉非尼治療復發及轉移性肝癌的療效分析[J].中國腫瘤臨床,2013,40(20):1236-1239.
[18]Dong Y,Wu G.Analysis of short and long term therapeutic effects of radiofrequency hyperthermia combined with conformal radiotherapy in hepatocellular carcinoma[J].JBuon,2016,21(2):407-411.
[19]Yu JI,Park HC,Oh D,et al.Combination treatment of trans-arterial chemo-embolisation,radiotherapy and hyperthermia(CERT)for hepatocellular carcinoma with portal vein tumour thrombosis:Interim analysis of prospective phase Ⅱ trial[J].Int J Hyperthermia,2016,32(3):331-338.
[20]Calderwood SK,Ciocca DR.Heat shock proteins:stress proteins with Janus-like properties in cancer[J].Int J Hyperthermia,2008,24(1):31-39.
[21]Islam MN,Saha MM,Ahsan M,et al.Percutaneous ethanol injection for ablation of hepatocellular carcinoma[J].Bang Med J,2010,43(1):12-17.
Efficacy and Toxicities of Percutaneous Ethonal Injection Combined w ith Local High-Frequency Hyperthermia for Hepatocellular Carcinoma*
Liu Jia1,Zhou Lin2,Tian Qing1,et al
(1.Department of Oncology,the First People's Hospital of Chengdu,Chengdu 610041,Sichuan,China;2.Department of Thoracic Oncology,Cancer Center,West China Hospital,Sichuan University,Chengdu 610041,Sichuan,China)
Objective:To retrospective analyze efficacy and toxicities of combined therapy of percutaneous ethonal injection(PEI)and local high-frequency hyperthermia for hepatocellular carcinoma.Methods:Forty-two hepatocellular carcinoma(≤5cm)patients with≤3 lesions and no lesions outside of the liver were enrolled.Ultrasound-guided PEI was carried out for every lesion in the liver(once a week,totally 3 to 4 times),and local high-frequency hyperthermia was carried out one day after(41℃-43℃for one hour).Results:The median follow-up time was 32 months.After the combined therapy,The AFP level declined in 95.2%of patients,the objective response rate was61.9%,the median progression-free survival was34 months,and the median overall survival was 40 months.Patients with single liver lesion had better survival than with>1 liver lesions(P<0.05).The incidence of grade 1 and 2 liver dysfunction was42.8%,grade 1 and 2 hepatalgia was 38%,and grade 1 fever was 31%.Conclusion:The combined therapy of PEI and local high-frequency hyperthermia is effective and safe treatment for hepatocellular carcinoma.
Hepatocellular Carcinoma;Percutaneous Ethonal Injection;High-Frequency Hyperthermia
R735.7;R730.58
A
10.3969/j.issn.1674-0904.2016.06.004
2016-09-22
2016-12-04
*四川省衛生廳科研課題(編號:100048)
劉佳(1979-),女,自貢人,主治醫師,主要從事腫瘤綜合治療研究。
△段萍,E-mail:zrzct@163.com

