結核感染T細胞斑點試驗對結核病治療效果的監測價值
何紫琪,李從榮
(武漢大學人民醫院檢驗科,湖北 武漢 430060)
結核感染T細胞斑點試驗對結核病治療效果的監測價值
何紫琪,李從榮
(武漢大學人民醫院檢驗科,湖北 武漢 430060)
目的 探討結核感染T細胞斑點試驗對結核病治療療效的監測意義。方法本研究采用T-SPOT.TB試劑盒,檢測T細胞中γ-干擾素對結核分支桿菌特異性多肽類早期分泌性抗原靶標6-kD(ESAT-6)和培養濾液蛋白(CFP-10)的應答,對比113例結核感染者治療前與治療后T-SPOT.TB結果的變化,其結果根據對該試驗中兩種抗原的聯合與各自應答來分析。結果113例感染者在治療后T-SPOT.TB結果轉陰者有42例(37.2%)。其中,CFP-10轉陰率占48.9%(P<0.001),ESAT-6轉陰率占20.0%(P=0.238)。ESAT-6的斑點形成細胞(SFCs)/2.5×105外周血單核細胞(PBMCs)的平均數在治療前和治療后分別為18.47和16.29(P=0.16),而CFP-10的SFCs/PBMCs的平均數在治療前和治療后分別為22.83和15.31(P<0.01)。結論結核病治療對于T細胞中γ-干擾素引起的ESAT-6和CFP-10抗原應答影響不同,CFP-10的定量應答才是結核病治療的更有效監測手段。
結核感染T細胞斑點試驗;早期分泌性抗原靶標6-kD蛋白;培養濾液蛋白CFP-10;結核病治療
在有沉重結核病負擔的國家,對結核感染者進行及時的鑒別診斷和治療是一種重要的結核病控制和消除手段[1-2]。目前除了觀察接受治療患者的疾病進展,尚無試驗來確定結核病治療效果。
近來,市售的商品化T-SPOT.TB試劑盒通過酶聯免疫斑點技術可將單個被激活的結核分支桿菌特異性T細胞顯現出來。試驗過程中過夜孵育使經結核分支桿菌抗原刺激的效應T細胞激活,若效應T細胞數量隨治療過程中分支桿菌抗原量下降而下降,那么測量分支桿菌特異性抗原應答的T細胞數即對于判定治療的有效性有重要意義[3]。本研究即通過T-SPOT.TB試驗來評價其在結核病治療中的監測價值。
1 資料與方法
1.1 一般資料 選擇2010年1月至2015年12月來我院行T-SPOT.TB檢查的患者909例,其中325例患者T-SPOT.TB試驗結果陽性。325例患者中238例為我院住院患者并最終確診為結核菌感染,其中肺結核212例,骨結核18例,結核性腦膜炎3例,腸結核5例,其余患者為隱匿性結核菌感染者。剔除經≥6個月治療后未回我院進行復診并再次行T-SPOT.TB試驗的患者,剩余113例患者納入本次研究。
1.2 T-SPOT.TB試驗 采用上海復星長征醫學科學有限公司提供的試劑盒,嚴格按照說明書操作。結果判讀:空白對照孔斑點數為0~5個時且(抗原A或抗原B孔的斑點數)-(空白對照孔斑點數)≥6,判斷為陽性;空白對照孔斑點數為6~10個時且(抗原A或抗原B孔的斑點數)≥2×(空白對照孔斑點數),判斷為陽性;上述標準不符合且陽性質控對照孔正常時檢測結果為“無反應性”。
1.3 統計學方法 數據處理采用SPSS 17.0軟件,散點圖作圖采用GraphPad Prism 5軟件。組間比例差異的比較采用χ2檢驗,配對比例差異的比較采用McNemar檢驗,配對資料平均數的比較采用Man-Whitney U檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 113例患者治療前與治療后的T-SPOT.TB結果 治療前,113例T-SPOT.TB陽性患者中ESAT-6陽性者60例(53.1%);CFP-10陽性者90例(79.6%)。其中,僅ESAT-6陽性者23例(20.1%),僅CFP-10陽性者53例(46.9%),二者均陽性者37例(32.7%)。治療后,T-SPOT.TB轉陰者42例(37.2%)。剩余71例治療后仍為陽性的患者中有22例(30.9%)僅為ESAT-6陽性,有17例(23.9%)僅CFP-10陽性,有32例(45.1%)二者均陽性(如圖1)。治療前,患者ESAT-6的SFCs/2.5×105PBMCs計數為0~84,平均值為18.47;治療后,患者ESAT-6的SFCs/PBMCs計數為0~120,平均值為16.29。治療前與治療后均值經Mann-Whitney檢驗比較,P=0.158 9。治療前,患者CFP-10的SFCs/2.5×105PBMCs計數為0~192,平均值為22.83;治療后,患者CFP-10的SFCs/PBMCs計數為0~158,平均值為15.31。治療前與治療后均值經Mann-Whitney檢驗比較,差異有統計學意義P<0.01(如圖2)。
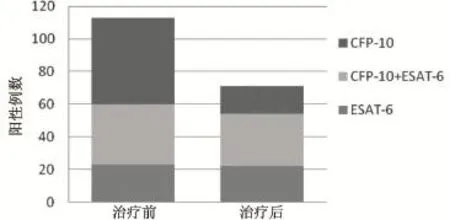
圖1 治療前與治療后ESAT-6、CFP-10陽性例數示意圖
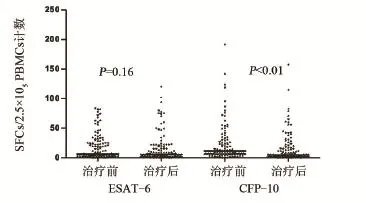
圖2 治療前與治療后ESAT-6、CFP-10的SFCs/PBMCs數比較
2.2 113例患者治療前與治療后ESAT-6、CFP-10計數 在23例治療前僅ESAT-6陽性的患者中有6例(26.09%)治療后轉陰;在53例治療前僅CFP-10陽性的患者中有35例(66.04%)治療后轉陰;在37例治療前二者均為陽性的患者中有4例(10.8%)治療后均轉陰,2例(5.4%)僅ESAT-6轉陰,5例(13.5%)僅CFP-10轉陰,見表1、表2。治療前,ESAT-6陽性與陰性患者所占比例分別為53.1%與46.9%;CFP-10陽性與陰性患者所占比例分別為79.65%與20.35%。治療后,ESAT-6陽性與陰性患者所占比例分別為47.79%與52.2%;CFP-10陽性與陰性患者所占比例分別為43.36%與56.64%。經配對比例差異McNemar檢驗,治療前與治療后患者對ESAT-6應答比例差異無統計學意義(P=0.238),而對CFP-10應答比例差異有顯著統計學意義(P<0.01)。

表1 治療前與治療后患者對ESAT-6應答數(例)

表2 治療前與治療后患者對CFP-10應答數(例)
2.3 113例患者治療前與治療后對ESAT-6和CFP-10應答的變化趨勢 由于此斑點計數是人工判讀,結果無法精確的再現,因此將計數±5SFCs/ PBMCs內的斑點數劃分為“不變”。在治療前與治療后患者對ESAT-6應答的降低、不變、上升的比例分別為48.67%、12.39%和38.94%;對CFP-10應答的降低、不變、上升的比例分別為67.26%、6.19%和26.55%,見表3。二者經組間比例差異比較的χ2檢驗,得出P= 0.008,表明ESAT-6和CFP-10的應答數在經治療后降低、不變與上升的比例差異有統計學意義,其中患者對ESAT-6應答下降的比例低于CFP-10,而不變與上升的比例均高于CFP-10。
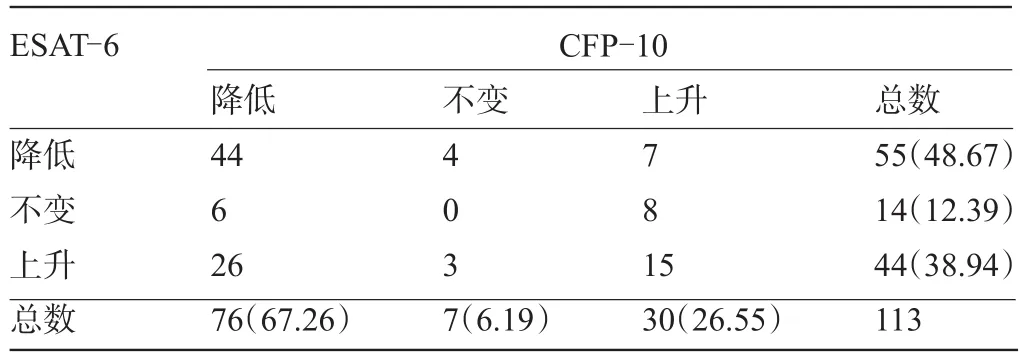
表3 治療前與治療后對ESAT-6和CFP-10應答變化(例)
3 討論
結核分支桿菌抗原特異性γ干擾素釋放試驗(IGRAs)是近來結核分支桿菌感染診斷領域的一項重要進展[4-5],它所檢測的是T細胞中γ-干擾素對結核分支桿菌特異性多肽的應答而產生的早期分泌性抗原ESAT-6和培養濾液蛋白CFP-10。這些抗原是由存在于所有結核分支桿菌的1號基因組差異區域編碼,而非結核分支桿菌和BCG疫苗菌株不含該區域,因此該抗原具有結核分支桿菌高度特異性。我們認為,效應T細胞的數量隨著治療過程中分支桿菌抗原量(即細菌載量)的降低而下降,那么抗原計數的變化即能反映治療的情況[6]。
本研究我們采用T-SPOT.TB試劑盒,對比113例感染者在治療前與經治療好轉后其ESAT-6和CFP-10抗原應答數量上的差異。對于ESAT-6抗原而言,治療前患者陽性率為53.10%,治療后陽性率為47.79%,該下降率差異無統計學意義(P>0.05);但對于CFP-10抗原而言,治療前患者陽性率為80.1%,治療后陽性率下降為43.36%,差異有統計學意義(P<0.05)。從抗原應答顯示的斑點數來看,治療前ESAT-6的平均值為18.47,治療后下降至16.29,差異無統計學意義(P>0.05);而CFP-10治療前平均斑點數為22.83,治療后下降至15.31,差異有統計學意義(P<0.05)。因考慮到斑點計數較為主觀,斑點結果無法準確再現,研究中將斑點變化在5以內劃分為“不變”,使用此方法,我們發現,67.26%的患者在治療后CFP-10斑點數下降,而51.3%的患者在治療后斑點數仍不變甚至上升(P<0.05)。這些數據表明,結核治療使CFP-10抗原應答有顯著的下降和轉化,但對ESAT-6抗原卻無此效應。
目前已發表的關于結核治療對T細胞對結核分支桿菌特異性抗原應答影響的縱向研究不多,研究對象也較少。Nicol等[7]研究團隊的一項關于兒童的報道顯示:T細胞對于ESAT-6的應答早期升高,在3個月后下降。一項由Aiken等[8]完成的89例患者研究中顯示:ESAT-6和CFP-10的計數在治療12個月后下降。Ewer等[9]報道:在接受3個月的異煙肼和利福平治療后,38例患者在6個月后對ESAT-6和CFP-10的應答增加。這些學者所持的觀點與我們的研究不盡相同,可能與研究對象數量和治療時間長短等因素有關。且我們的研究存在一定的局限性:患者服藥是自主執行,因此服藥的依從性無法完全保證;此外,我們對于未經治療的患者也無法跟蹤作T細胞應答監測。但有來源于其他調查的數據顯示:在無任何治療干預的情況下,陽性T-SPOT.TB應答仍保持不變[9]。
T-SPOT.TB這項新興的外周血檢測試驗有望最終取代沿用百年的結核菌素試驗(TST)[10-11],目前國內外已有許多關于該檢測方法的報道,肯定了其在結核病診斷中的價值,在英美等發達國家,IGRAs已被列入了結核病的診斷指南,其主要用于輔助篩查兒童中的無癥狀感染者,HIV感染者合并結核感染的診斷以及結核潛伏感染的流行病學調查[12-13]。本研究則從治療監測的角度,探討了它在反映結核治療中的應用價值,結果表明,該試驗的兩種抗原中CFP-10的數量變化是結核治療更好的一項監測手段。更多關于此試驗在結核治療過程中的作用研究還在持續進行,一項結核病治愈的替代標志物或疾病進展的風險因素有望產生。
[1]Zhang L,Zhang Y,Shi X,et al.Utility of T-cell interferon-gamma release assays for diagnosing tuberculous serositis:a prospective study in Beijing,China[J].PLoS One,2014,9(1):85030.
[2]Bathoorn E,Limburg A,Bouvman JJ,et al.Diagnostic potential of an enzyme-linked immunospot assay in tuberculous pericarditis[J].Clin Vaccine Immunol,2011,18(5):874-877.
[3]Chiappini E,Fossi F,Bonsignori F,et al.Utility of interferon-gamma release assay results to monitor anti-tubercular treatment in adults and children[J].Clin Ther,2012,34(5):1041-1048.
[4]Denkinger CM,Dheda K,Pai M.Guidelines on interferon-γ release assays for tuberculosis infection:concordance,discordance or confusion[J].Clin Microbiol Infect,2011,17(6):806-814.
[5]Ahmad S.New approaches in the diagnosis and treatment of latent tuberculosis infection[J].Respir Res,2010,11:169.
[6]Chee CB,KhinMar KW,Gan SH,et al.Tuberculosis treatment effect on T-cell interferon-gamma responses to mycobacterium tuberculosis-specific antigens[J].Eur Respir J,2010,36(2):355-361.
[7]Nicol M,Pienaar D,Wood K,et al.Enzyme-linked immunospot assay responses to ESAT-6,CFP-10 and purified protein derivative among children with tuberculosis:implications for diagnosis and monitoring of therapy[J].Clin Infect Dis,2005,40(9):1301-1308.
[8]Aiken A,Hill P,Fox A,et al.Reversion of the ELISPOT test after treatment in Gambian tuberculosis cases[J].BMC Infect Dis,2006, 6:66.
[9] Ewer K,Millington K,Deeks JJ,et al.Dynamic antigen-specific T-cell responses after point-source exposure to Mycobacterium tuberculosis[J].Am Respir Crit Care Med,2006,174(7):831-839.
[10]Leung CC,Yan WC,Ho PL,et al.T-SPOT.TB outperforms tuberculin skin test in predicting development of active tuberculosis among household contacts[J].Resirology,2015,20(3):496-503.
[11]Jung YJ,Woo HI,Jeon K,et al.The significance of sensitive interferon gamma release assays for diagnosis of latent tuberculosis infection in patients receiving tumor necrosis factor-alpha antagonist therapy[J].PLoS One,2015,10(10):e0141033.
[12]Hu XM,Liu J,Lei L,et al.Clinical usefulness of T-SPOT.TB in the diagnosis tuberculosis in emergency patients[J].Emergency Medicine,2012,12(suppl1):A7.
[13]Jose M,Catalina R,Mar M et al.Contribution of interferon gamma release assays testing to the diagnosis of latent tuberculosis infection in HIV-infected patients:A comparison of QuantiFERON-TB Gold in tube,T-SPOT.TB and tuberculin skin test[J].BMC Infectious Diseases,2012,12(169):2-10.
Value of T-SPOT.TB assay on monitoring the tuberculosis treatment efficacy.
HE Zi-qi,LI Cong-rong.Department of Clinical Laboratory,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo explore the value of T-SPOT.TB assay on monitoring the tuberculosis treatment efficacy.MethodsWe used the T-SPOT.TB assay to measure T-cell interferon-γ responses to Mycobacterium tuberculosis-specific peptides early secretory antigenic target 6-kD protein(ESAT-6)and culture filtrate protein 10 (CFP-10)in 113 patients with tuberculosis before and after the treatment.The results of changes in T-SPOT.TB before and after the treatment were analyzed according to the combined and separate responses to ESAT-6 and CFP-10 antigens.ResultsWhen the treatment was completed,42(37.2%)of 113 patients with tuberculosis reverted to negative according to the T-SPOT.TB results,of which CFP-10 reversion rate was 48.9%(P<0.001),and the ESAT-6 reversion rate was 20.0%(P=0.238).The mean number of spot-forming cells(SFCs)/2.5×105peripheral blood mononuclear cells(PBMCs)pre-and post-treatment were respectively 18.47 versus 16.29 for ESAT-6(P=0.16)and 22.83 versus 15.31 for CFP-10(P<0.01).ConclusionTuberculosis treatment has a differential effect on T-cell responses to ESAT-6 and CFP-10 as measured by T-SPOT.TB.The quantitative response to CFP-10 may be a more useful monitoring tool for treatment efficacy.
T-SPOT.TB assay;Early secretory antigenic target 6-kD protein(ESAT-6);Culture filtrate protein 10(CFP-10);Tuberculosis treatment
R52
A
1003—6350(2016)12—1923—03
10.3969/j.issn.1003-6350.2016.12.009
2015-12-28)
李從榮。E-mail:congrongli33@hotmail.com

