乙醛法篩選抗乙醛啤酒酵母菌株的應用研究
金瑋鋆,李 紅,王君偉(中國食品發酵工業研究院,北京100015)
?
乙醛法篩選抗乙醛啤酒酵母菌株的應用研究
金瑋鋆,李紅,王君偉
(中國食品發酵工業研究院,北京100015)
摘要:乙醛是使啤酒產生硬紙板味、爛蘋果味的主要來源,對啤酒品質有較大影響。本實驗采用紫外誘變與高濃乙醛平板選育結合法,將篩選得到的菌株(共20株)與出發菌株進行低溫發酵實驗,然后利用氣相色譜法測定菌株發酵液乙醛含量,并將其與出發菌株乙醛含量相比較。對具有較大乙醛降幅的菌株(共3株)進行乙醇脫氫酶活性的驗證及穩定性實驗,由此篩選出抗乙醛啤酒酵母菌株。該菌株可抵抗高濃度乙醛環境,從而快速還原代謝產生的乙醛,其乙醛含量為4.42 mg/L±0.14 mg/L,較出發菌株降低了71.13 %;乙醇脫氫酶(ADH1、ADH3與ADH4)活性顯著高于出發菌株(增幅為88.80 %),且遺傳穩定性表現良好。
關鍵詞:微生物;乙醛;抗乙醛啤酒酵母;高濃乙醛法;乙醇脫氫酶
優先數字出版時間:2015-10-22;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20151022.1440.002.html。
乙醛是啤酒羰基化合物的主要成分,也是啤酒產生硬紙板味、爛蘋果味的主要來源,對啤酒風味有較大的影響[1]。雖然國家標準GB4927—2008中并未對乙醛含量有所限制,但含量過高的乙醛也會影響人們對啤酒的味覺感受。當啤酒中乙醛的含量超過25 mg/L時,就會有辛辣刺激的口感;超過10 mg/L時,啤酒會有不成熟的口感。優質啤酒的乙醛含量一般在3~8 mg/L[2]。
在諸多低產乙醛啤酒酵母菌株的選育方法中,許多研究人員選擇運用基因工程手段構造重組菌株的方法獲得理想的低乙醛啤酒酵母菌株[3-4],該法雖然成功率高且效果顯著,但考慮到近年來利用基因工程重組菌株進行啤酒釀造的安全性問題備受爭議,國內外也鮮有企業將基因工程構造菌株應用于啤酒工業化生產之中。因此,本研究摒棄了基因工程法,通過分析啤酒酵母的乙醛代謝途徑,從傳統誘變及選育方法出發,進行低產乙醛啤酒酵母菌株的選育。
近年來也有研究人員采用相似選育方法進行低產乙醛啤酒酵母的選育。張媛媛利用紫外誘變和甲吡唑抗性平板+希夫試劑顯色結合法篩選得到乙醛含量低于出發菌的突變株,其乙醛降幅達到82.0 %[5];沈楠采用紫外誘變和乙醛脫氫酶抑制劑雙硫侖-乙醇平板篩選結合法,并配合高濃乙醛低溫馴化,得到低產乙醛酵母菌株,其降幅為73.7 %[6]。以上兩種方法在選育低產乙醛啤酒酵母菌株中具有顯著優勢,但操作過于復雜,實驗試劑成本過高。
因此,本實驗采用紫外誘變與高濃乙醛平板選育結合法,將隨機挑選大而圓的獨立菌落進行低溫發酵實驗,然后利用氣相色譜法測定實驗菌株發酵液乙醛的含量,并將其與出發菌株乙醛含量相比較。然后,對具有較大乙醛降幅的實驗菌株進行乙醇脫氫酶酶活的測定及穩定性實驗,由此篩選出抗乙醛啤酒酵母菌株。該菌株可抵抗高濃度乙醛環境,從而快速還原代謝產生的乙醛,具有低產乙醛的發酵特性。該方法操作簡單安全,所用試劑較少,可快速、有效地篩選出抗乙醛啤酒酵母,從菌株的角度降低啤酒中乙醛的含量。
如圖1所示,丙酮酸通過丙酮酸脫羧酶(E1)積累生成乙醛;乙醇通過乙醇脫氫酶(E2)生成乙醛的反應速率高于乙醛的還原反應;生成的乙醛未能通過乙醛脫氫酶(E3)及時轉化成乙酸。本實驗通過向環境中添加高濃度乙醛以造成乙醛的積累,抑制酵母的生長代謝活性,從而篩選E2(ADH1、ADH3、ADH4)或E3活性高的啤酒酵母菌株。
由圖1可知,E1為丙酮酸脫羧酶;E2為乙醇脫氫酶(其中乙醛生成乙醇途徑的關鍵酶為ADH1、ADH3、ADH4,乙醇生成乙醛的關鍵酶為ADH2);E3為乙醛脫氫酶(ALD2、ALD3、ALD4、ALD5、ALD6);E4為乙酰輔酶A合成酶(ACS1、ACS2)。
1材料與方法
1.1材料、試劑與儀器
1.1.1材料與試劑
菌種:實驗室保存菌株。
試劑及耗材:40 %乙醛(分析純),國藥集團化學試劑有限公司;瓊脂(生物試劑),北京奧博拓達科技有限公司;磷酸氫二鉀(分析純),磷酸二氫鉀(分析純),北京紅星化工廠;乙二胺四乙酸(EDTA)(生物試劑),氫氧化鉀(化學純),無水乙醇(分析純),北京化工廠;輔酶I (NAD+)(98 %分析純),還原型輔酶I(NADH)(98 %分析純),百靈威科技有限公司;甘氨酸(生物試劑),北京索萊寶科技有限公司;氯化鉀(分析純),西隴化工股份有限公司。
試劑及培養基配制方法如下:
2 mM EDTA:稱取0.58 g EDTA,用去離子水溶解并定容至1 L。
100 mM磷酸鉀緩沖液(pH7.5):將80.2 mL 1 mol/L磷酸氫二鉀與19.8 mL 1 mol/L磷酸二氫鉀混勻。
50 mM甘氨酸-氫氧化鉀緩沖溶液(pH9.0):將50 mL 0.2 mol/L甘氨酸與8.8 mL 0.2 mol/L氫氧化鉀混勻,用去離子水定容至200 mL。
100 mM乙醇:量取7.8 mL 75 %vol的乙醇溶液,用去離子水稀釋并定容至1 L。
0.15 mM乙醛:量取14.1 mL 40 %乙醛,迅速用去離子水稀釋并定容至1 L(通風櫥操作)。
1 mM NAD+:稱取0.67 g NAD+,用去離子水溶解并定容至1 L。
1 mM NADH:稱取0.71 g NADH,用去離子水溶解并定容至1 L。
10 mM氯化鉀:稱取0.75 g氯化鉀,用去離子水溶解并定容至1 L。
麥汁培養基:將大麥芽粉碎,利用協定糖化法制備原麥汁濃度為13°P的定型麥芽汁,115℃下滅菌20 min。
麥汁瓊脂培養基:在麥汁中加入2 %瓊脂,115℃下滅菌20 min。
乙醛-麥汁瓊脂培養基:用移液管移取10 mL 40 %乙醛溶液于100 mL容量瓶中,迅速用蒸餾水稀釋,配制成4 %乙醛溶液,備用(由于乙醛易揮發,因此配制時應在通風櫥內操作)。配制麥汁瓊脂培養基,滅菌后向含100mL未凝固培養基的三角瓶中依次注射添加經0.22 μm濾膜過濾的500 μL、1500 μL、2500 μL、3500 μL、4500 μL、5500 μL、6500 μL、7500 μL4 %乙醛溶液,立即封口并迅速混勻,配成終濃度依次為200 mg/L、600 mg/L、1000 mg/L、1400 mg/L、1800 mg/L、2200 mg/L、2600 mg/L、3000 mg/L的乙醛-麥汁瓊脂培養基。
1.1.2儀器與設備
生化培養箱(LRH-250),上海一恒科技有限公司;多用途恒溫超聲提取機(SY-1000E),北京弘祥隆生物技術公司;高速冷凍離心機(LR10-2.4A),北京雷勃爾醫療器械有限公司;紫外分光光度計(UV-1780),日本Shimadzu公司;高效氣相色譜儀(Autosystem XV),美國PE公司;高壓蒸汽滅菌鍋(LDZX-50KBS),上海申安醫療器械廠。
1.2實驗方法
1.2.1不同濃度乙醛的平板涂布
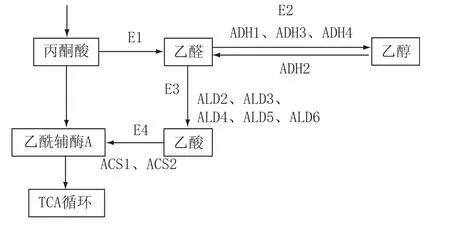
圖1酵母乙醛代謝途徑示意圖
(1)按乙醛-麥汁瓊脂培養基配制方法制備不同濃度乙醛-麥汁瓊脂平板,以麥汁瓊脂平板為對照,每個平板含培養基25 mL。
(2)取1支出發菌株(編號為KB)斜面,從斜面上接取1環酵母泥放入10 mL麥汁中28℃下活化培養24 h。
(3)取1 mL活化酵母液,利用梯度稀釋法稀釋至一定倍數后,分別取100 μL接到平板上涂布,每個乙醛濃度和對照組均設3個平行。
(4)將涂布好的平板(含乙醛的平板須用封口膜包好以減少乙醛的揮發)于28℃恒溫培養箱中倒置培養4~5 d,每日定時觀察菌落的生長情況,計算每個平板的菌落個數,計算抑制率。
抑制率的計算公式如下:
抑制率(%)=(對照組平均菌落數-實驗組平均菌落數)÷對照組平均菌落數×100 %。
1.2.2紫外誘變時間的確定
(1)25 W紫外燈預熱15~20 min后,將涂布好菌懸液的平板放置在紫外燈下30 cm處,迅速打開平板蓋進行紫外照射,紫外照射時間分別為0、5 s、10 s、15 s、20 s、30 s、40 s、50 s、60 s、70 s,每個照射強度做3個平行。
(2)照射后立即關蓋,并迅速用錫紙包好避光放置,整個誘變過程須避光完成,防止菌體發生光修復。
(3)將包好的平板于28℃下避光倒置培養4~5 d,觀察并記錄不同照射時間下酵母菌落數,計算不同照射強度下酵母致死率,確定紫外誘變最佳照射時間。
致死率的計算公式如下:
致死率(%)=(對照組平均菌落數-實驗組平均菌落數)÷對照組平均菌落數×100 %。
1.2.3高濃乙醛篩選抗乙醛啤酒酵母
(1)制備乙醛濃度為1800 mg/L的乙醛-麥汁瓊脂平板,按平板涂布實驗方法對酵母菌懸液進行涂布。
(2)對涂布好的平板進行紫外誘變的照射,照射時間為20 s,設3個平行。照射結束后用錫紙包好,于28℃下避光倒置培養4~5 d,觀察并記錄不同照射時間下酵母菌落數量。
(3)從平板中隨機挑選大而圓的獨立菌落酵母菌株,編號并保藏至斜面。
(4)分別從實驗菌株和KB斜面上取1環酵母菌株(接菌量約為2.5×107cfu/mL)放入10 mL麥汁中,28℃下活化培養24 h。
(5)分別取1 mL活化液接入9 mL麥汁中,28℃下擴大培養24 h,以提高酵母菌株的活性并促使接菌量基本一致。
(6)將10 mL擴培液分別接入100 mL麥汁中,12℃下進行低溫發酵,發酵時間為8~10 d。
(7)發酵結束后,取5 mL發酵液至頂空瓶中,參照《啤酒分析方法》GB 4928—2008,利用氣相色譜法(GC)對實驗菌株發酵液進行乙醛含量的測定[7],計算各實驗菌株的乙醛降幅與所有實驗菌株的乙醛平均降幅。降幅及平均降幅的計算公式如下:
降幅(%)=(出發菌株乙醛含量-實驗菌株乙醛含量)÷出發菌株乙醛含量×100 %;
平均降幅(%)=正突變菌株乙醛降幅的總和÷正突變菌株個數×100 %。
(8)根據乙醛降幅由大到小的順序對實驗菌株進行排序,選取降幅較大的3株進行乙醇脫氫酶酶活的測定。
1.2.4乙醇脫氫酶的提取及測定
1.2.4.1粗酶液的提取
(1)發酵結束后,將余下發酵液倒入50 mL離心管中(離心管須事先稱量質量并編號),以5000×g離心5 min,棄上清液收集酵母細胞。
(2)用5 mL 2 mM EDTA和超純水分別清洗2次,每次以5000×g離心10 min。
(3)稱量含有底層酵母泥的離心管質量以計算得到酵母泥質量,將收集得到的酵母泥懸浮于100 mM的磷酸鉀緩沖溶液(pH 7.5)(按1∶30料液比)。
(4)采用凍融-超聲結合法對酵母懸濁液進行破壁處理,將菌懸液冷凍于-18℃冰箱,每次至少冷凍3 h,于4℃冰箱中解凍3次。
(5)第3次解凍菌懸液后將其置于恒溫超聲提取機中,0℃下500 W超聲20 min(工作時間為3.5 s,間歇時間為1.5 s,冰浴降溫)。
(6)將超聲后的菌懸液在10℃下10000×g低溫離心10 min,吸取上清液作為細胞抽提物即粗酶液。
1.2.4.2乙醇脫氫酶酶活的測定
乙醇脫氫酶活性的測定原理為:
(1)乙醇脫氫酶ADH2酶活的測定:取2支比色管,向其中1支比色管中依次添加1.5 mL甘氨酸-氫氧化鉀緩沖液、0.5 mL NAD+、0.5 mL粗酶液作為實驗組,另1支比色管中依次添加1.5 mL甘氨酸-氫氧化鉀緩沖液、0.5 mL NAD+、0.5 mL去離子水作為對照組。將比色管搖勻,室溫(25℃)下添加0.5 mL乙醇,快速混勻后倒入比色皿中,記錄340 nm下1 min的吸光度,并計算每分鐘吸光度增加值E340。
(2)乙醇脫氫酶ADH1酶活的測定:取2支比色管,向其中1支比色管中依次添加1.5 mL甘氨酸-氫氧化鉀緩沖液、0.5 mL NADH、0.5 mL粗酶液作為實驗組,另1支比色管中依次添加1.5 mL甘氨酸-氫氧化鉀緩沖液、0.5 mL NADH、0.5 mL去離子水作為對照組。將比色管搖勻,室溫(25℃)下添加0.5 mL乙醛,快速混勻后倒入比色皿中,記錄340 nm下每分鐘的吸光度,并計算每分鐘吸光度增加值E340。
乙醇脫氫酶酶活定義為:3 mL反應體系。1 min吸光度增加0.001為一個活力單位。以單位酵母質量所有具有的酶活性值表示,單位為U/mg。
酶活計算公式如下:
U= (E340×3) / (0.5×0.001)。
式中:E340為每分鐘的吸光度增加值;3為測酶活的反應體系的量;0.5為反應體系添加酶液的量;0.001為吸光度增加單位。
酶活增幅的計算公式如下:
酶活增幅(%)=(實驗菌株酶活-出發菌株酶活)÷出發菌×100 %。
1.2.5穩定性實驗
1.2.5.1重復實驗
選取初篩菌株與出發菌株,重復發酵實驗并測定相關指標,每株設3組平行。
1.2.5.2傳代實驗
(1)選取初篩菌株與出發菌株斜面上取1環酵母菌株(接菌量約為2.5×107cfu/mL)放入10 mL麥汁中,28℃下活化培養24 h。
(2)分別取1 mL活化液接入10 mL麥汁中,28℃下擴大培養24 h,以提高酵母菌株的活性并促使接菌量基本一致,視此發酵液為酵母菌株的第0代發酵液。
(3)在第0代菌株發酵高泡期(即24 h后)時,從中移取1 mL發酵液,加到10 mL麥汁中,為1代菌株發酵,剩余10 mL第0代發酵液則接入100 mL麥汁中進行12℃低溫發酵實驗;在第1代菌株發酵高泡期時,再移出1 mL發酵液加到10 mL麥汁中,為2代菌株發酵,剩余10 mL 第1代發酵液接入100 mL麥汁中進行12℃低溫發酵實驗。如此反復操作步驟,連續進行5代三角瓶發酵實驗,發酵時間為8~10 d。
(4)發酵結束后,取5 mL發酵液至頂空瓶中,參照《啤酒分析方法》GB 4928—2008,利用氣相色譜法(GC)對實驗菌株發酵液進行乙醛含量的測定,計算相同菌株不同代數間的相對偏差,據此驗證初篩菌株穩定性。
2結果與討論
2.1乙醛抑制曲線與最佳添加濃度的確定
按照乙醛添加方法及培養基配制方法,分別制備濃度梯度為0 mg/L、200 mg/L、600 mg/L、1000 mg/L、1400 mg/L、1800 mg/L、2200 mg/L、2600 mg/L、3000 mg/L乙醛稀釋液的麥汁瓊脂培養基,并進行平板涂布培養實驗,對各平板進行菌落計數和抑制率的計算,繪制抑制曲線,實驗結果見圖2。
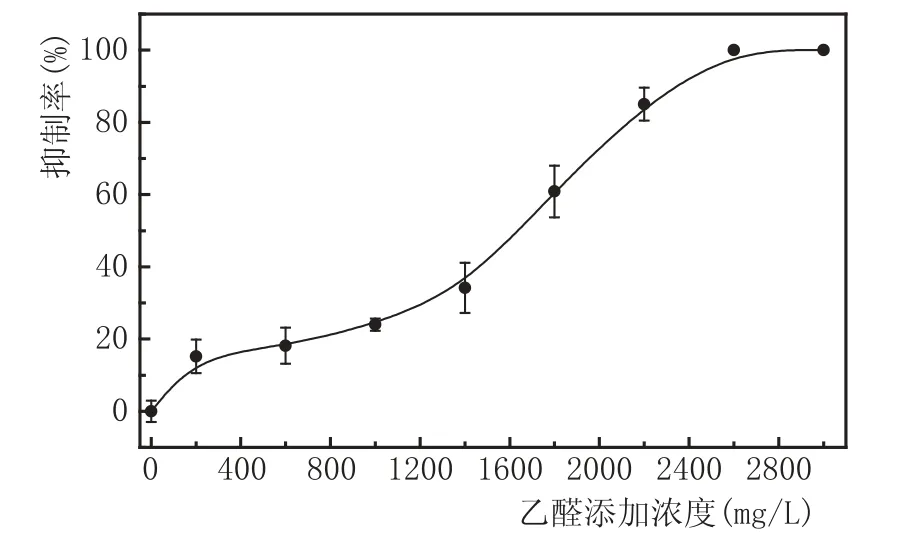
圖2添加不同濃度乙醛的酵母抑制曲線
由圖2可知,隨著乙醛添加濃度的不斷升高,酵母抑制率逐漸上升,抑制曲線呈上升趨勢,當乙醛濃度大于2600 mg/L時,酵母完全受到抑制,不再生長。當乙醛濃度為1800 mg/L時,酵母抑制濃度超過50 %,因此,選取1800 mg/L為乙醛最佳添加濃度。
2.2紫外誘變最佳時間的確定
本研究通過紫外誘變實驗得到不同誘變時間下酵母致死率,繪制致死曲線,對紫外誘變的最佳誘變時間進行確定。實驗結果見圖3。
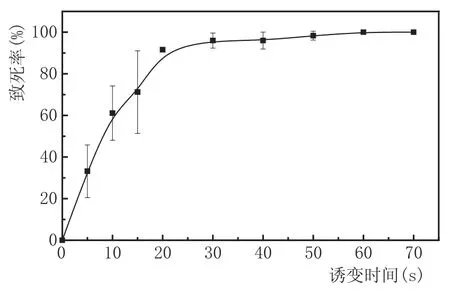
圖3不同紫外誘變時間下的酵母致死曲線
由圖3可知,酵母致死率隨著紫外誘變時間的增長呈上升趨勢,當紫外誘變時間在20 s之前時,酵母致死率較低且不穩定;當紫外誘變時間為20 s時,酵母致死率超過80 %;當誘變時間為60 s以上時,酵母致死率達到100 %。因此,本實驗選取20 s(致死率為91.58 %)作為其最佳誘變時間。
2.3抗乙醛啤酒酵母菌株的選育
選取抑制濃度為1800 mg/L乙醛進行抗乙醛啤酒酵母菌株的選育實驗。實驗中共隨機挑選了20株實驗菌株與出發菌株(KB)一同進行液態發酵實驗。發酵結束后,測定乙醛含量,并計算實驗菌株乙醛降幅與平均降幅,結果見圖4。
由圖4可知,20株實驗菌株中共有9株乙醛含量較出發菌株(KB)有所下降,正突變率為45.00 %,平均降幅為18.39 %,最大降幅為71.40 %。
其中,乙醛降幅最高的菌株編號依次為2、12、14。
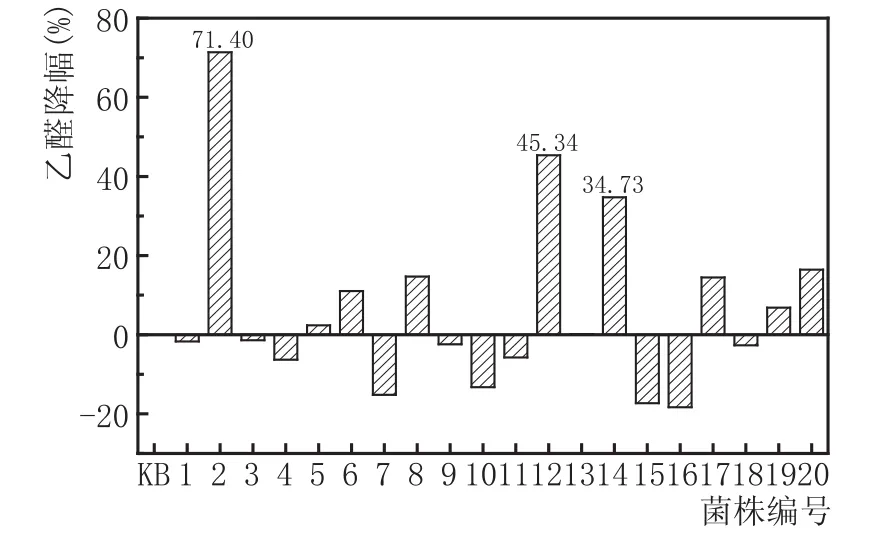
圖4高濃乙醛法篩選菌株(共20株)與出發菌株(KB)乙醛降幅
2.4初篩菌株與出發菌株乙醇脫氫酶酶活的測定
對編號為2、12、14的3株初篩菌株及KB進行乙醇脫氫酶(分別用ADH1與ADH2表示)酶活的測定,并計算初篩菌株與KB的酶活增幅,測定及計算結果見表1。
由表1可知,3株初篩菌株乙醇脫氫酶酶活均高于出發菌株KB,將乙醛生成乙醇途徑的關鍵酶ADH1、ADH3、ADH4與乙醇生成乙醛的關鍵酶ADH2酶活增幅相比較可以看出,初篩菌株ADH1、ADH3、ADH4酶活增幅均高于ADH2酶活增幅,該現象表明初篩菌株乙醛生成乙醇的反應速率大于乙醇生成乙醛的反應速率,因而實現乙醛代謝速度的提升。該實驗結果很好地證實了初篩菌株的低產乙醛現象,也驗證了利用高濃乙醛法選育抗乙醛啤酒酵母菌株的有效性。3組實驗菌株中,菌株2乙醇脫氫酶ADH1、ADH3、ADH4酶活顯著高于其余實驗菌株及對照組,該實驗結果與其具有最大乙醛降幅相符合。
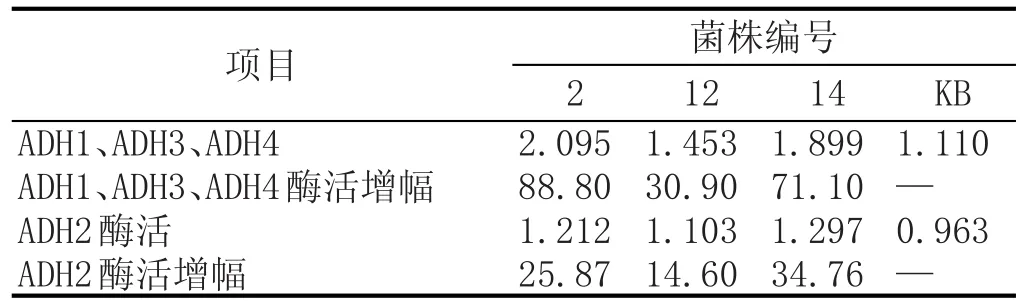
表1初篩菌株(共3株)與出發菌株(KB)乙醇脫氫酶活性及酶活增幅對比結果
2.5穩定性實驗
對以上3株初篩菌株進行同步發酵并測定發酵液乙醛含量,進行重復實驗及傳代實驗,其中,重復實驗設3組平行,傳代實驗共傳5代。
初篩菌株與KB重復性實驗見表2:3株初篩菌株與KB實驗重復性良好,數據標準偏差均不超過0.20 mg/L。其中,菌株2的乙醛含量平均值最低(4.42 mg/L±0.14 mg/L),比出發菌株(KB)降低了71.13 %。初篩菌株與KB傳代實驗見表3:菌株2、菌株12表現出良好的遺傳穩定性,每代乙醛含量間標準偏差均低于0.20 mg/L。菌株2乙醛含量的波動范圍為4.12~4.49 mg/L。
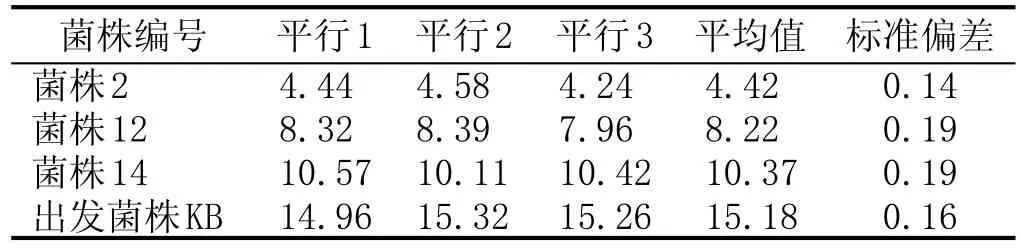
表2初篩菌株(共3株)與出發菌株(KB)重復實驗乙醛含量對比結果 (mg/L)
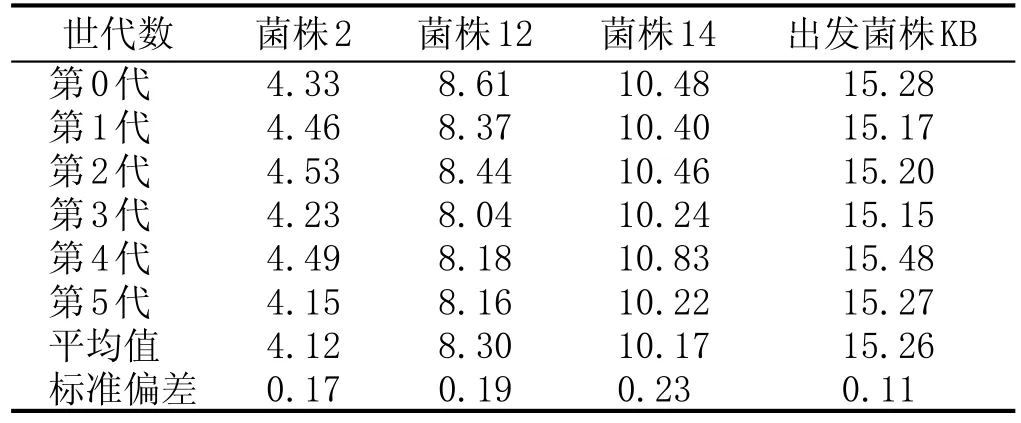
表3初篩菌株(共3株)與出發菌株(KB)傳代實驗乙醛含量對比結果 (mg/L)
3 結論
本實驗從酵母乙醛代謝途徑出發,分析了酵母降低乙醛含量的代謝途徑,并綜合實驗操作成效及實驗菌株安全性,最終采用將紫外誘變育種與高濃乙醛法平板篩選法相結合的方法篩選抗乙醛啤酒酵母菌株。通過低溫發酵實驗測定乙醛含量及低乙醛實驗菌株乙醇脫氫酶活性,最終篩選得到具有抗高濃度乙醛環境且穩定傳代的抗乙醛啤酒酵母菌株。該菌株編號為2,乙醛含量為4.42 mg/L±0.14 mg/L,較出發菌株降低了71.13 %;其乙醇脫氫酶(ADH1、ADH3與ADH4)活性顯著高于出發菌株(增幅為88.80 %),且遺傳穩定性表現良好。
參考文獻:
[1] Joseph T H, William C H. Kinetics of acetaldehyde formation during the staling of lager beer[J]. Journal of the ASBC, 1977, 35(4):183-186.
[2]李紅,吳永陽,張五九.啤酒中的乙醛[J].釀酒, 2004, 31(6):
35-37.
[3] Wang D L, Sun J S, Zhang W J. Disruption of brewer's yeast alcohol dehydrogenase II gene and reduction of acetaldehyde content during brewery fermentation[J]. Journal of the ASBC, 2006, 64(4):195-201.
[4]蔡勇,王肇悅,晏本菊.關于控制啤酒乙醛含量的研究進展[J].中國釀造, 2008,182(5):4-6.
[5]張媛媛,李崎.低產乙醛啤酒酵母的選育與研究[D].無錫:江南大學, 2011.
[6]沈楠,王金晶,劉春鳳,等.低產乙醛啤酒酵母的定向馴化篩選[J].食品與發酵工業,2013, 39(7):94-97.
[7]全國食品工業標準化技術委員會.GB/T 4928—2008啤酒分析方法[S].北京:中國標準出版社,2009.
The Screening of Acetaldehyde-resistant Beer Yeast Strains by High-concentration Acetaldehyde Method
JIN Weiyun, LI Hong and WANG Junwei
(China National Research Institute of Food & Fermentation Industries, Beijing 100015, China)
Abstract:Acetaldehyde is the main source of cardboard and rotten apple flavor in beer, which has a great influence on beer quality. In this study, acetaldehyde content in the fermenting liquid (low- temperature fermentation by starting strains and 20 experimental yeast strains screened by UV mutation and high-concentration acetaldehyde breeding method) was measured by GC. Then acetaldehyde content in fermenting liquid by experimental strains was compared with that by starting strains. And the activity of alcohol dehydrogenase and the stability test of the experimental strains (3 strains in total) with large decreasing amplitude of acetaldehyde content were carried out to select acetaldehyde-resistant yeast strains. The content of acetaldehyde of the final-selected beer yeast strains was 4.42±0.14 mg/L, 71.13 % lower than the starting strains; the activity of alcohol dehydrogenase (ADH1, ADH3 and ADH4 ) was significantly higher than the starting strains (increased by 88.80 % ), and good genetic stability was expressed.
Key words:microbe; acetaldehyde; acetaldehyde-resistant beer yeast; high-concentration acetaldehyde method; alcohol dehydrogenase
通訊作者:李紅(1978-),男,博士,博士后,高級工程師,研究方向:食品發酵。
作者簡介:金瑋鋆。
收稿日期:2015-07-23
基金項目:國家國際科技合作專項項目(2014DFG31770)。
DOI:10.13746/j.njkj.2015319
中圖分類號:TS262.5;TS261.1;TS261.4
文獻標識碼:A
文章編號:1001-9286(2016)01-0010-05

