miRNA- 140過表達腺病毒載體的構建及鑒定
賀鵬,段莉
[1.南方醫科大學附屬深圳恒生醫院 口腔科,廣東 深圳 518000; 2.深圳市第二人民醫院
(深圳大學第一附屬醫院),深圳市組織工程重點實驗室,廣東 深圳 518035]
?
miRNA- 140過表達腺病毒載體的構建及鑒定
賀鵬1,段莉2
[1.南方醫科大學附屬深圳恒生醫院 口腔科,廣東 深圳518000; 2.深圳市第二人民醫院
(深圳大學第一附屬醫院),深圳市組織工程重點實驗室,廣東 深圳518035]
[摘要]目的:構建穩定表達成熟miRNA- 140腺病毒表達載體。方法:從人類基因組中擴增出帶有酶切位點的miRNA- 140目的基因,將目的基因連接到穿梭質粒pDC316- mCMV- EGFP,進一步將帶有目的基因的穿梭質粒重組到骨架質粒AdEasy,并將重組質粒轉染到AAV- 293細胞中包裝成腺病毒載體,經過二次擴增之后獲得高滴度的腺病毒,并且檢測其包裝效率及感染滴度。最后,用目的腺病毒感染骨肉瘤細胞,通過熒光定量PCR方法檢測miRNA- 140表達情況。結果:酶切鑒定和測序結果均表明,miRNA- 140 成功克隆入pDC316- mCMV- EGFP 載體中。與AdEasy重組后,包裝純化具有感染性的腺病毒miRNA- 140,通過熒光定量PCR檢測,軟骨肉瘤細胞中miRNA- 140升高4.2±0.2倍。 結論:成功構建了成熟miRNA- 140的腺病毒表達載體。
[關鍵詞]miRNA- 140; AdEasy系統; 熒光定量PCR; 骨肉瘤細胞
microRNA(微小RNA)以下簡稱miRNA,是真核生物體內廣泛分布的一類長約19~25 bp核苷酸的內源性非編碼單鏈小RNA分子,其依賴于miRNA成熟體和靶基因mRNA的3′UTR(非翻譯區)互補性的機制,從而在基因的轉錄水平上對目的基因表達進行負向調控,導致mRNA翻譯抑制或者降解[1- 2]。miRNA的功能十分強大,人體內編碼蛋白質的基因中有30%受到miRNA的調控,而每個miRNA可以調節數百個靶基因,因此,探討miRNA在基因表達調控領域的研究有重要意義。其中miRNA表達載體已成為miRNA研究的重要工具之一,miRNA真核表達載體已被廣泛應用于生物體內基因的功能研究領域。 目前,在骨肉瘤的治療過程中一般偏向于采用化療聯合手術切除的綜合療法。然而,隨著藥物治療時間的延長, 骨肉瘤耐藥性出現極大影響了新開發輔助藥物治療的效果,從而導致骨肉瘤治療失敗。最近研究表明,骨肉瘤的最新生物標記miRNA- 140與骨肉瘤的耐藥性關系密切[3- 5]。因此,構建miRNA- 140的過表達腺病毒載體,可為進一步探討miRNA- 140在骨肉瘤耐藥中的作用機制奠定基礎。
本研究利用基因工程技術克隆了人miRNA- 140編碼基因, 并完成其腺病毒載體的構建。將miRNA- 140與包裝載體轉染AAV- 293(腺相關病毒- 293)細胞, 收獲腺病毒,為探討miRNA- 140在骨肉瘤耐藥中的作用機制提供工具。此外,成功構建可在細胞內穩定表達miRNA- 140的表達載體將為進一步研究相關基因功能奠定基礎。
1材料和方法
1.1實驗材料
AAV- 293細胞(深圳市第二人民醫院中心實驗室保存),DH5a感受態細胞(深圳市第二人民醫院中心實驗室制備),pDC316- mCMV- EGFP和 pBHGloxdeltaE1,3Cre質粒(本實驗室保存),Trizol試劑 (Invitrogen公司),DNA提取試劑盒、質粒提取試劑盒(Omega公司),各種工具酶、DNA marker (Takara公司),其余試劑為國產分析純。
1.2重組腺病毒載體pDC316- miRNA- 140的構建及鑒定
根據GenBank中miRNA- 140的序列設計合成引物,miRNA- 140編碼序列堿基NW- 926462.1,核苷酸位置 23546875- 23547470(表1), 以人類基因組為模板,PCR擴增出595bp片段。 載體pDC316- mCMV- EGFP經PstⅠ 和HindⅢ 酶切后直接去磷酸化,瓊脂糖凝膠電泳后回收線性化載體。常規方法連接轉化,經測序驗證。
表1普通PCR以及實時熒光定量引物序列
Tab 1Primers used for stem- loop reverse transcription or polymerase chain reaction of mi- RNAs

RNA引物序列(5'-3')miRNA-140SenseGTAGGCACTGCAGATGAGAGAGAGAGAGCGCTGTAntisenseATCGACAAGCTTCATGCTGCCTTCAGATGAGAmiRNA-140-5pStem-loopprimerGTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCATSenseCGCGCCAGTGGTTTTACCCTAntisenseCCAGTGCAGGGTCCGAGGTAU6Stem-loopprimerGTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACGATTSenseCCTGCGCAAGGATGACAntisenseGTGCAGGGTCCGAGGT
1.3重組腺病毒miRNA- 140制備
腺病毒包裝細胞AAV- 293 用含10%胎牛血清的高糖DMEM培養液進行培養,控制細胞匯合度為50%進行傳代擴增。準備進行包裝24h前將細胞傳代接種于直徑10cm 的細胞培養皿,轉染前細胞生長密度至培養皿底面積的70%~80%,每皿約3×106個細胞。重組腺病毒穿梭質粒pDC316- miR- 140- EGFP、陽性對照pDC316- GFP,分別通過Biotool DNA Transfection Reagent與腺病毒骨架質粒pBHGloxdeltaE1,3Cre共轉染AAV- 293細胞。每天觀察細胞出毒現象,出毒現象為細胞變大變圓,呈葡萄狀,并開始出現明顯噬斑。病毒包裝72h后,在激發波長488nm處利用倒置熒光顯微鏡觀察AAV- 293細胞中綠色熒光蛋白的表達,計數表達綠色熒光細胞的比例,確定轉染后病毒包裝感染效率。
1.4病毒液的收集和純化
用細胞刮刀把貼壁細胞全部刮落到培養液中,轉移到消毒、預冷的50ml離心管中,反復凍融4次(-80℃和37℃水浴), 每次凍融的時間為15 min左右。隨后以12000 r·min-1離心10 min 除去細胞碎片。將含病毒的上清轉入新的離心管中。向病毒液中加入1/10 體積的氯仿,37 ℃ 300r·min-1劇烈振搖1h。然后加入氯化鈉粉末2.56 g至終濃度為1mol·L-1,4℃、12000 r·min-1離心30min后收集離心管中的上清液于一新的50ml離心管中,加入PEG8000至終濃度10%,振搖至其完全溶解,然后冰上放置1h。最后4 ℃、12000 r·min-1離心30min,棄上清,向沉淀中加入4ml PBS溶解沉淀并分裝凍存于-80℃, 命名為pAd- has- miRNA- 140。
1.5骨肉瘤細胞中miRNA- 140 表達水平的檢測
pAd- has- miRNA- 140感染骨肉瘤細胞后, 提取總RNA,RT- PCR(實時定量聚合酶鏈反應)方法檢測miRNA水平。分別以140- RT和U6- RT為引物,對RNA進行反轉錄,合成cDNA第一鏈。以cDNA為模板,用特異性上游引物140- qRTf 或U6- qRTf 以及通用下游引物Reverse(表1)分別對目的基因miR- 140 及內參基因U6 snRNA 進行擴增,反應體系按照SYBR Premix Ex Taq Ⅱ熒光定量PCR 試劑盒說明進行,用ABI 7300熒光定量PCR系統進行檢測。采用相對定量方法進行miRNA水平分析,miR- 140表達水平用2- ΔCt表示,其中ΔCt=CtmiR- 140-CtU6。設對照組(感染空載體病毒的骨肉瘤細胞)miRNA- 140表達水平為1,計算實驗組(干擾pAd- has- miRNA- 140病毒的骨肉瘤細胞)miRNA- 140的相對表達水平。
1.6統計學處理
應用GraphPad Prism 5.0軟件進行數據分析和統計圖制作。兩組間miRNA- 140表達水平比較用Student’t檢驗,P<0.05為差異有統計學意義。
2結果
2.1腺病毒穿梭質粒的構建、同源重組及鑒定
pDC316- miRNA- 140- EGFP經PstⅠ和HindⅢ雙酶切鑒定(圖1)、DNA測序結果證實,與miRNA- 140編碼序列的同源性為100%。該結果表明已成功將miRNA- 140定向克隆至穿梭質粒pDC316- mCMV- EGFP中。
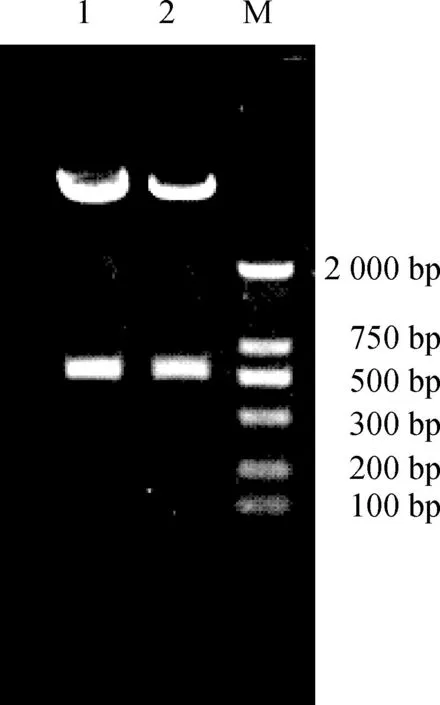
M.DNA marker;1、2.pDC316- miRNA- 140- EGFP雙酶切
圖1重組腺病毒質粒pDC316- miRNA- 140- EGFP的PstⅠ和HindⅢ雙酶切鑒定
M.DNA marker;1,2.pDC316- miRNA- 140- EGFP double digestion
Fig 1The recombinant adenovirus plasmid was identified withPstⅠ andHindⅢ digestion
2.2pDC316- miRNA- 140質粒成功轉染至腺病毒包裝細胞AAV- 293
質粒共轉染AAV- 293 細胞24h后倒置顯微鏡下觀察發現,細胞變大變圓,呈葡萄狀,并開始出現明顯噬斑。72h后熒光顯微鏡下觀察到細胞熒光表達率高達70%(圖2)。該結果表明pDC316- miRNA- 140質粒已成功轉染腺病毒包裝細胞AAV- 293。
2.3實時定量PCR檢測miRNA- 140的表達
pDC316- miRNA- 140病毒感染骨肉瘤細胞后,利用實時定量PCR檢測miRNA- 140表達情況,與對照組比較,實驗組的miRNA- 140明顯升高(圖3)。該結果表明pDC316- miRNA- 140病毒已成功感染骨肉瘤細胞。
3討論
越來越多的研究表明,miRNA與腫瘤的發生密切相關[6- 7]。對miRNA在不同組織和疾病中的表達譜分析發現, miRNA 在骨肉瘤表達譜具有明顯的組織特異性, 在該類疾病中miRNA的表達譜改變具有明顯的特征。這些特點使miRNA有可能成為骨肉瘤診斷的新的生物學標記和治療藥物作用的靶標。大量研究證據也表明,miRNA異常表達在骨肉瘤的發病、后期惡化及轉移中扮演重要角色,許多重要的miRNA參與骨肉瘤細胞的免疫逃逸反應、腫瘤新生血管的生成及其耐藥性等等。目前,腫瘤相關miRNA具備應用于骨腫瘤的分型、診斷、預后判斷、藥效評估及用于輔助的相關治療等方面的潛能[8- 10]。

A.倒置顯微鏡下觀(×100); B.熒光顯微鏡下觀(×100)
圖2重組腺病毒質粒pDC316- miRNA- 140- EGFP在包裝細胞AAV- 293中的表達情況
A.Under the invert microscope(×100); B.Under the fluorescent microscope(×100)
Fig 2The expression of the recombinant adenovirus plasmid pDC316- miRNA- 140- EGFP in AAV- 293
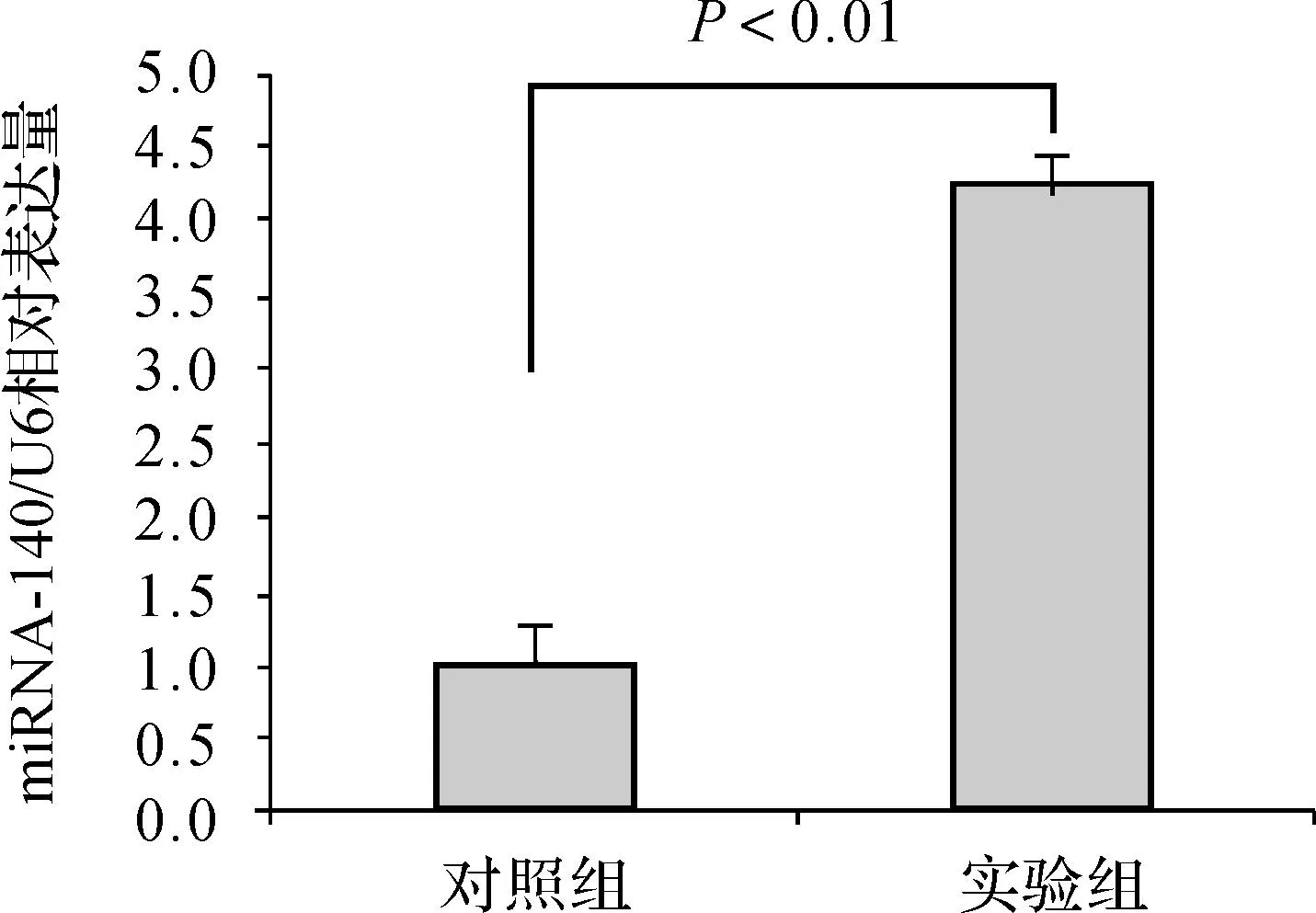
圖3實時定量PCR檢測重組腺病毒pAd- has- miRNA- 140感染骨肉瘤細胞表達情況
Fig 3The expression of the recombinant adenovirus pDC316- miRNA- 140 in osteosarcoma cells was detected by real- time PCR
在研究miRNA功能時, 最簡潔的方法是利用化學方法合成的miRNA 進行轉染,但化學合成的這類RNA穩定性差、容易發生降解,不能達到持續穩定的表達,特別是原代細胞存在轉染效率低等問題。這些不足使得轉染miRNA成為研究者需解決的一道難題。利用miRNA構建病毒類表達載體則能夠克服上述缺點。腺病毒載體的miRNA不僅保留了每個miRNA天然的原始獨自雙臂結構,并且腺病毒載體上的強啟動子CMV非常有利于miRNA的大量表達。腺病毒載體容量大,安全系數高,腺病毒不會整合到宿主細胞的染色體當中, 因而產生免疫原性極小, 而且腺病毒包裝容易操作, 所制備病毒滴度很高,病毒可以感染多種細胞類型,特別針對一些原代難以轉染的細胞可以達到理想的轉染效果,成為近來的首選方法[11- 12]。因此,腺病毒包裝的miRNA非常適合用于miRNA基因調控功能研究、miRNA基因治療等方面。
本研究構建的重組穿梭質粒pDC316- mCMV- miRNA- 140中包含加強性GFP表達框,可于感染24h后不同時間段觀察熒光表達。因此, 重組病毒載體在293AAV細胞中的包裝效率很容易通過熒光顯微鏡觀察, 也為重組病毒滴度測定提供便利; 特別是在帶有目的基因的重組腺病毒感染靶細胞時,可以直接通過觀察到目的基因轉入組織細胞的熒光強度來確定目的基因的表達效果。
本研究利用Adeasy腺病毒包裝系統成功完成重組腺病毒pAd- has- miRNA- 140包裝與純化,收獲高滴度的重組腺病毒,隨后感染目的細胞,其高表達miRNA- 140。這為下一步進行基礎研究與臨床應用奠定了基礎。特別是miRNA- 140的靶基因是HDAC4(組蛋白去乙酰化酶4), 通過抑制HDAC在骨肉瘤中的作用可能還具有一定的治療方面的應用價值[13]。因此, 本研究成功制備了miRNA- 140重組腺病毒, 為進行miRNA- 140與骨肉瘤耐藥作用機制以及miRNA- 140參與骨肉瘤疾病發病機制的研究創造了前提條件。
[參考文獻]
[1] WAHID F,SHEHZAD A,KHAN T,et al.MicroRNAs:synthesis,mechanism,function,and recent clinical trials[J].Biochim Biophys Acta,2010,1803(11):1231- 1243.
[2] FARAZI T A,HOELL J I,MOROZOV P,et al.microRNAs in Human Cancer[J].Adv Exp Med Biol,2013,774:1- 20.
[3] SONG B,WANG Y,XI Y,et al.Mechanism of chemoresistance mediated by miR- 140 in human osteosarcoma and colon cancer cells[J].Oncogene,2009,28(46):4065- 4074.
[4] NICOLAS F E,PAIS H,SCHWACH F,et al.Experimental identification of microRNA- 140 targets by silencing and overexpressing miR- 140[J].RNA,2008,14(12):2513- 2520.
[5] KOTA J,CHIVUKULA R R,O’DONNELL K A,et al.Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model[J].Cell,2009,137(6):1005- 1017.
[6] 蔣森,趙亞萍,杜云翔.MiR- 1在腫瘤中的研究進展[J].東南大學學報:醫學版,2012,31(5):648- 651.
[7] 蔣亮,劉春輝,許斌,等.miR- 146a通過抑制ROCK1基因的表達促進去勢抵抗性前列腺癌細胞的凋亡[J].東南大學學報:醫學版,2015,34(3):357- 360.
[8] OOM A L,HUMPHRIES B A,YANG C.MicroRNAs:novel players in cancer diagnosis and therapies[J].Biomed Res Int,2014,2014:959461.
[9] GUO X,XIA J,YAN J.Promoter methylated microRNAs:Potential therapeutic targets in gastric cancer (Review)[J].Mol Med Rep,2015,11(2):759- 765.
[10] GANDELLINI P,GIOVANNETTI E,NICASSIO F.MicroRNAs in cancer management:big challenges for small molecules[J].Biomed Res Int,2015,2015:982156.
[11] EINFELD D A,ROELVINK P W.Advances towards targetable adenovirus vectors for gene therapy[J].Curr Opin Mol Ther,2002,4(5):444- 451.
[12] LIU F,LI Q,ZHANG P et al.Role of adenovirus- mediated retinoblastoma 94 in the treatment of human non- small cell lung cancer[J].Mol Med Rep,2015,11(5):3349- 3353.
[13] TUDDENHAM L,WHEELER G,NTOUNIA- FOUSARA S,et al.The cartilage specific microRNA- 140 targets histone deacetylase 4 in mouse cells[J].FEBS Lett,2006,580(17):4214- 4217.
The construction and identification of an adenoviral vector expressing mature miRNA- 140
HE Peng1,DUAN Li2
[1.DepartmentofStomatology,SouthernMedicalUniversityShenzhenHengshengHospital,Shenzhen518000,China;2.ShenzhenKeyLaboratoryofTissueEngineering,ShenzhenSecondPeople’sHospital(TheFirstHospitalAffiliatedtoShenzhenUniversity),Shenzhen518035,China]
[Abstract]Objective:To construct an adenoviral vector expressing mature miRNA- 140. Methods: The target Hsa- miRNA- 140 gene amplified from human genome was digested and linked to the shuttle plasmid pDC316- mCMV- EGFP. The recombinant plasmid was confirmed and transfected into AAV- 293 cells for adenoviruses pAd- has- miRNA- 140 packaging. The obtained adenoviruses were used to infect target cells and the cellular expressions of has- miRNA- 140 were detected using fluorescence and quantitative PCR. Results: Has- miRNA- 140 containing the restriction sites was amplified and linked to the shuttle plasmid pDC316- mCMV- EGFP,which was successfully recombined with AdEasy.After packaging in AAV- 293 cells,the adenoviruses were obtained,which caused an increase of miRNA- 140 expression about 4.2±0.2 folds in osteosarcoma cells. Conclusion: The adenoviral vector expressing the mature miRNA- 140 is successfully constructed.
[Key words]miRNA- 140; AdEasy system; quantitative polymerase chain reaction; osteosarcoma cells
doi:10.3969/j.issn.1671- 6264.2016.01.002
[中圖分類號]Q782
[文獻標識碼]A
[文章編號]1671- 6264(2016)01- 0006- 05
[作者簡介]賀鵬(1973-),男,湖南衡山人,主治醫師。E- mail:hp73514@sina.com
[基金項目]深圳市科技計劃項目(201003462)
[收稿日期]2015- 07- 20[修回日期] 2015- 09- 18
[引文格式] 賀鵬,段莉.miRNA- 140過表達腺病毒載體的構建及鑒定[J].東南大學學報:醫學版,2016,35(1):6- 10.
·論著·

