兔膝骨性關節炎治療中透明質酸鈉與曲安奈德對滑膜和軟骨的影響
李偉,姜春巖,王戰偉,任士友,肖德明
(1.北京大學第四臨床醫學院北京積水潭醫院運動損傷科,北京100035;2.北京大學深圳醫院運動醫學與康復科,廣東深圳518036)
兔膝骨性關節炎治療中透明質酸鈉與曲安奈德對滑膜和軟骨的影響
李偉1,姜春巖1,王戰偉2,任士友2,肖德明2
(1.北京大學第四臨床醫學院北京積水潭醫院運動損傷科,北京100035;2.北京大學深圳醫院運動醫學與康復科,廣東深圳518036)
目的評估透明質酸鈉與曲安奈德對兔膝骨性關節炎中關節滑膜及軟骨的影響。方法24只新西蘭兔制造骨關節炎模型后按數表法隨機分為對照組、透明質酸鈉(SH)組、曲安奈德(TA)組,每組各8只,分別進行關節腔注射生理鹽水0.4 mL、SH 0.4 mL、TA 0.4 mL,每周一次,每組6次。6周后觀察每組兔膝關節滑膜組織病理切片、血管滑膜SP法染色、軟骨AB-PAS染色及MMP-1免疫組化。結果滑膜病理切片顯示,SH組滑膜增生最少,TA組滑膜增生較少,對照組滑膜增生明顯;滑膜SP法染色顯示SH組、TA組VEGF陽性細胞百分數較對照組減少[(42.50±5.29)%、(50.80±5.24)%vs(53.38±4.75)%,P<0.05],SH組、TA組平均光密度值較對照組減少[(0.32±0.02)、(0.43±0.04)vs(0.48±0.05),P<0.05],TA組較SH組和對照組內軟骨細胞減少,軟骨基質成分減少,SH組、TA組較對照組軟骨表層破壞減少。SH組、TA組軟骨MMP-1細胞百分數評分優于對照組[(61.25±4.06)%、(76.27±4.68)%vs (87.13±3.64)%,P<0.05];SH組、TA組軟骨Mankins評分優于對照組[(6.88±1.25)分、(7.27±0.68)分vs(8.13±0.83)分,P<0.05]。結論透明質酸鈉和曲安奈德均能抑制滑膜炎增生,減少兔膝關節腔內的炎性細胞因子,減少了軟骨基質的破壞,且透明質酸鈉要優于曲安奈德。
骨性關節炎;關節軟骨;曲安奈德;透明質酸鈉;關節腔內注射
骨關節炎(osteoarthritis,OA)是臨床常見病,其發生率隨著社會老齡化發展日益增高,給家庭以及社會都造成了沉重的負擔[1]。OA治療方法有很多,其中關節腔內藥物注射治療是一種有效和常用的方式,最常用的兩種注射藥物為透明質酸鈉與糖皮質激素[2]。有研究顯示,關節腔內注射藥物應用率從1999年的39%上升至2006年的47%,到2013年降至37.5%[3]。然而,每個新診斷骨關節炎的患者糖皮質激素注射的平均數由0.27升至0.45,透明質酸鈉(sodium hyaluronate,SH)注射的平均數從0.18升至0.36,在這些患者中,69%將糖皮質激素作為一線藥,31%將透明質酸鈉作為一線藥,它們能明顯減輕患者癥狀,但也存在很多爭議,如透明質酸鈉不一定有效、激素可能損害軟骨等,其對軟骨細胞和基質的具體保護作用仍有待研究[4]。
本研究采用新西蘭兔制成兔膝OA動物模型,關節腔內注射SH與曲安奈德(triamcinolone acetonide,TA)以觀察其對關節軟骨及滑膜的影響,為臨床更好評價與選擇關節腔內注射藥物作基礎研究。
1 材料與方法
1.1 實驗動物、藥物試劑及儀器選擇6個月齡雄性新西蘭兔[許可證SYXK(粵)2010-0106],購自西安市迪樂普生物資源開發有限公司,體質量2.0~2.5 kg。主要藥物有:透明質酸鈉(山東正大福瑞達制藥有限公司);曲安奈德(云南昆明積大制藥股份有限公司)。主要試劑:Anti-VEGF抗體(abcam公司,英國)、MMP-1染色劑量盒(北京博奧森生物技術有限公司)。
1.2 造模分組及用藥24只新西蘭兔被制作成兔OA動物模型,方法為將兔左膝用石膏固定于伸直位,范圍為兔踝關節下3 cm至腹股溝下1.5 cm,踝背屈30°~40o,固定時間5周,自由活動與進食。5周去除石膏后按數表法隨機分為對照組、SH組、TA組、每組8只,分別關節腔注生理鹽水0.4 mL、SH 0.4 mL、TA 0.4 mL(含TA1 mg)每周一次,共6次。
1.3 動物處死與取材關節腔內注射6周后采用過量麻醉的方法處死新西蘭兔,打開左膝關節囊取膝關節股骨髁軟骨和內側滑膜并剔除軟組織,生理鹽水沖洗組織,用10%中性甲醛固定,標記分組。滑膜標本行HE染色、VEGF免疫組化SP法染色檢測;軟骨行AB-PAS染色、MMP-1免疫組化檢測。
1.4 實驗方法
1.4.1 滑膜SP法染色檢測用清潔液處理載有滑膜組織的載玻片、烘干,涂多聚L一賴氨酸在擬貼片區域,烤箱55℃~60℃烘烤2 h備用。切片、脫蠟、水化、標記一抗Anti-VEGF抗體、二抗,應用免疫組織化學S-P法測定細胞和組織的抗原,進行染色,再用還原液1 min后自來水沖洗還藍,梯度酒精脫水、透明、封片。各組隨機選8張切片,隨機選擇3個視野(200倍),對VEGF染色陽性細胞進行計數,每個視野細胞計數為100個,取8張細胞計數的平均值。保持染色強度與背景相近,胞膜、細胞漿若為無棕黃色為陰性;胞膜、細胞漿若為棕黃色為陽性。應用圖像分析軟件測量視野中染色陽性細胞,計算其積分光密度值和平均光密度值。
1.4.2 軟骨病理學檢查及Mankin's評分軟骨標本取材后進行按常規行蘇木素-伊紅染色及甲苯胺蘭染色(AB-PAS染色),置光鏡下觀察,AB-PAS染色行Mankin病理學評分[5]。
1.4.3 軟骨MMP-1免疫組化將軟骨蠟塊標本制作組織切片后,脫蠟、脫水,水沖洗,修復抗原5 min,3%過氧化氫處理10 min使內源性過氧化物酶活性抑制,用正常牛血清孵育10 min,封閉抗原甩干,加入濃度1:200的MMP-1,1 h后PBS沖洗,加二抗15 min后PBS再次沖洗,加入二抗孵育30 min后再用三氨基聯苯二胺(DAB)顯色,用水沖洗終止反應,復染后脫水,透明封片,陰性對照采用PBS代替一抗進行實驗,形態計量學研究采用Pelletier等[6]的方法。
1.5 統計學方法應用SPSS19.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,多組間均數比較采用單因素方差分析,其中兩兩比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 滑膜組織學觀察及VEGF的表達對照組滑膜層細胞為4~7層,有的區域形成滑膜絨毛,滑膜下層增厚,膠原纖維成分呈現波浪狀,血管增生明顯(圖1A),VEGF免疫組化染色滑膜下層見血管生成,并見棕褐色染色(圖1B);SH組滑膜層細胞較對照組減少,部分區域滑膜細胞層增多,為2~4層,滑膜下層細胞數量減少,見血管增生明顯,疏松結締組織變薄(圖1C)。VEGF免疫組化染色發現滑膜下層血管區域內皮細胞呈棕褐色染色(圖1D),較對照組減少;TA組滑膜層細胞較對照組減少,滑膜層約為3~5層,滑膜下層細胞數量增多,見血管增生明顯,結締組織和血管大量增生(圖1E),VEGF免疫組化染色顯示滑膜尤其膜下層有大量棕褐色染色(圖1F)。應用圖像分析軟件測量三組染色陽性細胞,計算平均光密度值(MD),見表1。
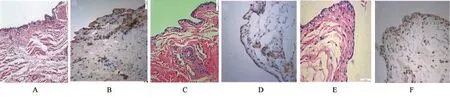
圖1 對照組、SH組、TA組滑膜HE切片與VEGF免疫組化染色圖(×400)
表1 三組新西蘭兔滑膜免疫組化VEGF陽性細胞和平均光密度值比較(±s)
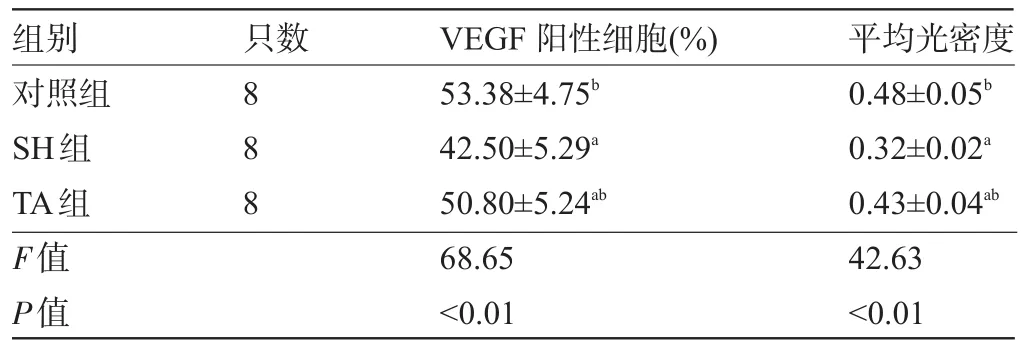
表1 三組新西蘭兔滑膜免疫組化VEGF陽性細胞和平均光密度值比較(±s)
注:與對照組比較,aP<0.05;與SH組比較,bP<0.05。
組別只數VEGF陽性細胞(%)平均光密度對照組SH組TA組F值P值888 53.38±4.75b42.50±5.29a50.80±5.24ab68.65<0.01 0.48±0.05b0.32±0.02a0.43±0.04ab42.63<0.01
2.2 軟骨Mankin's評分和MMP-1細胞比較軟骨AB-PAS染色觀察多糖著色,其中黏液酸性呈藍色,中性呈紅色,混合性呈紫色,細胞核呈藍色,顏色越深,基質成份含量越高。AB-PAS染色片顯示對照組表層結構破壞嚴重,細胞減少(圖2A),SH組結構基本完整,但細胞數量少,顏色主要呈藍色(圖2B),TA組結構基本完整,但細胞數量明顯減少,基質較SH減少(圖2C),進行Mankin's評分。MMP-1免疫組化切片中對照組軟骨結構中基本只見到表層大量胞漿染成深棕色的陽性細胞,其他各層細胞大量凋亡,數量減少,軟骨層變薄(圖2D)。SH組軟骨標本結構中,可見染成深棕色的陽性細胞,在移行層更多并伴軟骨紊亂(圖2E),但軟骨表面呈現一定修復能力;TA組軟骨標本細胞大量凋亡,細胞數量減少,表面細胞胞漿染呈深棕色,整個基質層明顯變薄(圖2F)。三組新西蘭兔軟骨Mankin's評分及MMP-1細胞百分數比較見表2。
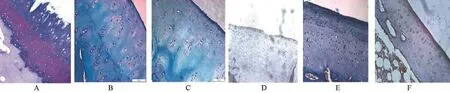
圖2 對照組、SH組、TA組軟骨AB-PAS染色(×400)及MMP-1免疫組化染色(×400)
表2 三組新西蘭兔軟骨Mankin's評分及MMP-1細胞百分數比較(±s)
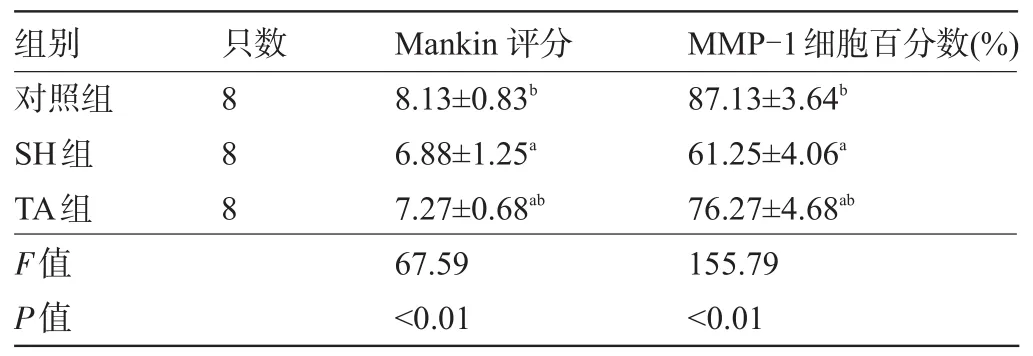
表2 三組新西蘭兔軟骨Mankin's評分及MMP-1細胞百分數比較(±s)
注:與對照組比較,aP<0.05;與SH組比較,bP<0.05。
組別只數Mankin評分MMP-1細胞百分數(%)對照組SH組TA組F值P值888 8.13±0.83b6.88±1.25a7.27±0.68ab67.59<0.01 87.13±3.64b61.25±4.06a76.27±4.68ab155.79<0.01
3 討論
膝OA是一種中老年人的常見病,其主要病理表現為關節軟骨的退化,軟骨結構瓦解,最后失去保護關節的功能。近幾年來的研究顯示軟骨破壞是由多種細胞因子引起金屬蛋白酶活性增高,導致基質破壞。而細胞因子主要由滑膜炎中增生的、功能活躍的滑膜細胞產生的,細胞因子又可刺激滑膜細胞增生,形成惡性循環,加速OA病變[7]。在這個病理發展中,血管內皮生長因子(vascular endothelial growth factor,VEGF)起重要作用。Mabey等[8]研究顯示VEGF在OA患者與正常對照組有明顯差別,局部關節和全身血液中的VEGF含量水平可作為是原發性OA患者的一種生物指標監測[9],不僅如此,膝OA患者的關節滑液VEGF濃度水平與其骨關節炎的超聲結果、放射分級及功能狀態是相關[10],Meta分析顯示患者關節內VEGF水平的升高明顯加速OA的病理進程。
因此OA病理過程是一個復雜的過程,它包括著血管增生、滑膜炎反應、大量細胞因子生成、軟骨破壞等病理表現。在本實驗中,為了更清楚地顯示透明質酸鈉、曲安奈德與對滑膜和關節的影響,我們選擇了觀察滑膜、VEGF的表達、MMP-1的表達及軟骨的功能與結構。結果顯示了透明質酸鈉、曲安奈德相對對照組能減少滑膜細胞增生及VEGF和MMP-1的表達,也能減緩軟骨降解。
在OA的治療中,激素關節腔內注射可以顯著減少關節滑膜組織分泌白細胞介素-1與腫瘤壞死因子α,抑制毛細血管與纖維母細胞增生。在臨床觀察中,一組隨機對照實驗顯示接受激素治療的OA患者WOMAC和VAS評分都有一定提高[11]。在12周的療效觀察中,激素可以減輕OA患者關節疼痛及和腫脹,同時沒有明顯的副作用[12]。一個Mete分析[13]也顯示關節腔內注射激素治療骨性關節炎在1~6周后是否有益仍還不清楚。多個時間點的分析表明,隨著時間的推移,效果降低,并且沒有任何證據顯示在激素注射6個月后仍有效果,也有證據顯示長期使用能導致軟骨或關節的破壞[14],這些研究顯示了激素關節腔內注射治療OA的局限性。
本實驗采用的TA為中效糖皮質激素,其抗炎、抗過敏作用較強且持久,可迅速消除腫痛、緩解癥狀,還可以阻斷MMP的激活與合成[15]。本實驗研究結果顯示曲安奈德也能明顯地減少滑膜細胞,減少炎性細胞因子。但同時,它對滑膜細胞增殖的抑制也影響了正常軟骨細胞的增殖及更新,使關節軟骨結構中軟骨細胞數量明顯減少,甚至比對照組的軟骨細胞還要少。雖然TA短期迅速減輕細胞因子達到減輕疼痛,但從長期效果來看,沒有改善關節軟骨細胞的質量,它同臨床的觀察結果類似。
在軟骨保護劑中,SH補充軟骨基質的HA含量,減少滑液中炎性介質IL-1和MMP-1含量[16],也能減少Coll2-1含量,減少軟骨降解[17],延緩OA進程。它對軟骨彈性的改善明顯比止痛藥物要好,還能減少止痛藥物的副作用,時間長達8周以上[18]。在相關動物實驗中,結果還顯示創傷后立即關節腔內注射HA能減少撞擊導致的細胞凋亡[19],顯示其延緩關節軟骨破壞的良好效果。在本實驗中,我們研究顯示SH組的軟骨表面已經有一些修復的表現,但修復的軟骨基質層與原來的軟骨基質層的結構有一定紊亂,顯示修復的基質質量有待改善。
對于二者的比較,TA比SH能更快地改善膝關節的癥狀。在一個前瞻性、隨機的、雙盲的臨床對照試驗中,對OA患者進行TA、SH關節腔注射,結果顯示在6個月的隨訪中TA在改善膝痛、膝關節功能與活動度上與SH有同樣效果,并且第1周治療明顯改善疼痛,第2周治療明顯改善膝關節功能[20]。SH雖然起效較慢,但作用時間更持久。它減少了阿片類鎮痛藥和NSAIDs的使用,具有更好的風險/收益比,并可能延緩關節置換手術時間達8.7個月[21]。臨床療效顯示比皮質類固醇要慢1~4周,但可維持6~12個月[22]。
綜上所述,本研究顯示兔膝OA關節腔內注射SH與TA短期對關節軟骨都有一定保護作用,尤其能明顯抑制關節滑膜增生,減少關節軟骨的破壞。但從長期觀察,TA無論從延緩病理進程還是改善癥狀方面不一定有良好治療作用,SH則在二方面的效果可能更好,這一點在臨床上也得到一致認識。OA是一個長期的疾病,因此,從二種藥物使用上,本研究顯示SH更適合長期使用來減輕滑膜炎癥及保護軟骨。同時,本實驗的不足之處只觀察了6周,缺乏更長時間的觀察,需要在未來的實驗中進一步研究。
[1]Lawrence JS,Bremmer JM,Ber F.Osto-arthrosis:Prevalence in the population relationship between symptoms and X-ray changes[J]. Ann Rheum Dis,1966,25(1):1-24.
[2]Yu SP,Hunter DJ.Managing osteoarthritis[J].Aust Prescr,2015,38 (4):115-119.
[3]Koenig KM,Ong KL,Lau EC,et al.The use of hyaluronic acid and corticosteroid injections among medicare patients with knee osteoarthritis[J].JArthroplasty,2016,31(2):351-355.
[4]Richards MM,Maxwell JS,Weng LI,et al.Intra-articular treatment of knee osteoarthritis:from anti-inflammatories to products of regenerative medicine[J].Phys Sports Med,2016,44(2):101-108.
[5]Mankin HJ,Lippiello L.Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips[J].J Bone Joint SurgAm,1970,52(3):424-434.
[6]Pelletier JP,Lascau-Coman V,Jovanovic D,et al.Selective inhibition of inducible nitric oxide synthase in experimental osteoarthritis is associated with reduction in tissue levels of catabolic factors[J].J Rheumatol,1999,26(9):2002-2014.
[7]Goldring MB.The role of cytekines as inflammatory mediators in osteoarthritis:Lessons from animal models[J].Connect Tissue Res, 1999,40(1):1-11.
[8]Mabey T,Honsawek S,Saetan N,et al.Angiogenic cytokine expression profiles in plasma and synovial fluid of primary knee osteoarthritis[J].Int Orthop,2014,38(9):1885-1892.
[9]Yuan Q,Sun L,Li JJ,et al.Elevated VEGF levels contribute to the pathogenesis of osteoarthritis[J].BMC Musculoskelet Disord,2014, 15:437.
[10]Kim HR,Lee JH,Kim KW,et al.The relationship between synovial fluid VEGF and serum leptin with ultrasonographic findings in knee osteoarthritis[J].Int J Rheum Dis,2016,19(3):233-240.
[11]Dávila-Parrilla A,Santaella-Santé B,Otero-López A.Does injection site matter?A randomized controlled trial to evaluate different entry site efficacy of knee intra-articular injections[J].Bol Asoc Med P R, 2015,107(2):78-81.
[12]Spolidoro Paschoal NO,Natour J,Machado FS,et al.Effectiveness of triamcinolone hexacetonide intraarticular injection in interphalangeal joints:A 12-week randomized controlled trial in patients with hand osteoarthritis[J].J Rheumatol,2015,42(10):1869-1877.
[13]Jüni P1,Hari R,Rutjes AW,et al.Intra-articular corticosteroid for knee osteoarthritis[J].Cochrane Database Syst Rev,2015,22(10): CD005328.
[14]Raynauld JP,Buckland-Wright C,Ward R,et al.Safety and efficacy of long-term intraarticular steroid injections in osteoarthritis of the knee:a randomized,double-blind,placebo-controlled trial[J].Arthritis Rheum,2003,48(2):370-377.
[15]Herve Z,Joseph P,Christel H,et al.Evaluation of intra-articular delivery of hyaluronic acid functionalized biopolymeric nanoparticles in healthy rat knees[J].Biomed Mater Eng,2010,20(3):235-242.
[16]Henrotin Y,Chevalier X,Deberg M,et al.Early decrease of serum biomarkers of type II collagen degradation(Coll2-1)and joint inflammation(Coll2-1 NO(2)by hyaluronic acid intra-articular injections in patients with knee osteoarthritis:A research study part of the Biovisco study[J].J Orthop Res,2013,31(6):901-907.
[17]Plickert HD,Bondzio A,Einspanier R,et al.Hyaluronic acid concentrations in synovial fluid of dogs with different stages of osteoarthritis[J].Res Vet Sci,2013,94(3):340-350.
[18]Bannuru RR,Natov NS,Obadan IE,et al.Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis:a systematic review and meta-analysis[J].Arthritis Rheum 2009,61(12):1704-1711.
[19]Barreto RB,Sadigursky D,de Rezende MU,et al.Effect of hyaluronic acid on chondrocyte apoptosis[J].Acta Ortop Bras,2015,23(2): 90-93.
[20]Tammachote N,Kanitnate S,Yakumpor T,et al.Intra-articular,single-shot hylan G-F 20 hyaluronic acid injection compared with corticosteroid in knee osteoarthritis:A double-blind,randomized controlled trial[J].J Bone Joint SurgAm,2016,98(11):885-892.
[21]Ong KL,Anderson AF,Niazi F,et al.Hyaluronic acid injections in medicare knee osteoarthritis patients are associated with longer time to knee arthroplasty[J].Arthroplasty,2016,31(8):1667-1673.
[22]Legré-Boyer V.Viscosupplementation:techniques,indications,results [J].Orthop Traumatol Surg Res,2015,101(1 Suppl):S101-108.
Effect of intraarticular injection of sodium hyaluronate and triamcinolone acetonide on cartilage and synovium of osteoarthritis rabbits.
LI Wei1,JIANG Chun-Yan1,WANG Zhan-Wei2,RNE Shi-You2,XIAO De-Ming2.1.Department of Sports Medicine,the Fourth Clinical Medical College of Peking University,Beijing Jishuitan Hospital,Beijing 100035,CHINA; 2.Department of Sports Medicine and Rehabilitation,Peking University Shenzhen Hospital,Shenzhen 518036,CHINA
ObjectiveTo evaluate the effects of intraarticular injection of sodium hyaluronate(SH),triamcinolone acetonide(TA)on cartilage and synovium of osteoarthritis(OA)rabbit models.MethodsAfter the models of OA established,a total of 24 male rabbits were divided into the control group,sodium hyaluronate(SH)group and triamcinolone acetonide(TA)group,with 8 rabbits in each group.The control group,SH group and TA group respectively received intraarticular injection of 0.9%saline 0.4 mL,SH 0.4 mL,TA 0.4 mL one time each week for 6 weeks.After 6 weeks,the synovial tissue biopsy,vascular synovial SP staining,cartilage alcian blue and periodic acid-Schiff(AB-PAS)staining and matrix metalloproteinase-1(MMP-1)immunohistochemistry were observed.ResultsCompared with the control group, the histological observation of synovium showed that SH group had least synovial hyperplasia,and TA group had less synovial hyperplasia.The histological observation of cartilage SP staining showed the percentage of positive cells of VEGF and average optical density in the SH group and TA group were(42.50±5.29)%,(0.32±0.02),(50.80±5.24)%, (0.43±0.04),respectively,which were significantly lower than those in the control group(53.38±4.75)%,(0.48±0.05),respectively(P<0.05).The SH group and TAgroup had less apoptosis of chondrocytes and more integrated structure of matrix compared with the control group.The MMP-1 percentage cartilage cells and cartilage Mankins score of the SH group and TA group were(61.25±4.06)%,(6.88±1.25)%,(76.27±4.68)%,(7.27±0.68),respectively,which were significantly better than those in the control group(87.13±3.64)%,(8.13±0.83),respectively(P<0.05).ConclusionIntraarticular injection of SH and TA can relieve inflammation of OA,alleviate the pathologic process of OA,reduce the destruction of cartilage matrix,and SH better than TA.
Osteoarthritis(OA);Articular cartilage;Triamcinolone acetonide(TA);Sodium hyaluronate(SH); Intraarticular injection
R-332
A
1003—6350(2016)21—3444—04
2016-06-08)
10.3969/j.issn.1003-6350.2016.21.002

