應用手持技術探究碳酸鈉和碳酸氫鈉的性質
霍愛新張 瑜 王皖娣
(天津師范大學教師教育學院 天津 300387)
?
應用手持技術探究碳酸鈉和碳酸氫鈉的性質
霍愛新*張瑜王皖娣
(天津師范大學教師教育學院天津300387)
摘要:碳酸鈉和碳酸氫鈉是鈉的兩種重要化合物,兩種化合物的性質比較是高中化學教學中的一個重點。但是應用常規實驗儀器進行實驗時,發現存在實驗現象不明顯,甚至可能失敗的教學問題。通過溫度傳感器、pH傳感器、二氧化碳傳感器在該實驗中的應用,使實驗現象更明顯,更有利于學生觀察、比較和記憶。
關鍵詞:手持技術;碳酸鈉;碳酸氫鈉
碳酸鈉與碳酸氫鈉的“溶解熱的比較、堿性強弱的比較、與鹽酸反應的速率比較和熱穩定性的比較”是鈉的化合物的主要教學內容。但是在教學中發現,這四組實驗存在以下問題:二者溶解存在熱量變化不明顯的問題,實驗過程中,很難用手感知溫度差異;水溶液都呈堿性,但pH差值不大,用pH試紙測定,堿性強弱不顯著;觀察與酸反應的速率時,反應較快,通過觀察很難判斷氣體放出的快慢;熱分解反應放出的二氧化碳用澄清石灰水檢驗,效果不明顯。手持技術應用于化學實驗中具有數字和圖形結合的特點,利用手持技術對該部分教學實驗進行改進,可以使實驗現象更直觀,更有利于學生的觀察、比較和記憶。
一、實驗藥品和儀器
鹽酸(0.1mol/L)、碳酸鈉(0.1mol/L)、碳酸氫鈉(0.1mol/L)、碳酸鈉和碳酸氫鈉固體、三口燒瓶、量筒、試管、注射器、橡皮塞、膠頭滴管。實驗采用Pasco公司的數字采集器、datastudio數據采集軟件、溫度傳感器、pH傳感器、CO2傳感器。
二、實驗步驟
組裝實驗裝置,將傳感器、數據采集器、計算機及其相對應的軟件相連接。分別做以下四組實驗:
(1)稱取1.68g碳酸氫鈉和2.12g碳酸鈉粉末(等物質的量),分別溶于10mL水,利用溫度傳感器測定其溫度變化。
(2)取0.1mol/L的碳酸氫鈉和碳酸鈉溶液各10mL,利用pH傳感器測定堿性大小。
(3)取0.1mol/L的碳酸氫鈉和碳酸鈉溶液各6mL,分別與10mL0.1mol/L鹽酸反應,利用CO2傳感器測量CO2濃度變化。該實驗用兩個三口燒瓶作為反應容器,一個盛有碳酸氫鈉溶液,一個盛有碳酸鈉溶液,每個三口燒瓶一口連接二氧化碳傳感器,另一口用注射器同時注入鹽酸。實驗裝置如圖1所示。

圖1 碳酸氫鈉溶液和碳酸鈉溶液與鹽酸反應的實驗裝置圖
(4)稱取少量碳酸氫鈉和碳酸鈉固體粉末放入試管中加熱,利用CO2傳感器測量CO2濃度變化。
三、實驗數據分析
1.碳酸氫鈉和碳酸鈉溶解過程溫度變化
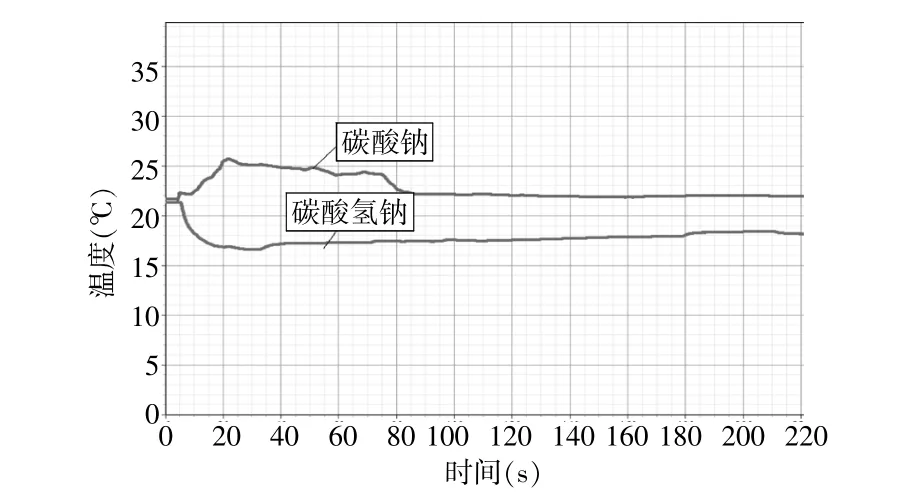
圖2 等物質的量的碳酸氫鈉和碳酸鈉溶解時溫度變化情況
在常規實驗教學中,往往是在試管中溶解振蕩后讓學生用手感知試管底部溫度變化,碳酸鈉溶解放熱溫度略有升高可以感知,但碳酸氫鈉溶解時吸熱,并且熱量變化較小,用手不易感知到。
從圖2中可以看出碳酸鈉溶解時的溫度變化是升高的,碳酸氫鈉溶解時溫度變化是降低的。反應開始顯示室溫約為22℃,迅速將10mL水加入兩種固體中,振蕩溶解,溫度傳感器實時將體系內的溫度變化用圖表的形式表示出來,直觀的可以看出溶解后碳酸鈉溶液溫度高于初始室溫,而碳酸氫鈉溶液低于室溫。傳感器引入實驗教學中,結合實時、直觀的圖表和數字進行解釋說明,可以提高實驗結果的直觀性和數字化,學生更容易理解和記憶。
2.碳酸鈉溶液和碳酸氫鈉溶液pH大小
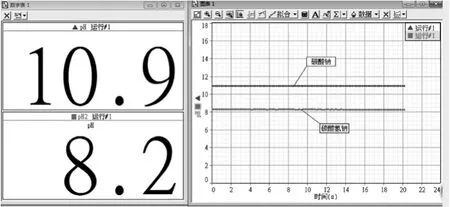
圖3 等物質量濃度的碳酸氫鈉和碳酸鈉溶液的pH變化情況
傳統實驗教學用酚酞溶液或pH試紙測定兩者水溶液的酸堿性,酚酞溶液可以通過溶液的顏色深淺進行定性說明,但是有時酚酞量過多或者溶液濃度不同都會對現象有影響,現象不明顯;用pH試紙測量,由于兩種溶液都呈堿性且pH差值不大,由于pH試紙的精確度不高,數據往往并不明顯。
從圖3中可以看出碳酸鈉溶液的堿性高于碳酸氫鈉溶液。利用pH傳感器測量溶液的pH值,實驗結果數字化、定量、精確,可以將兩組實驗的數據差別更直觀地表示出來。手持技術引進實驗中,可以把原本的定性實驗進行定量化,并且圖表簡單容易理解,數據直觀。
3.碳酸鈉和碳酸氫鈉與酸反應快慢
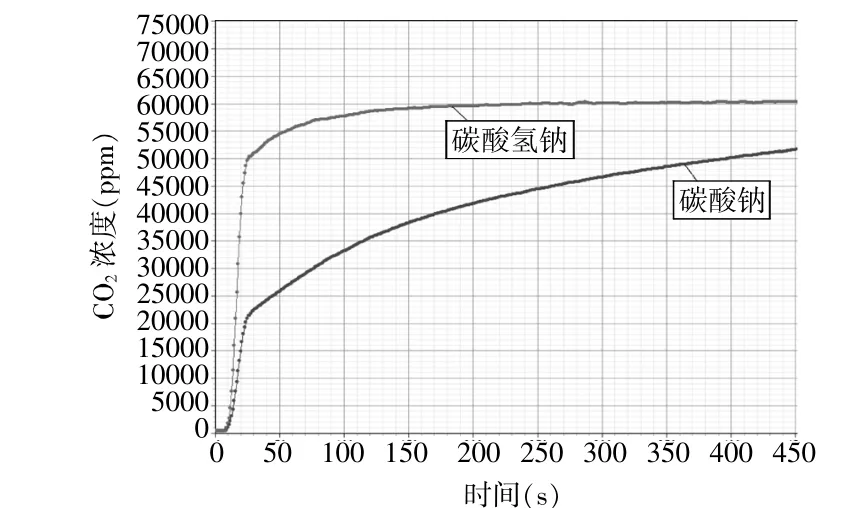
圖4 等物質量濃度的碳酸氫鈉和碳酸鈉與酸反應CO2產生濃度變化情況
傳統的實驗教學中,碳酸氫鈉和碳酸鈉與酸反應,由于現象不明顯,很多教師都進行過實驗改進,大多數都是改進實驗裝置。如在試管內反應,管口套有氣球的裝置,看氣球膨脹大小比較二者反應速率快慢[1],但是也有教師對此實驗改進提出質疑[2]。該實驗特點是反應過快,操作不當容易漏氣或者氣球膨脹效果不明顯。
也有教師用壓力傳感器[3],進行產生氣體的壓力的比較,也很好地說明反應速率,但是需要驗證產生的氣體為CO2,而用CO2傳感器,不需要再驗證產生的氣體是CO2。
用CO2傳感器對體系進行測量,圖4顯示結果碳酸氫鈉與酸反應的過程中測量數值迅速增大,出現曲線的斜率比碳酸鈉與酸反應的大。在圖3中,可以清晰看出碳酸氫鈉在反應過程中放出氣體量快于碳酸鈉。碳酸氫鈉曲線斜率較大,CO2濃度增長遠遠高于碳酸鈉,反應進行2分鐘后碳酸氫鈉產生的CO2量基本穩定,而碳酸鈉產生的CO2量仍然不斷緩慢增長。基于酸過量情況,最后產生的二氧化碳氣體量應該是相同的。利用手持技術,通過圖表曲線變化趨勢可以看出二者明顯的差異性。
4.碳酸氫鈉和碳酸鈉熱穩定性
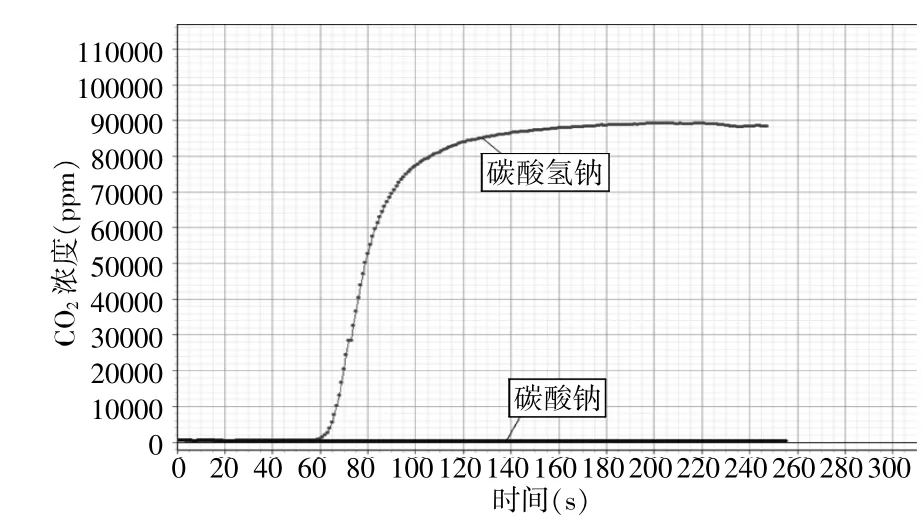
圖5 等質量的碳酸氫鈉和碳酸鈉受熱分解產生CO2濃度大小情況
傳統實驗教學不能直觀地看到二氧化碳的生成,需要用澄清的石灰水驗證,且無法進行直觀比較。
應用手持技術,實驗中用CO2傳感器直接測量碳酸氫鈉和碳酸鈉受熱分解情況。圖5明顯可以看出碳酸鈉受熱后一段時間立即產生CO2,氣體量不斷增加。直觀表明受熱可發生化學變化并證明產生氣體為CO2,而碳酸鈉受熱分解CO2數值無變化。運用該傳感器的優勢可使學生們看出反應產生CO2變化的具體情況,加深對二者性質的本質區別,使實驗更加直觀、具體。
三、實驗小結
在碳酸氫鈉和碳酸鈉性質的學習過程中,通過四組實驗的設計,使用多種傳感器進行實驗。傳感器的數字化、定量化、圖形化、數形結合,使二者的物理性質和化學性質的比較更直觀,易于學生觀察,促進學生理解。
參考文獻
[1]葉珍.碳酸鈉與碳酸氫鈉分別與鹽酸反應的實驗改進[J].文理導航(中旬),2014,1
[2]潘澤新.碳酸鈉和碳酸氫鈉與稀鹽酸反應實驗改進的探索過程[J].第五屆中國教育技術裝備論壇獲獎論文集(中),2014,11
[3]曾珍,鮑正榮.利用“手持技術”比較碳酸鈉和碳酸氫鈉與稀鹽酸反應的速率[J].中小學實驗與裝備,2012,3(22):11-26
doi:10.3969/j.issn.1008-0546.2016.03.032
文章編號:1008-0546(2016)03-0088-02
中圖分類號:G632.41
文獻標識碼:B
*通訊聯系人:E-mail:huoaixin@126.com

