低氧誘導因子短期活化后誘導miR-29c表達上調可延緩5/6腎切除大鼠的腎病進展
梁怡然 衡艷艷 俞小芳 賈平 方藝
(1. 復旦大學附屬中山醫院腎內科,上海 200032;
2. 長治醫學院附屬和平醫院腎內科,山西長治 046000;
3. 上海市腎臟疾病與血液凈化重點實驗室,上海 200032;
4. 上海市腎病與透析研究所,上海 200032)
?
低氧誘導因子短期活化后誘導miR-29c表達上調可延緩5/6腎切除大鼠的腎病進展
梁怡然1Δ衡艷艷2Δ俞小芳1,3,4賈平1,3,4方藝1,3,4
(1. 復旦大學附屬中山醫院腎內科,上海200032;
2. 長治醫學院附屬和平醫院腎內科,山西長治046000;
3. 上海市腎臟疾病與血液凈化重點實驗室,上海200032;
4. 上海市腎病與透析研究所,上海200032)
摘要目的: 探討適度活化低氧誘導因子(hypoxia-inducible factor, HIF)對延緩殘腎慢性腎臟病進展的作用及可能機制。方法: 雄性SD大鼠采用二步法5/6腎大部切除術建立殘腎模型,隨機分為L-mimosine (L-Mim)治療組(術后5~12周短期給予脯氨酸羥化酶抑制劑,隔日50 mg/kg腹腔給藥)和未治療殘腎組,同時設立假手術對照組。術后12周末處死大鼠留取標本。結果: L-Mim治療組大鼠血肌酐水平[(82.4±6.3)比(130.1±24.1) μmol/L, P<0.05]、24 h尿蛋白水平[(0.7±0.1)比(1.7±0.5) g/d, P<0.05]以及殘腎病理改變較未治療殘腎組大鼠有顯著改善。miRNA芯片分析結果提示:L-Mim治療組腎皮質miR-29c豐度高于未治療殘腎組,伴HIF-1α和HIF-2α表達增強。經熒光素酶報告檢測系統和體外突變實驗明確原肌球蛋白1(TPM1)為miR-29c靶基因之一。HK2細胞轉染pre-miR-29c寡核苷酸后可以抑制TGF-β1 (3 ng/mL, 24 h)誘導的原肌球蛋白水平上調(P<0.05或0.01)。結論: 大鼠殘腎腎間質纖維化病變明顯并伴miR-29c水平下調,適度活化HIF水平可通過上調miR-29c表達延緩殘腎功能惡化。
關鍵詞miR-29c;腎小管間質纖維化;低氧誘導因子;原肌球蛋白1
Short-Term Activation of Hypoxia-Inducible Factor Slows Kidney Disease Progression in Rat Model of 5/6 Subtotal Nephrectomy by Up-regulating MiR-29c Expression
LIANGYiran1ΔHENGYanyan2ΔYUXiaofang1,3,4JIAPing1,3,4FANGYi1,3,4
1.DepartmentofNephrology,ZhongshanHospital,FudanUniversity,Shanghai200032,China; 2.DepartmentofNephrology,HepingHospitalAffiliatedtoChangzhiMedicalCollege,Changzhi046000,China; 3.ShanghaiKeyLaboratoryofKidneyandBloodPurification,Shanghai200032,China; 4.ShanghaiInstituteofKidneyandDialysis,Shanghai200032,China
AbstractObjective: To investigate the role and probable mechanism of moderate activation of hypoxia-inducible factor(HIF) in slowing chronic kidney disease progression of remnant kidney.Methods: Rat models of remnant kidney were established by 5/6 subtotal nephrectomy in male Sprague-Dawley rats. And then they were randomly allocated to L-mimosine(L-Mim) treatment group, in which the rats were treated with intraperitoneal injections of L-Mim during 5-12 week after operation, and untreated remnant kidney group. Meanwhile, sham operated rats were set as control group. All rats were sacrificed at the end of week 12, and the specimens were collected. Results: The serum creatinine level in L-Mim treatment group was lower than that in untreated remnant kidney group(82.4±6.3 vs. 130.1±24.1 μmol/L,P<0.05), as well as the 24 h Ualblevel (0.7±0.1 vs. 1.7±0.5 g/d,P<0.05). And the pathological changes in in L-Mim treatment group was slightly improved while compared to untreated remnant kidney group. The result of miRNA microarray analysis showed that miR-29c in renal cortex was up-regulated in L-Mim group compared with untreated remnant group and meanwhile the expressions of HIF-1α and HIF-2α increased. Tropomyosin 1 (TPM1) met the sequence criteria for microRNA-target interaction, which was later confirmed by luciferase reporter system and mutation test in vitro. HK2 cell transfected with pre-miT-29c oligonucleotide could inhibit the tropomyosin up-regulation induced by TGF-β1treatment (3 ng/mL, 24 h),P<0.05 or 0.01.Conclusions: Renal interstitial fibrosis in rat remnant kidney was significant, and it was accompanied by the miR-29c down-regulation. Moderate activation of HIF level may attenuate the deterioration of renal function by up-regulating miR-29c expression.
Key WordsMiR-29c;Renal tubulointerstitial fibrosis;Hypoxia-inducible factor;Tropomyosin-1
腎小管間質纖維化是所有慢性腎臟疾病的共同病理特征,也是各種慢性腎臟疾病進展至終末期腎衰竭的共同途徑[1]。腎小管間質的缺血損傷是導致腎小管間質病變進行性發展的重要機制[2-3],而缺氧又是缺血損傷中的始動環節。因此,作為維持氧自穩平衡的核心調控因子的低氧誘導因子(hypoxia-inducible factor, HIF)在腎臟缺血缺氧損傷中起著重要的調節作用。但HIF本身不能直接感應氧濃度的變化,常氧條件下HIF-α極不穩定,經脯氨酸羥化酶(prolyl-4-hydroxylase domain, PHD)催化發生羥基化,羥基化修飾后的HIF-α迅速與pVHL(von Hippel-Lindau protein)蛋白結合,經泛素蛋白酶體途徑降解。與此相反,低氧狀態下,PHD羥基化HIF-α反應受阻,故HIF-α表達上調[4]。因此,PHD構成了轉錄因子HIF-α低氧誘導功能的開關,前期研究亦證實通過化學方法抑制PHD后可以穩定HIF-α活性[5-6]。
微小RNA (microRNAs,miRNAs) 是一類內源性非蛋白質編碼RNA分子,通過完全/不完全與靶 mRNAs 的3’非翻譯區(3’-UTR)互補結合,剪切靶 mRNAs或抑制其翻譯,從而調控細胞的多種生物學行為。miRNAs在缺氧導致的一系列生理或病理反應中起重要調節作用[7],尤其是一簇冠名為低氧相關的miRNAs,即HRMs(hypoxia-regulated microRNAs)在HIF介導的缺血缺氧損傷的即時和長期適應性反應中起重要作用[8]。目前認為HIF對下游基因的調控有兩條途徑:一是經典途徑,HIF對下游基因表達的直接調控;二是近年來發現的新途徑,HIF通過調控缺氧調節的microRNAs (hypoxia-regulated microRNA, HRMs)來間接調控靶基因。單一miRNAs可調控一組相關基因的表達,并且HRMs在轉錄后水平影響基因翻譯,不涉及靶基因轉錄,直接影響靶基因蛋白表達水平[9]。在HIF的基因調控中,HRMs途徑可能起著更為重要的作用,而以HRMs為靶點的干預可能成為新的更有效的治療手段。本研究在以往研究的基礎上,以5/6腎大部切除(5/6Nx)大鼠為體內模型,嘗試從miRNA調控的新角度揭示慢性腎功能不全(CKD)進展的發病機制。
1資料與方法
1.1主要試劑及細胞培養小鼠抗雞TPM1抗體(美國Sigma公司),兔抗大鼠HIF-1α和HIF-2α多克隆抗體(美國Abcam公司),HRP標記的鼠抗小鼠IgG(美國Jackson公司),HRP標記的山羊抗兔IgG(上海碧云天生物技術有限公司)。 Oligofectamine轉染試劑(美國Invitrogen公司), pre-miR-29c Oligo、pre-negative control、control anti-miR、pRL-TK internal control plasmid購自美國Ambion公司。 Taqman miRNA RT kit、Taqman Universal PCR master mix、no UNG、Taqman miRNA assay (rno-miR-29和U6)均購自美國ABI公司。細胞培養:根據不同的實驗要求選擇DMEM、Opti-MEM I (美國Gibco公司)等細胞培養液。
1.25/6腎切除模型的建立清潔級Sprague-Dawley雄性大鼠,體質量180~200 g,購自復旦大學上海醫學院實驗動物中心,按復旦大學實驗動物應用和管理委員會的要求飼養。大鼠進食標準食物,自由飲水。適應性飼養1周后,4% 戊巴比妥鈉(40 mg/kg)腹腔內注射麻醉,先弧形切除左腎上、下極各1/3,1周后再進行右腎全切除,建立5/6腎大部切除的CKD大鼠模型。建模后第1周末,選取存活的大鼠隨機分組。大鼠隨機分組如下(n=5):未治療的對照組(vehicle control),即單純5/6腎切除術組;L-mimosine(L-Mim治療組,L-Mim治療時間為腎切除術后第5至12周(L-Mim wk 5-12)。另設假手術組,大鼠僅接受2次腹腔打開/縫合手術。所有大鼠觀察12周后統一處死,留取大鼠腎臟組織進行后續研究。
1.3大鼠24 h尿微量白蛋白和腎功能測定各組大鼠處死前24 h將其置入代謝籠中,自由進食和飲水,收集24 h尿液,記量后分裝,-80℃保存。ELISA法測定尿微量白蛋白濃度,結合24 h尿量計算出24 h尿微量白蛋白定量(24 h Ualb)。處死時心臟穿刺采血,分離血清,酶法測定血清肌酐(Scr)濃度,尿素酶-GLDH法測定尿素氮(BUN)濃度。
1.4大鼠腎臟組織學檢查腎組織經10%中性緩沖甲醛溶液固定過夜,梯度乙醇脫水、二甲苯透明、石蠟包埋、切片(厚度為2 μm)后,常規PAS染色分析。腎小球硬化和腎小管間質損傷采用半定量評分[10]。
1.5Western印跡檢測抽提殘腎皮質總蛋白或HK2細胞胞質蛋白,BCA法進行蛋白質定量。每泳道20 μg蛋白,10% SDS-PAGE電泳分離后濕轉至PVDF膜,2%BSA+5%脫脂奶粉封閉4℃過夜,次日加一抗室溫孵育2 h,洗膜,加相應二抗室溫孵育1 h,最后用增強化學發光系統顯色,圖像分析系統灰度掃描。
1.6差異表達miRNA的芯片篩查及功能驗證
1.6.1miRNA芯片檢測采用Agilent的大鼠miRNA芯片比較L-Mim治療組和單純5/6 Nx組腎皮質miRNAs的表達差異。該芯片包含350個大鼠相關的miRNAs。標本處理、檢測和芯片數據分析由生物芯片上海國家工程研究中心完成。2組大鼠腎組織(每組各4只),提取RNA,質檢后上樣芯片分析(Agilent Technologies, Santa Clara, CA,芯片參考Sanger database v10.1,標記350種大鼠相關的miRNAs探針)。差異miRNAs的篩選條件為:P值<0.05,錯誤發現率(FDR)<5%,2組間變化倍數大于1.5。
1.6.2miR-29c對應靶基因的熒光素酶活性檢測通過miRNA靶預測數據庫查詢,預測差異rno-miR-29c對應的靶基因。在此基礎上,通過PCR方法,將miR-29c預測靶基因原肌球蛋白α(TPM1)的3’-UTR區域擴增,并將擴增產物克隆至pRL-TK internal control plasmid (美國Ambion公司)。隨后再轉染至HeLa細胞。48 h后觀察熒光素酶活性(以β-半乳糖苷酶為熒光內參),以control pre-miR為對照。采用ABI的Dual-Light系統測量熒光素酶活性。
1.6.3Real-time PCR測定miR-29c的表達 采用real-time PCR進行定量分析,選擇Taqman化學檢測法(美國Applied Biosystems公司) 進行檢測,U6作為內參。反轉錄采用TaqMan miRNA RT Kit,熒光定量PCR采用TaqMan Universal PCR master mix,no UNG試劑盒,各反應體系20 μL。選擇miR-29c特異性引物。參數設定參照供應商提供的數據。
1.6.4細胞培養及基因轉染HK2細胞購自美國ATCC細胞庫,用KSF不含血清的培養液培養。置37℃細胞培養箱(5% CO2)內培養。實驗細胞為10代以內。采用Oligofectamine轉染pre-miR-29c Oligo/pre-miR-negative control (Oligo最終濃度100 nmol/L)。轉染24 h/48 h后提取細胞RNA/胞質蛋白。
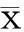
2結果
2.1大鼠殘腎腎功能和病理改變腎切除各組大鼠在體質量和收縮壓方面差異無統計學意義。與未治療組相比,L-Mim治療組大鼠血清BUN和Scr降低,24 h尿白蛋白排泄減少,Hb增加,差異有統計學意義(P<0.05或0.01,表1)。組織學分析結果顯示L-Mim治療組腎臟病理表現輕,腎小球硬化指數和腎小管間質損傷指數均低于未治療組(表1、圖1)。

A:假手術組; B:L-Mim治療組;C:單純5/6腎切除術組。Masson染色(×200)圖1 大鼠腎組織的病理改變

項目假手術組未治療組L-Mim治療組Scr(μmol/L)23.4±2.8130.1±24.1▲▲82.4±6.3**▲▲BUN(mmol/L)5.1±0.433.4±4.0▲▲16.7±2.7**▲▲24hUalb(mg/d)0.3±0.11.7±0.5▲▲0.7±0.1▲Hb(g/L)145.0±6.9100.2±7.6▲▲118.6±12.7*▲腎小球硬化指數0.0±0.03.1±0.3▲▲2.1±0.3**▲腎小管間質損傷0.0±0.04.9±0.6▲▲3.0±0.3**▲
注:Scr:血清肌酐; BUN:血清尿素氮;Ualb:尿白蛋白排泄率;Hb:血紅蛋白。與未治療組比較,*P<0.05,**P<0.01;與假手術組比較▲P<0.05,▲▲P<0.01
2.2L-Mim治療對HIF-1α和HIF-2α的活化程度的影響術后12周,單純手術組和L-Mim治療組腎組織HIF-2α的蛋白水平均高于假手術組,但L-Mim治療組腎組織HIF-1α水平高于對照組和假手術組(圖2)。結果提示術后5~12周的L-Mim治療可穩定HIF-1α和 HIF-2α的表達。

S:假手術組;C:對照組;L:L-Mim治療組圖2 術后12周各組大鼠腎臟HIF-α的蛋白表達水平
2.3L-Mim治療組和未治療組大鼠腎皮質miRNAs表達差異芯片分析結果顯示共有9種miRNAs表達異常,其中rno-miR-22*、rno-miR-345-5p、rno-miR-29c*和rno-miR-29c的豐度在L-Mim治療組中上調,rno-miR-872、rno-miR-130b、rno-miR-450a、rno-miR-24和rno-miR-25的表達豐度在L-Mim治療組表達下調(表2、圖3A)。由于miR-29c差異在兩組間差異變化最為明顯(L-Mim干預后上調3.14倍),且miR-29家族對應的靶基因中包含較多與細胞外基質相關的基因,故選擇miR-29c為研究的靶點。

表2 L-Mim治療組和單純手術組

A:Agilent microRNA microarray分析結果顯示9種miRNAs表達異常,其中4種miRNAs在L-Mim治療組上調,5個下調;B:大鼠5/6腎臟切除后,腎組織miR-29c水平表達下降,L-Mim干預后可部分逆轉miR-29c表達下調;C:L-Mim可上調殘腎rno-pri-miR-29 b2/c的豐度
圖3L-Mim干預可部分逆轉殘腎組織miR-29c的表達水平
2.4miR-29c差異表達的再驗證及對應靶基因的預測和功能驗證
2.4.1miR-29c表達差異的再驗證分別取與芯片送檢樣本不同批的3組大鼠腎皮質組織,提取RNA后,檢測假手術組、單純5/6腎切除以及L-Mim治療組腎皮質miR-29c及其前體pri-miR-29b2/c表達豐度。假手術組miR-29c水平高于5/6腎切除組,后兩組中,L-Mim組miR-29c水平高于未治療殘腎對照組;假手術組腎組織pri-miR-29b2/c的豐度處于低平狀態,L-Mim干預后殘腎組織pri-miR-29b2/c表達較對照組和假手術組明顯上調。同時比較了miR-29家族的其他兩個成員——miR-29a和miR-29b的表達豐度,發現miR-29a和miR-29b的變化趨勢與miR-29c相似,但差異無統計學意義。見圖3B、3C。
2.4.2miR-29c靶基因的預測通過TargetScan (http:∥www.targetscan.org/)、PicTar (http:∥pictar.bio.nyu.edu/)、miRanda (http:∥microrna.sanger.ac.uk/targets/v4/)等運算方法,預測了miR-29c對應的與細胞外基質相關的靶基因(表3)。

表3 miR-29c對應的靶基因
注:at/c, L-Mim治療組/單純手術組;bNA:在數據庫中未搜索到目的miRNAs的信息
2.4.3熒光素酶報告系統驗證原肌球蛋白-α為miR-29c對應靶基因熒光素酶基因報告系統證實:TPM1為miR-29c對應的新靶基因,突變實驗進一步證實了TPM1與miR-29c對應關系 (圖4A)。

A:MiR-29c作用于TPM1的3’-UTR區,將含TPM1基因的3’-UTR序列(誘導突變或未突變)的熒光素酶報告基團、pRL-TK internal control質粒、對照pre-miR寡核苷酸和miR-29c mimic共轉染至HeLa 細胞,MiR-29c mimic降低了與TMP1 3’-UTR相連的熒光素酶報告基團的熒光強度,但不明顯降低TPM1 3’UTR突變后的熒光強度(*P<0.01 vs pre-miR negative control, n=5);B:大鼠5/6腎切除術后殘腎組織的原肌球蛋白(TM)的蛋白水平上調,L-Mim干預可以抑制TM的表達上調。Lane 1-3: L-Mim治療組; lane 4-6:殘腎對照組; lane 7-9: 假手術組圖4 TPM1為miR-29c對應的靶基因
2.4.4miR-29c與TPM1的功能驗證 將人腎小管上皮細胞HK2細胞在含有TGF-β1(3 ng/μL)的培養液內孵育30 min后,分別轉染pre-miR-29c和pre-miR-negative control,24 h后收集RNA或48 h后收集蛋白標本。Real-time PCR結果顯示TGF-β1處理后的細胞miR-29c的表達水平下降80%左右(P<0.05),圖5A),CoCl2化學誘導HIF活化后(數據未顯示)可部分逆轉TGF-β1引起的miR-29c表達下調(圖5B)。Pre-miR-29c+TGF-β1組miR-29c的平均表達豐度為對照組(pre-miR-negtive control+ TGF-β1)的2 256倍,為單純TGF-β1處理組的1.25×106倍。比較pre-miR-29c+ TGF-β1組和pre-miR-negtive control+TGF-β1組細胞轉染48 h后TPM1的蛋白表達,前者TM2/3的表達較后者下降19.6%(n=5,P<0.01, 圖5C)。動物實驗觀察到,L-Mim治療組大鼠腎皮質TM的表達雖高于假手術組,但低于未治療對照組(圖4B)。
3討論
越來越多的證據表明,腎小管間質的慢性缺氧可能是各種慢性腎臟疾病包括腎小球疾病進展為終末期腎病的共同致病通路[1-2]。5/6腎切除的殘腎模型是經典CKD模型之一,我們前期的研究發現,5/6腎切除后殘腎組織的HIF-1α和HIF-2α的蛋白表達上調,至術后第4~6周達到峰值,隨后緩慢降低[11]。因此選擇術后第5周進行干預,是因為一方面腎小管上皮細胞代償性增生此時達到高峰,腎小管未出現萎縮和擴張,間質也沒有明顯纖維化;另一方面HIF-α亞單位在殘腎中的表達也達到了暫時性的高峰,并趨于下降。我們的研究結果也驗證了上述假設,術后12周時,與未治療組相比,L-Mim治療明顯降低了大鼠BUN和Scr等生化指標,減輕了殘腎的小管間質損傷并降低24 h的尿白蛋白排泄率。作為酮戊二酸類似物的L-Mim是眾多PHD抑制劑中的一種,后者通過抑制HIF-1α或HIF-2α與pVHL的結合達到穩定和活化HIF。我們推測,進展期L-Mim的腎臟保護作用可能通過適時上調HIF-α亞單位從而選擇性活化VEGF、HO-1和Glut-1等具有腎保護作用的靶基因,使得代償性增生的腎小管上皮細胞耐受缺氧而延遲進入小管萎縮和間質纖維化[8]。

A:TGF-b1下調miR-29c豐度(*P<0.05 vs vehicle treated)。B: CoCl2逆轉TGF-β1誘導的miR-29c表達下調;cHK2在接受TGF-β1(3 ng/mL)處理前24 h,預先培養于含或不含CoCl2 (200 μmol/L)的培養液(n=6, *P<0.05 vs 單純TGF-β1處理組)。C:miR-29c mimics抑制TGF-β1誘導的TM水平上調,每條泳道的蛋白經考馬氏亮藍染色后定量,并作為TM蛋白的內參(n=5, #P<0.05 vs pre-miR-Neg)圖5 MiR-29c表達下調可能參與TGF-β1誘導的TPM1表達上調
miRNAs是重要的基因調控因子,其異常表達可導致疾病的發生發展。miRNAs參與調控人類以及嚙齒類動物(大鼠和小鼠)腎臟正常生理過程的狀態已有文獻報道,新近的研究發現,某些miRNAs的異常表達與一些腎臟疾病的發病關聯,如miR-192和miR-377的表達異常與糖尿病腎病發病相關,miR-15a參與多囊腎發病等。本研究通過高通量芯片分析發現,miR-29c的表達與慢性腎臟病(CKD)進展負相關,體內和體外實驗先后證實了:大鼠殘腎模型中觀察到腎組織miR-29c水平與腎小管間質纖維化程度、Scr和尿蛋白水平負相關;在模擬腎小管間質纖維化體外模型中,當TGF-β1誘導HK2細胞發生上皮間質轉化(EMT)[12]時,細胞miR-29c水平顯著下降。生物信息學的進一步研究發現miR-29c對應的靶基因包括了各型膠原、FBN1等與細胞外基質相關的基因,而miRanda、PicTar和TargetScan等數據庫的檢索結果提示TPM1也是miR-29c的靶基因之一,并經熒光素酶報告系統和突變實驗證實。
原肌球蛋白是細肌絲中與肌動蛋白結合的蛋白,不僅是肌肉收縮過程中的重要調節蛋白,也參與細胞骨架的構成[13]。迄今為止,哺乳動物中的4個TM基因已經被確認,分別命名為TPM1、TPM2、TPM3和TPM4。TM主要分為兩大類,含248~291個氨基酸殘基的相對高相對分子質量組(high molecular weight,HMW)和含245~251個氨基酸殘基的低相對分子質量組(low molecular weight, LMH),其中TPM1,即α基因編碼的為HMW的TM,主要包括TM6(40 000)、TM2(36 000)和TM3(34 000),TPM1除編碼骨骼肌的α-TM外,還編碼平滑肌α-TM等其他幾種同型異構體。在一些慢性疾病模型中,也證實TPM1參與了上皮細胞張力纖維的生成[13-15]。
成纖維細胞和上皮細胞均可表達TPM1編碼的HMW——原肌球蛋白TM2、TM3和TM6以及TPM2編碼的TM1。我們早先的研究發現TGF-β1誘導腎小管上皮細胞發生EMT時TPM1表達增強[12]。原肌球蛋白是穩定肌動蛋白,是調控細胞內張力纖維以及維系細胞骨架的重要成分之一。TPM1伴隨EMT發生而表達上調的現象提示TPM1水平可能影響上皮細胞的緊密連接和極性,后者也參與病理狀態下的細胞骨架重構。在本研究中我們觀察到大鼠5/6腎大切后,腎組織TPM1的表達隨腎功能的惡化而上升,經L-Mim短期治療后,腎功能改善、尿蛋白減少的同時,也伴隨TPM1表達下調,其中TM6經L-Mim治療后明顯下調,其蛋白表達水平隨病情的改善而部分下調,提示TPM1的高表達與CKD進展和腎小管間質纖維化的發病可能相關。本研究進一步發現,HK2細胞轉染miR-29c的前體寡核苷酸(pre-miR-29c)使miR-29c的過量表達后,Western印跡結果表現為TM2蛋白水平明顯下降,提示在CKD的進展過程中伴隨miR-29c表達下調,適時給予PHD抑制劑增加HIF表達后可部分逆轉殘腎組織CKD進展所致的miR-29c表達下調。TPM1是miR-29c對應的靶基因之一,前者與張力纖維生成、細胞骨架重構相關,可能是防治腎小管間質纖維化、延緩CKD進展的靶目標之一。但TPM1不同異構體在腎病進展中的作用仍有待進一步探索。
本研究結果提示L-Mim可延緩CKD進展,尤其在小管間質出現明顯損傷之前開始干預效果更明顯,可能的機制與上調miR-29c表達相關。與其他PHD抑制劑如 3,4-DHB和S956711 相比,L-Mim在有效治療濃度范圍內無毒性作用,其出現最大毒性的濃度是最大有效濃度的 2 倍以上[16],是有前景的誘導慢性缺氧耐受、延緩CKD進展的藥物之一。關于藥物的最佳干預時機、劑量以及相關作用機制仍有待于進一步闡明。
參考文獻
[ 1 ]Nangaku M. Hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure[J].Nephron Exp Nephrol,2004,98(1):e8-e12.
[ 2 ]Tanaka T, Nangaku M.The role of hypoxia, increased oxygen consumption, and hypoxia-inducible factor-1 alpha in progression of chronic kidney disease[J].Curr Opin Nephrol Hypertens,2010,19(1):43-50.
[ 3 ]俞小芳,丁小強,朱加明,等. 5/6腎切除大鼠低氧誘導因子1α和2α在腎內的表達和定位[J].中華腎臟病雜志,2010, 26(9):689-695.
[ 4 ]Maxwell PH. Hypoxia-inducible factor as a physiological regulator[J].Exp Physiol,2005, 90(6): 791-797.
[ 5 ]張曉麗,劉紅,鄒建洲,等.低氧誘導因子1α高表達對小鼠急性缺血性腎損傷的影響[J].中華腎臟病雜志, 2007,23(7):448-452.
[ 6 ]陳越,蔣素華,朱加明,等.小分子RNA干擾沉默缺氧誘導因子1α加重缺氧狀態腎小管上皮細胞的生長抑制和壞死[J].中華腎臟病雜志, 2010,26(7):562-563.
[ 7 ]Liang M, Liu Y, Mladinov D, et al. MicroRNA: a new frontier in kidney and blood pressure research[J].Am J Physiol Renal Physiol,2009,297(3):F553-F558.
[ 8 ]Hua Z, Lv Q, Ye W, et al. MiRNA-directed regulation of VEGF and other angiogenic factors under hypoxia[J].PLoS One,2006,1:e116.
[ 9 ]Makeyev EV, Maniatis T. Multilevel regulation of gene expression by microRNAs [J], Science. 2008, 319(5871): 1789-1790.
[10]Maric C, Sandberg K, Hinojosa-Laborde C. Glomerulosclerosis and tubulointerstitial fibrosis are attenuated with 17beta-estradiol in the aging Dahl salt sensitive rat[J].J Am Soc Nephrol,2004, 15(6):1546-1556.
[11]Yu X, Fang Y, Ding X, et al. Transient hypoxia-inducible factor activation in rat renal ablation and reduced fibrosis with L-mimosine[J].Nephrology (Carlton),2012,17(1):58-67.
[12]Kriegel AJ, Fang Y, Liu Y, et al. MicroRNA-target pairs in human renal epithelial cells treated with transforming growth factor beta 1: a novel role of miR-382[J].Nucleic Acids Res,2010,38(22): 8338-8347.
[13]Houle F, Poirier A, Dumaresq J, et al. DAP kinase mediates the phosphorylation of tropomyosin-1 downstream of the ERK pathway, which regulates the formation of stress fibers in response to oxidative stress[J].J Cell Sci,2007,120(Pt 20):3666-3677.
[14]Zheng Q, Safina A, Bakin AV. Role of high-molecular weight tropomyosins in TGF-beta- mediated control of cell motility[J].Int J Cancer,2008,122(1):78-90.
[15]Morita T, Mayanagi T, Sobue K. Dual roles of myocardin-related transcription factors in epithelial mesenchymal transitionvia slug induction and actin remodeling[J].J Cell Biol,2007,179 (5):1027-1042.
[16]Warnecke C,Griethe W,Weidemann A,et al.Activation of the hypoxia-inducible factor-pathway and stimulation of angiogenesis by application of prolyl hydroxylase inhibitors[J]. FASEB J,2003,17(9):1186-1188.
中圖分類號R692
文獻標志碼A
通訊作者方藝,E-mail: fang.yi@zs-hospital.sh.cn;賈平,E-mail: JPwxl999@126.com
基金項目:國家自然科學基金資助項目(編號:81200557;81430015);上海市科學技術委員會基金項目(編號:14DZ2260200)
Δ梁怡然和衡艷艷對本文有同等貢獻,為共同第一作者。
·論著·

