SPG膜乳化法制備載BSA的PLGA微球的工藝考察
萬斯斯,楊琪,鐘晨,羅宇燕,張永明
(1.中山大學附屬第三醫院 藥劑科,廣東 廣州 510630; 2.中山大學 藥學院,廣東 廣州 510006)
?
SPG膜乳化法制備載BSA的PLGA微球的工藝考察
萬斯斯1,楊琪1,鐘晨2,羅宇燕1,張永明1
(1.中山大學附屬第三醫院 藥劑科,廣東 廣州 510630; 2.中山大學 藥學院,廣東 廣州 510006)
目的 采用SPG膜乳化法,制備載蛋白藥物的聚乳酸聚乙醇酸(PLGA)微球,并對其形態學性質、載藥量、體外釋藥進行考察。方法 以血清白蛋白(BSA)為模型藥物,PLGA作為載體材料,采用SPG膜乳化技術結合復乳溶劑揮發法制備微球;分別考察初乳勻漿轉速、內水相體積、膜擠出壓力、外/內水相加鹽等因素對微球質量的影響。結果 以優化處方制備的載藥微球形態圓整、粒徑均一,平均粒徑為(55.51±0.24)μm,載藥量、包封率分別為7.70%和69.33%,緩釋時間達到40 d。結論 本研究獲得了SPG膜乳化法制備BSA-PLGA緩釋微球的新工藝。
SPG膜乳化法; PLGA; 緩釋微球
近年來,隨著生物科技的迅猛發展,越來越多療效顯著的蛋白、多肽類藥物被開發上市。由于這類藥物穩定性差、口服易降解,凍干粉針類制劑仍是其傳統劑型,但難以解決半衰期短,需頻繁、長時間注射給藥的缺點,導致臨床應用受到限制。利用生物可降解的新型聚合物材料為載體材料[1],將蛋白多肽類藥物制成微球注射劑,可達到體內持久緩釋,減少給藥次數,顯著增加患者用藥順應性的目的。聚乳酸聚乙醇酸(PLGA)以良好的生物相容性受到很多學者的關注,已有多種以PLGA為載體的緩控釋藥物上市。
SPG膜(shirasu porous glass membrane)是日本SPG公司開發的新型無機膜,膜孔徑微小均勻且可控[2],原理是分散相在N2壓力的作用下透過微孔膜的膜孔而在膜表面形成液滴,在沿膜表面不斷攪拌的外水相溶液的沖洗作用下,液滴的直徑達到臨界值后,就從膜表面剝離,從而形成乳液,再結合溶劑揮發法固化后即可得到粒徑均一可控的微球。本課題組采用SPG膜乳化法,以生物可降解的新型共聚物材料PLGA為載體材料制備BSA微球,達到緩釋40 d的效果。前期研究考察了內、外水相體積對微球內外形態、藥物分布和釋放的影響[3],本文以包封率、載藥量、突釋率、體外釋藥行為等為評價指標,進一步考察初乳勻漿轉速、內水相體積、膜擠出壓力、外/內水相加鹽等因素對微球質量的影響,為SPG膜乳化法應用于蛋白類藥物緩釋微球的研究奠定基礎。
1 儀器與試藥
1.1 儀器
MG-20外壓式SPG膜乳化器(日本SPG公司);T25高速勻漿器(美國IKA公司);JSM-6330F冷場掃描電鏡(日本電子公司);RW16電動攪拌器(美國IKA公司);SL16/40(R)冷凍離心機(美國Thermo 公司);Precisa 92SM-202A電子天平(瑞士Precisa公司);SHZ-82B恒溫水浴振蕩器(江蘇正基儀器有限公司);TGL-18C臺式高速離心機(上海安亭科學儀器廠)。
1.2 試藥
牛血清白蛋白(BSA,美國Genview公司);聚乳酸聚乙醇酸共聚物(PLGA,美國伯明翰公司);聚乙烯醇124(PVA,上海展云化工有限公司);二氯甲烷(DCM,天津市富宇精細化學品有限公司);BCA蛋白定量試劑盒(美國Pierce公司)。
2 方法
2.1 微球的制備
稱取適量BSA粉末,加入適量F68溶液充分溶解作為內水相。再與一定濃度PLGA的DCM溶液混合后,在冰浴條件下高速勻漿制成初乳。再將初乳作為分散相轉移至SPG膜乳化器的儲油罐內,通過N2加壓的作用下透過SPG膜的膜孔,進入不斷攪拌的PVA外水相溶液中從而形成復乳。低溫條件下低速攪拌3 h使微球固化完全,離心收集,純化水洗滌3次后冷凍干燥,即得。
2.2 微球載藥量和包封率的測定[4]
精密稱取載藥微球約10 mg至7 mL離心管,加入0.1 mol/L NaOH-2%SDS溶液5.0 mL。置于37 ℃水浴箱內恒速振蕩48 h使微球完全裂解,13 000 r/min離心 5 min 后,取上清液進行BCA法蛋白含量測定。同法處理空白微球的裂解液作為背景校正。按公式“載藥量=微球中含藥量/微球的總質量×100%”和“包封率=實際載藥量/理論載藥量×100%”分別計算微球的載藥量和包封率。
2.3 微球的體外釋放[4]
精密稱取微球50 mg,加入10 mmol/L pH 7.4緩沖液1.5 mL,置于(37±5) ℃恒溫水浴搖床中,以100 r/min勻速振蕩,分別于5、12 h和1、2、4、7、10、15、20、25、30、35、40 d取出,13 000 r/min離心5 min,將上清液全部取出,加入新鮮的PBS。用BCA法測定上清液蛋白含量,同法處理空白微球作為空白對照,計算不同時間點蛋白釋放量。
2.4 微球的形態特征
2.4.1 微球形態、粒徑大小 使用馬爾文激光粒度儀測定微球的粒徑分布及平均粒徑。本試驗采用干法測量,干法進樣器為Scirocco2000A,遮光度為0.5-6,測量時間為8~10 s,分散氣壓為3.5×105Pa。
2.4.2 微球的形態觀察 將冷凍干燥后的微球均勻分散在貼有導電膠的載樣臺,置于真空條件下,噴上金粉。利用冷場掃描電子顯微鏡在電子束強度為10 kV的條件下觀察微球表面及內部形態。
3 結果
3.1 SPG膜乳化法制備微球的處方考察
3.1.1 初乳勻漿轉速對微球質量的影響 初乳的穩定性是SPG膜乳化法中影響微球理化性質最重要的因素之一。初乳制備過程中,勻漿轉速會顯著影響初乳的穩定性。本文在預試驗的基礎上,固定其他各參數,其中聚合物質量分數為15%、膜孔徑為5 μm、擠出壓力為30 kPa,分別考察初乳勻漿轉速為5 000、10 000、15 000、20 000 r/min對微球質量的影響,結果見表1。可見,隨著初乳勻漿轉速加快,載藥量、包封率顯著增大,突釋率逐漸降低。當轉速升至15 000 r/min和20 000 r/min時,包封率增至67.91%和71.61%,突釋率降低至39.23%和31.75%。進一步考察該因素對微球的體外釋藥行為的影響,分別測定不同時間的釋藥量,以時間為橫坐標、累積釋放率為縱坐標繪制曲線(圖1)。結果可見,15 000 r/min在1 d內的累積突釋率(39.23%)雖然大于20 000 r/min(31.57%),但后者在40 d累積釋放率僅為54.07%,而前者40 d累積釋放超過75%,并且2~40 d范圍內以均勻的速度釋放藥物,緩釋時間較長。綜合以上結果,選擇最適初乳攪拌速度為15 000 r/min。
表1 初乳勻漿轉速對微球質量的影響


初乳勻漿轉速/(r·min-1)載藥量/%包封率/%突釋率/%50004.92±1.0344.3165.26±3.42100006.26±0.9256.3853.13±1.57150007.55±0.4067.9139.23±0.92200007.96±0.7171.6131.57±1.35

圖1 初乳勻漿速度對微球體外釋放的影響
Figure 1 The effect of rotational speed on the release from microspheres (n=3)
3.1.2 不同內水相體積對微球質量的影響 固定油相體積為4 mL,初乳攪拌速度為15 000 r/min,膜孔徑為5 μm,擠出壓力為30 kPa,分別考察內水相體積為150、300、600 μL對微球質量的影響,結果見表2。可見,當內水相體積由150 μL增加至300 μL時,微球的載藥量、包封率增大,但繼續增加至600 μL時,包封率反而下降,突釋率隨著內水相體積的增加而逐漸增大。從圖2的體外釋放行為可見,內水相體積為150 μL時,突釋率雖低,但40 d累積釋放量不到50%;比較內水相體積為300 μL和600 μL的微球,40 d累積釋放量相差不大,但前者突釋率明顯低于后者。綜合以上結果,選擇內水相體積為300 μL。
3.1.3 不同膜擠出壓力對微球質量的影響 固定其他參數,采用膜孔徑為5 μm的SPG膜,分別考察擠出壓力為40、30、20 kPa,記錄相應擠出時間,并比較微球的質量,結果見表3。可見,隨著擠出壓力減小,所需擠出時間明顯增加,當擠出壓力減小至20 kPa時,載藥量和包封率降低,突釋率顯著增加至62.77%。從體外釋放曲線(圖3)可見,擠出壓力對40 d累積釋放曲線影響不大,對突釋有顯著影響。擠出壓力在30 kPa下微球的載藥量、包封率高、突釋率最低,微球形態圓整、粒徑均一。綜合以上結果,選擇最適擠出壓力為30 kPa。
表2 內水相體積對微球的影響


內水相體積/L載藥量/%包封率/%突釋率/%1505.91±1.6553.2228.52±2.093007.22±0.1465.0036.15±1.476005.62±1.1250.6051.57±2.42

圖2 內水相體積對微球體外釋放的影響
Figure 2 The effect of internal water phase volume on the release from microspheres (n=3)
表3 擠出壓力對微球的影響


擠出壓力及時間載藥量/%包封率/%突釋率/%40kPa/2min7.57±1.0268.1842.93±3.6730kPa/8min7.47±0.2567.2638.13±0.5820kPa/20min6.35±1.1657.1662.77±0.66
3.1.4 外水相或內水相加鹽(NaCl)對微球質量的影響 考察在外/內水相均不加鹽以及分別加鹽3個處方對微球質量的影響,結果見表4。可見,在外水相中加入鹽,顯著增加微球包封率(80.32%),降低突釋率(29.02%)。但從釋放曲線(圖4)看,后期釋放減緩,40 d的累積釋放率減少;而在內水相中加入鹽,不但載藥量、包封率明顯降低,突釋率增加至76.38%,且5~40 d微球幾乎不釋放。綜合以上結果,選擇不加鹽作為優化處方。

圖3 擠出壓力對微球體外釋放的影響
Figure 3 The effect of extrusion pressure on the release from microspheres (n=3)
表4 外水相或內水相加鹽對微球的影響
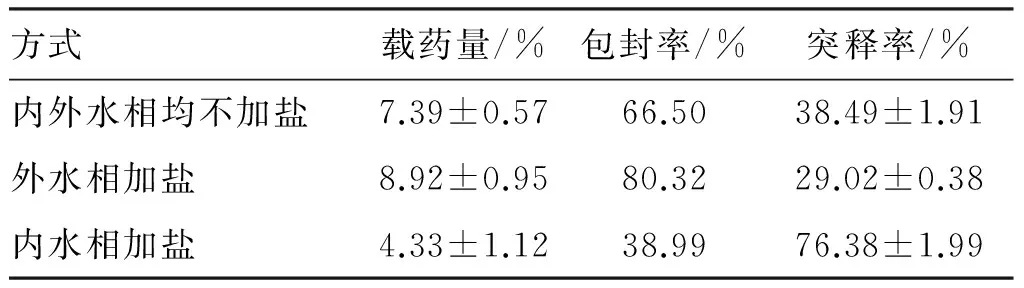
方式載藥量/%包封率/%突釋率/%內外水相均不加鹽7.39±0.5766.5038.49±1.91外水相加鹽8.92±0.9580.3229.02±0.38內水相加鹽4.33±1.1238.9976.38±1.99

圖4 外水相或內水相加鹽對微球體外釋放的影響
Figure 4 The effects of adding NaCl into external or internal water phase on the release from microspheres (n=3)
3.2 處方驗證的結果
根據以上因素考察結果,確定處方工藝為:BSA 75 mg,F68溶液300 μL,PEG-PLGA 600 mg,二氯甲烷4 mL,初乳勻漿轉速15 000 r/min,膜擠出壓力30 kPa。以此處方制備3批微球,并對其形態學性質、載藥量、體外釋藥進行考察,結果見表5。可見,3批微球的平均載藥量為7.70%,包封率為69.33%,平均突釋率為36.88%。體外釋放行為(圖5)顯示,40 d累積釋放率接近80%,整個釋放周期以較均勻的速度持續釋放。微球形態光滑圓整、粒徑均一且分散性良好,平均粒徑為(55.51±0.24)μm,見圖6和圖7。
表5 優化處方制備的微球的性質考察結果


批號載藥量/%包封率/%突釋率/%201503017.69±0.1569.1936.84±2.12201503027.67±0.1469.0438.30±3.35201503037.75±0.3669.7635.52±1.82

圖5 優化處方制備的微球的體外釋放曲線
Figure 5Invitrorelease of microspheres prepared by modified prescription (n=3)

圖6 優化處方制備的微球的粒徑分布
Figure 6 Diameter distribution pictures of microspheres prepared by modified prescription

a.1 100×; b.70×。
圖7 優化處方制備的微球SEM圖
Figure 7 SEM pictures of microspheres prepared by modified prescription
4 討論
本文采用新型SPG膜乳化技術結合復乳溶劑揮發法制備BSA/PLGA緩釋微球,與傳統的機械攪拌、超聲乳化法等比較,膜乳化法操作條件溫和、能耗低,制備得到的微球具有粒徑可控、尺寸均一、包封率高、重現性好等優點[5];與復乳法[6]相比,該制備方法簡單快速。結合預試驗和前期研究[3],本文選取初乳勻漿轉速、內水相體積、膜擠出壓力、外水相或內水相加鹽4個因素,分別考察它們對微球質量的影響[7]。
初乳勻漿轉速和內水相體積這兩個因素是通過改變初乳的性質而影響微球質量的[8]。本文結果顯示,隨著初乳勻漿轉速的增加,載藥量和包封率增加,突釋率降低。這可能是因為隨著初乳的勻漿轉速增加,初乳中內水相被剪切形成數目更多、體積更小的液滴,形成更加均質的體系,初乳的穩定性增加,從而形成的復乳體系中油相就含有更多更小的內水相液滴,使得包封率增加、突釋率降低。
本文結果亦顯示,隨著內水相增加,載藥量和包封率呈現先增加后減小,突釋率呈現先減小后增大的現象。分析原因是內水相的體積小(150 μL),在投藥量一定的情況下,溶解藥物后內水相的黏度高,在制備初乳時越不容易分散,因此形成的微球內部孔洞數目少且孔徑大[9],導致包封率降低,突釋增高;隨著內水相體積增加(300 μL),黏度降低、分散相改善,初乳的穩定性也就越高;但當內水相體積增加過大(600 μL),微球內部的小液滴大量增加,意味著小液滴擴散到微球表面進入外水相的幾率變大,引起藥物損失,包封率再次降低。
擠出壓力是SPG膜乳化法中影響微球理化性質另一個重要因素[10],壓力過大會使初乳以噴射狀分散到連續相,來不及充分接觸乳化劑,造成液滴直徑變大,CV(coefficient of variation,變異系數)值也隨之增加。若壓力過低,不但膜通量減少,而且由于乳化速度變慢,乳化時間延長,造成初乳不穩定,降低包封率。本文通過調整不同擠出壓力,最終確定膜孔徑為5 μm的最適擠出壓力為30 kPa。
為解決微球突釋問題,通過在外水相中加入鹽來升高滲透壓,減少在固化過程中由于壓差導致內水相中的蛋白擴散至外水相所引起的包封率下降、突釋率增加[11-12]。本文結果顯示,在外水相中加入鹽,的確能顯著增加包封率、降低藥物突釋,但同時由于微球近表面的水通道減少,內部的蛋白更加難以擴散釋放,加劇后期釋藥不完全;而在內水相中加入鹽,由于升高內水相的滲透壓,導致微球表面孔洞劇增,突釋異常嚴重,后續試驗可以嘗試調整鹽量來改善突釋。
本文采用SPG膜乳化法制備BSA/PLGA微球,初步篩選出優化處方,制備得到的3批微球粒徑均一、形態圓整、分散性和流動性良好,載藥量、包封率較高,體外釋藥平緩,說明該方法重現性良好,具有廣泛的應用前景。試驗中只是分別對4個處方工藝參數進行單因素考察,今后將進行多因素考察,以進一步優選工藝處方。
[1] ANDERSON J M,SHIVE M S. Biodegradation and biocom-patibility of PLA and PLGA microspheres[J]. Adv Drug Deliv Rev,2012,64(Suppl):72-82.
[2] NAKASHIMA T,SHIMIZU M,KUKIZAKI M. Particle control of emulsion by membrane emulsification and its applications[J]. Adv Drug Deliv Rev,2000,45(1):47-56.
[3] 金啟星,成曉嵐,羅宇燕,等. 工藝因素對復乳法制備的載BSA的PLGA微球形態與釋藥的影響[J].廣東藥學院學報,2014,30(5):539-543.
[4] 楊夢琪,張永明,陳德,等.SPG膜乳化法制備溶菌酶-PLGA微球的研究[J].中國藥師,2015,18(3):376-380
[5] CHARCOSSET C,LIMAYEM I,FESSI H. The membrane emulsification process—a review [J]. J Chem Technol Biotechnol,2004,79(3):209-218.
[6] 羅宇燕,麥海燕,黎吶,等.復乳法及其改良法制備的干擾素PLGA微球載藥釋藥特性的對比[J].中山大學學報(自然科學版),2014,53(3):110-114.
[7] 袁清霞,趙龍巖,程杰,等.W/O/W復乳溶劑蒸發法制備水溶性藥物微球研究進展[J].中國生化藥物雜志,2012,33(6):920-923.
[8] QI Feng,WU Jie,QING Zefan,et al. Preparation of uniform-sized exenatide-loaded PLGA microspheres as long-effective release system with high encapsulation efficiency and bio-stability[J]. Colloids Surf B Biointerfaces,2013,112(3):492-498.
[9] 李姝瑾,羅宇燕,黎吶,等.微球內部結構對體外釋放的影響初步研究[J].今日藥學,2014,24(11):778-796.
[10] SUN Guanqing,QI Feng,WU Jie,et al. Preparation of uniform particle-stabilized emulsions using SPG membrane emulsification[J]. Langmuir,2014,30(24):7052-7056.
[11] 周香蓮,賀進田,周志濤,等.外水相中NaCl對S/O/W法制備的牛血清白蛋白PLGA緩釋微球性質的影響[J].藥學學報,2010,45(8):1057-1063.
[12] LUAN X,SKUPIN M,SIEPMANN J,et al. Key parameters affecting the initial release (burst) and encapsulation efficiency of peptide-containing poly(lactide-co-glycolide) microparticles[J]. Int J Pharm,2006,324(2):168-175.
(責任編輯:陳翔)
Preparation of BSA-loaded PLGA microspheres with SPG membrane emulsification
WAN Sisi1,YANG Qi1,ZHONG Chen2,LUO Yuyan1,ZHANG Yongming1
(1.DepartmentofPharmacy,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China; 2.SchoolofPharmaceuticalSciences,SunYat-senUniversity,Guangzhou510006,China)
Objective To prepare poly (lactic acid) (PLGA) microspheres by SPG membrane emulsification method and investigate their morphological properties,drug loading and drug releaseinvitro. Methods Microspheres were prepared with serum albumin (BSA) as a model drug and PLGA as the carrier material by SPG membrane emulsification technique combined to double emulsion solvent evaporation method. The influence of rotational speed of colostrum homogenate,internal phase volume,adding salts into external or internal water phase,extrusion pressure and other factors on the quality of the microspheres were investigated. Results The morphology of microspheres with optimization prescription were round with uniform size,and the average particle size was (55.51±0.24) μm. Drug loading and encapsulation ratios were 7.70% and 69.33%,respectively. The release time was 40 days. Conclusion This study provided a new technology of preparing BSA-PLGA sustained-release microspheres by SPG membrane emulsification method.
SPG membrane emulsification; PLGA; sustain-released microspheres
2016-06-27
廣東省醫學科研基金資助(B2014150)
萬斯斯(1981—),男,主管藥師,電話:020-85252233,Email:sisi-wan@tom.com;通信作者:張永明(1965—),男, 博士,主任藥師,從事緩控釋制劑研究,電話:020-85253112,Email:874477522@qq.com。
時間:2016-10-08 14:57
http://www.cnki.net/kcms/detail/44.1413.R.20161008.1457.005.html
R944
A
1006-8783(2016)05-0550-05
10.16809/j.cnki.1006-8783.2016062704

