糖皮質激素誘導的蛋白激酶在缺血大鼠海馬神經元細胞中的保護作用
張 瑋 李樹清
(昆明醫科大學第一附屬醫院急診科,云南 昆明 650032)
?
糖皮質激素誘導的蛋白激酶在缺血大鼠海馬神經元細胞中的保護作用
張瑋李樹清1
(昆明醫科大學第一附屬醫院急診科,云南昆明650032)
〔摘要〕目的探討糖皮質激素誘導的蛋白激酶1(SGK1)在大鼠海馬神經元細胞中缺血再灌注中的保護作用。方法將海馬神經元細胞根據氧糖剝奪(腦缺血)誘導時間不同分為正常海馬神經元細胞組,氧糖剝奪誘導120 min組、氧糖剝奪誘導120 min后正常恢復10 min組、氧糖剝奪誘導120 min后正常恢復30 min組和氧糖剝奪誘導120 min后正常恢復60 min組。采用Annexin V-FITC/PI流式細胞術對樣品進行檢測,區分實驗樣本中正常、壞死、凋亡細胞。結果隨著氧糖剝奪(腦缺血)時間的延長而神經元細胞凋亡的數量呈現不斷增加的趨勢;而隨著氧糖剝奪(腦缺血)時間的延長,SGK1在蛋白水平的表達出現不斷下降的趨勢;和對照組相比其神經元細胞凋亡的數量明顯減少;SGK1蛋白的過表達受到抑制。結論SGK1可以有效減少氧糖剝奪SD大鼠海馬神經元細胞的凋亡,而SGK1調控神經元細胞凋亡的模式是通過PI3K/Akt/GSK3β信號通路來介導。
〔關鍵詞〕糖皮質激素誘導的蛋白激酶1;神經元細胞;缺血再灌注
研究發現,缺血再灌注損傷是對組織造成損傷的主要因素,即再次恢復血液供應,缺血組織灌注時造成的微血管和實質器官的損傷〔1~3〕,本研究旨在探討糖皮質激素誘導的蛋白激酶1(SGK1)在大腦缺血再灌注過程中可能的保護機制。
1資料和方法
1.1樣本來源本研究用細胞為培養后的1日齡SD大鼠神經元細胞。對SD大鼠采用椎脫臼處死法處死,用75%酒精浸泡消毒3~5 min;取出海馬神經元細胞進行培養。
1.2試驗方法
1.2.1大鼠海馬神經元細胞的額分離及培養選用1日齡SD大鼠2只。通過對大鼠進行消毒后處死,獲取了SD大鼠的海馬細胞,并進行了體外培養。
1.2.2已分離培養的SD大鼠海馬神經元細胞的免疫熒光鑒定采用海馬神經元特異性抗微管相關蛋白2(MAP2)抗體免疫熒光來顯示分離和培養的結果,在顯微鏡下計數,記錄每個視野中染色陽性的細胞占所有細胞的比值,超過95%的為陽性。
1.2.3通過氧糖剝奪誘導海馬神經元凋亡將海馬神經元細胞根據氧糖剝奪誘導時間不同分為正常海馬神經元細胞組,氧糖剝奪誘導120 min組、氧糖剝奪誘導120 min后正常恢復10 min組、氧糖剝奪誘導120 min后正常恢復30 min組和氧糖剝奪誘導120 min后正常恢復60 min組。采用Annexin V-FITC/PI流式細胞術對樣品進行檢測,區分實驗樣本中正常、壞死、凋亡細胞。
1.2.4Western印跡技術檢測上述步驟中各種細胞的SGK1表達實驗對樣本進行總蛋白提取與定量,根據SGK1的mRNA序列(序列號:NM_001193568.1)設計了該基因的全基因引物,獲得目的基因SGK1模板,構建質粒載體,并進行過表達效率檢測。
1.3統計學方法采用SPSS16.0進行分析。
2結果
2.1氧糖剝奪誘導海馬神經元凋亡及SGK1表達情況NC代表未經任何處理的培養過的SD大鼠海馬神經元細胞、OGD表示對培養過的SD大鼠海馬神經元細胞進行了120 min的氧糖剝奪,而10 min組、30 min組和60 min組則表示培養過的SD大鼠海馬神經元細胞在進行了120 min的氧糖剝奪之后分別進行了10 min、30 min和60 min的氧糖正常供給。各組凋亡情況及SGK1表達見表1,圖1。
2.2SGK1基因蛋白水平的過表達能阻止氧糖剝奪120 min的培養過的SD大鼠海馬神經元細胞的凋亡與NC組比較,轉染SGK1過表達載體的細胞內,可以SGK1導致mRNA的表達增加約5倍;在轉染了SGK1過表達病毒載體的細胞中,SGK1基因在蛋白水平的表達約超過未處理組的2.5倍。海馬神經元分別轉染了空載體或編碼SGK1基因的表達載體;在轉染24 h后,SGK1在基因水平和蛋白質水平的變化情況和NC相比具有顯著性差異。海馬神經元分別轉染了空載體或編碼SGK1基因的表達載體24 h,然后進行120 min的氧糖剝奪,然后使之恢復60 min;運用流式細胞儀分析用膜聯蛋白V/PI雙染色法來檢測細胞凋亡情況。通過免疫印跡實驗檢測SGK1和活化的金屬基質蛋白酶(caspase)-3蛋白水平差異情況。見表2,表3,圖2。

表1 各組大鼠海馬神經元細胞凋亡及SGK1蛋白表達
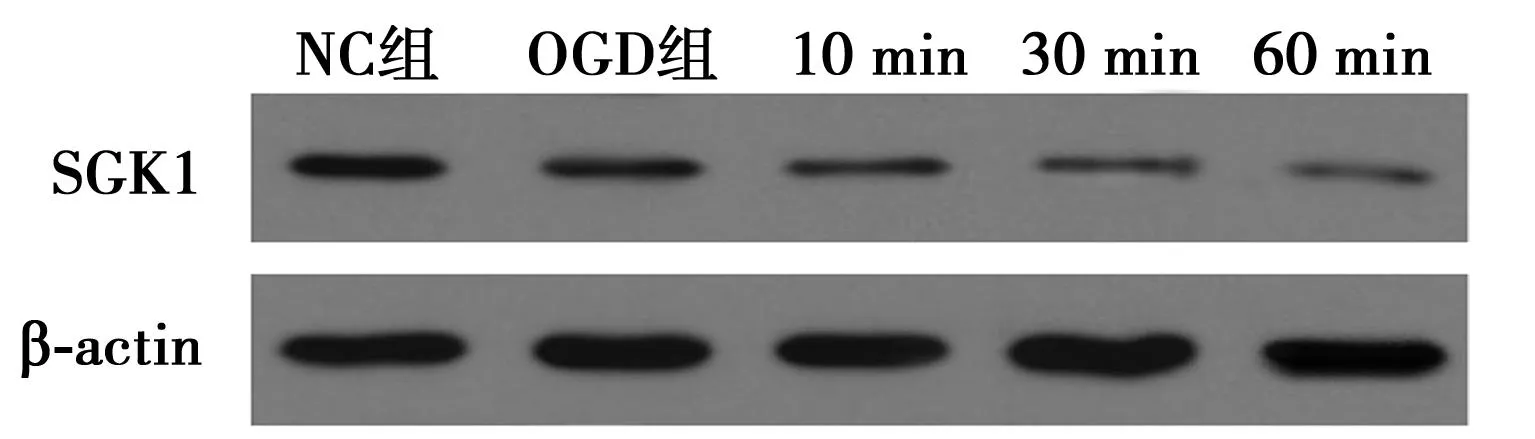
圖1 SD大鼠SGK1表達情況

觀察指標NC組Voctor組SGK1組F值P值基因水平1.00±0.131.02±0.122.71±0.6324.311<0.001蛋白水平1.05±0.101.03±0.115.43±1.3631.005<0.001
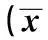
表3 SGK1過表達可保護神經元細胞在
3討論
缺血性腦血管病是目前導致人類,尤其是老年人致死和致殘率最高的疾病之一。對于缺血性腦血管病當前最主要的治療原則是對缺血區域進行血液灌注〔4〕;然而近期發現對缺血性腦血管疾病的缺血再灌注非但沒有使組織功能恢復,反而會導致缺血所致的功能障礙和結構破壞進一步加重,這種現象即缺血再灌注損傷〔5〕,在各種模式生物〔6〕和人類〔7〕研究中都得到了一致的結果。
本研究結果發現,對體外培養的SD大鼠海馬神經元細胞進行氧糖剝奪可導致SD海馬神經元細胞凋亡數量的增加,而之后隨著再恢復氧糖供應時間的增加,神經元細胞凋亡的數據則呈現進一步加劇的趨勢。而SGK1的過表達則可以抑制SD大鼠海馬神經元細胞因氧糖剝奪導致的細胞凋亡的趨勢。
另外本結果顯示,SGK1的過表達能顯著降低因氧糖剝奪導致的SD大鼠海馬神經元細胞凋亡的數量,這一結果得到了熒光輔助細胞篩選分析的支持,提示Akt和GSK-β可對經受缺血再灌注海馬神經元細胞能起到保護作用。
4參考文獻
1Fields JD,Khatri P,Nesbit GM,etal.Meta-analysis of randomized intra-arterial thrombolytic trials for the treatment of acute stroke due to middle cerebral artery occlusion〔J〕.J Neurointerv Surg,2011;3(2):151-5.
2Lang F,B?hmer C,Palmada M,etal.(Patho)physiological significance of the serum-and glucocorticoid-inducible kinase isoforms〔J〕.Physiol Rev,2006;86(4):1151-78.
3熊濤,屈藝,母得志.AKT-GSK3信號通路與缺血缺氧性腦損傷〔J〕.醫學綜述,2010;16(23):3521-4.
4Dirksen MT,Laarman GJ,Simoons ML,etal.Reperfusion injury in humans:a review of clinical trials on reperfusion injury inhibitory strategies〔J〕.Cardiovasc Res,2007;74(3):343-55.
5Choi DW.Ischemia-induced neuronal apoptosis〔J〕.Curr Opin Neurobiol,1996;6(5):667-72.
6Hokari M,Kuroda S,Kinugawa S,etal.Overexpression of mitochondrial transcription factor A(TFAM)ameliorates delayed neuronal death due to transient forebrain ischemia in mice〔J〕.Neuropathology,2010;30(4):401-7.
7Itoh T,Satou T,Nishida S,etal.Edaravone protects against apoptotic neuronal cell death and improves cerebral function after traumatic brain injury in rats〔J〕.Neurochem Res,2010;35(2):348-55.
〔2015-11-03修回〕
(編輯袁左鳴)
《中國老年學雜志》鄭重聲明
中國老年學雜志從未設任何網站,唯一投稿方式為郵箱投稿,投稿郵箱為:okgood911@126.com 。唯一咨詢電話:0431-88923384 。唯一匯款方式為郵局匯款,匯款地址:長春市建政路971號《中國老年學雜志》編輯部收,郵編:130061。
〔中圖分類號〕R74
〔文獻標識碼〕A
〔文章編號〕1005-9202(2016)06-1300-02;
doi:10.3969/j.issn.1005-9202.2016.06.009
通訊作者:李樹清(1953-),男,博士生導師,教授,主要從事腦缺血與腦保護的研究。
基金項目:云南省科技廳應用基礎研究基金(No.2013FB131);云南省教育廳科研基金(No.2013Y281)
1昆明醫科大學基礎醫學院病理生理教研室
第一作者:張瑋(1975-),男,博士,副主任醫師,主要從事急診醫學方面的研究。

