CIK對卵巢癌及其耐藥細胞的殺傷作用
賈雪麗 皇甫明美 閆文星 徐 爽 邱 爽 孫世龍 劉林林
(吉林大學第二醫院,吉林 長春 130041)
?
CIK對卵巢癌及其耐藥細胞的殺傷作用
賈雪麗皇甫明美閆文星徐爽邱爽1孫世龍1劉林林
(吉林大學第二醫院,吉林長春130041)
〔摘要〕目的探討細胞因子誘導的殺傷細胞(CIK)對卵巢癌細胞(SKOV3)及其耐藥細胞(SKVCR)的體外殺傷效應。方法用健康志愿者外周血單個核細胞(PBMC)在體外應用多種細胞因子誘導成CIK細胞,流式細胞術分析其表型特征,CIK分別作用于SKOV3及SKVCR 24 h和48 h后,CCK8法檢測不同效靶比下的細胞吸光度(A)值并計算CIK對各組細胞的殺傷效應。結果CIK細胞對SKOV3及SKVCR的殺傷效應隨效靶比的增加及作用時間的延長而增強(P<0.05)。在同一作用時間、相同效靶比時,CIK細胞對于SKOV3和SKVCR的殺傷效應差異無顯著性(P>0.05)。結論CIK對卵巢癌及其耐藥細胞有較強的殺傷作用,具有一定的臨床應用價值。
〔關鍵詞〕卵巢腫瘤;多重耐藥;細胞因子誘導的殺傷細胞
卵巢癌目前尚無有效的篩查方法,多數患者就診時已屬晚期。以鉑類為基礎的化療是晚期卵巢癌的重要治療手段,但由于化療毒副作用較大及耐藥性的出現,導致卵巢癌的化療效果受限。隨著免疫細胞生物學、分子生物學和免疫學的迅速發展,免疫治療(特別是過繼性細胞免疫治療)發揮越來越重要的作用。本研究旨在探討CIK對卵巢癌細胞(SKOV3)及其耐藥細胞(SKVCR)的體外殺傷效應,為卵巢癌綜合治療新策略提供實驗依據。
1 材料與方法
1.1試劑與儀器淋巴細胞分離液( Sigma公司);RPMI1640培養液(Hyclone公司);α-MEM培養液(Gibco公司);胎牛血清(Hyclone公司);抗人CD3單克隆抗體(Sigma公司);重組人干擾素(上海生物制品所);白細胞介素-2(北京四環生物工程制品廠);anti-hunman CD3-FITC、CD56-PE(BD公司);CCK8試劑盒(日本同仁化學研究所);-70℃深低溫冰箱(SNAYO公司);CO2培養箱(SNAYO公司);無菌超凈工作臺(江蘇凈化設備廠);FACSort flow cytometer(Becton Dickinson公司);酶標儀(KCjunior公司)。
1.2細胞株人卵巢癌細胞株SKOV3及其耐藥細胞SKVCR為吉林大學公共衛生學院放射醫學國家重點實驗室保存,均使用α-MEM培養液(含10%FBS及青霉素與鏈霉素各100 U/ml),于37℃、5%CO2培養箱中培養。其中卵巢癌耐藥細胞株SKVCR是由SKOV3以逐漸增加長春新堿藥物劑量誘導而成,耐藥濃度為2 μg/ml。經檢測SKVCR不僅對長春新堿產生耐藥,對其他不同結構和作用機制的化療藥物(如吡柔比星、依托泊苷)也產生了交叉耐藥〔1〕。
1.3效應CIK細胞的制備CIK的制備參考相關文獻〔2〕,用淋巴細胞分離液密度梯度離心法提取健康者外周血單個核細胞,用RPMI1640完全培養液調整細胞濃度至5×106/ml,置于37℃、5%CO2培養箱中。2 h后收集非貼壁細胞調整濃度為1×106/ml,加入1 000 U/ml干擾素(IFN)-γ繼續培養。24 h后加入50 ng/ml anti-human CD3、1 000 U/ml IL-2,以后每3 d添加一次培養液,并補足IL-2。于培養第14天收取CIK細胞,用流式細胞儀檢測細胞表型,測定CD3+CD56+雙陽性細胞百分比。
1.4CCK8法測定CIK細胞對SKOV3和SKVCR的殺傷作用取培養第14天收獲的CIK細胞作為效應細胞,對數生長期的SKOV3、SKVCR為靶細胞。調整靶細胞濃度為8×104/ml,100 μl加入96孔平底培養板于37℃、5%CO2培養箱中培養。24 h細胞貼壁后按照不同實驗組別給予相應處理:A1~4為CIK殺傷SKOV3細胞組,B1~4為CIK殺傷SKVCR細胞組;每組中1~4的效靶比分別為5∶1、10∶1、20∶1、40∶1,按照不同的效靶比加入不同濃度CIK細胞100 μl。同時設空白培養液(空白組)、單獨靶細胞(靶細胞組)作不同濃度效應細胞(效應細胞組)作對照孔,每組設3個復孔,每孔終體積為200 μl。置于培養箱中24 h和48 h取出細胞培養板,加入CCK8每孔20 μl低速振蕩混勻,繼續培養3 h。酶標儀設置測量波長490 nm、參考波長610 nm,測各孔吸光度值(A值)。殺傷作用(%)=〔1-(實驗組A值-效應細胞組A值)/(靶細胞組A值-空白組A值)〕×100%。
1.5統計學方法應用SPSS13.0軟件進行方差分析及t檢驗。
2結果
2.1CIK細胞的制備本實驗選取培養至第14天時的CIK細胞,此時獲得大量增殖,流式細胞儀檢測其CD3+CD56+細胞所占比例達45.8%。
2.2各組CIK細胞對靶細胞的殺傷作用見表1。在同一靶細胞、作用時間相同的條件下,不同效靶比CIK細胞作用組對卵巢癌細胞的殺傷作用之間的差異有統計學意義(P<0.05),
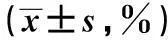
表1 CIK對SKOV3和SKVCR細胞的殺傷作用
隨著效靶比的增加,殺傷作用隨之增強;各組內不同作用時間CIK對卵巢癌細胞的殺傷率之間存在顯著性差異(P<0.05),在24~48 h,隨著作用時間的延長,其細胞抑制作用明顯增強。值得注意的是本實驗所研究的卵巢癌細胞株SKOV3和其耐藥細胞株SKVCR在同一作用時間、同一效靶比時,CIK對它們殺傷作用的差異無統計學意義(P>0.05)。
3討論
CIK細胞既具有T淋巴細胞強大的抑瘤活性,又具有自然殺傷(NK)細胞非MHC限制性殺瘤優點,所以又被稱為自然殺傷細胞樣T淋巴細胞〔3,4〕。近年來出現的過繼性細胞免疫治療包括LAK、TIL、CTL、DC和CIK,與其他類型細胞免疫治療相比,CIK具有增殖活性高,殺瘤作用強,殺傷范圍廣,毒性作用輕微等優點。CIK細胞已被應用于呼吸系統〔5〕、消化系統〔6〕、血液系統〔7〕等腫瘤患者的臨床治療,均取得較好的療效。
CIK 細胞殺傷腫瘤細胞的機制可能有以下幾點:①通過釋放顆粒酶或穿孔素,對腫瘤細胞直接發揮殺傷作用。②CIK 細胞分泌多種細胞因子(如IL-2、 IFN-γ、TNF-α等),直接殺傷或通過增強細胞毒作用間接殺傷腫瘤細胞。③有研究表明,經過CIK治療后腫瘤患者外周血中調節T細胞較治療前明顯降低〔8〕,說明CIK細胞免疫治療可以提高患者的免疫功能,進而通過調節免疫系統發揮間接殺傷作用。④CIK 細胞通過與腫瘤細胞膜表達的Ⅰ型跨膜糖蛋白結合,或通過下調凋亡抑制基因、上調促凋亡基因的表達誘導腫瘤細胞凋亡壞死。
腫瘤細胞對化療藥物耐藥性的產生是臨床腫瘤化療失敗的原因之一,根據耐藥表型的不同,可以分為原藥耐藥和多藥耐藥。其中,多藥耐藥是腫瘤細胞產生的主要耐藥形式,可以影響包括卵巢癌、乳腺癌、肺癌及胃癌等大部分腫瘤的治療效果〔9〕。腫瘤細胞的多藥耐藥是指腫瘤細胞對某一抗癌藥物產生耐藥性的同時,對其他未接觸的、作用機制不同的藥物也產生耐藥性的現象。本實驗結果證明,在一定范圍內CIK對卵巢癌細胞SKOV3和其多藥耐藥細胞SKVCR的殺傷率隨效靶比的增高及作用時間的延長而增強。在同一作用時間、相同效靶比時,CIK細胞對于SKOV3和SKVCR的殺傷作用無明顯差別,這將有助于卵巢癌尤其是對化療不敏感的卵巢癌患者抗腫瘤治療新策略的制定。CIK細胞已成為腫瘤過繼免疫治療的主力軍,是繼手術、放療和化療之后輔助治療的重要手段之一。
4參考文獻
1梁冰.抑制自噬增強卵巢癌耐藥細胞放化療敏感性的體外研究〔D〕.長春:吉林大學,2014.
2Tan G,Zhang X,Feng H,etal.The therapeutic effect of cytokine-induced killer cells on pancreatic cancer enhanced by dendritic cells pulsed with K-ras mutant peptide〔J〕.Clin Dev Immunol,2011;2011:649359.
3Pievani A,Borleri G,Pende D,etal.Dual-functional capability of CD3+CD56+CIK cells,a T-cell subset that acquires NK function and retains TCR-mediated specific cytotoxicity〔J〕.Blood,2011;118(12):3301-10.
4Mesiano G,Todorovic M,Gammaitoni L,etal.Cytokine-induced killer(CIK)cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors〔J〕.Expert Opin Biol Ther,2012;12(6):673-84.
5Li R,Wang C,Liu L,etal.Autologous cytokine-induced killer cell immunotherapy in lung cancer:a phase Ⅱ clinical study〔J〕.Cancer Immunol Immunother,2012;61(11):2125-33.
6孫明芳,丁震宇,謝曉冬,等.化療聯合自體CIK細胞治療晚期胃癌的隨機對照研究〔J〕.現代腫瘤醫學,2013;7(21):1537-40.
7Wang Y,Bo J,Dai HR,etal.CIK cells from recurrent or refractory AML patients can be efficiently expanded in vitro and used for reduction of leukemic blasts in vivo〔J〕.Exp Hematol,2013;41(3):241-52.
8李敏,鄧海峰,陸明洋,等.CIK治療前后腫瘤患者外周血CD4+CD25+調節型T細胞變化研究〔J〕.中國實驗診斷學,2011;15(6):1051-3.
9Persidis A.Cancer multidrug resistance〔J〕.Nat Biotechnol,1999;17(1):94-5.
〔2015-07-10修回〕
(編輯李相軍)
〔中圖分類號〕R737.31
〔文獻標識碼〕A
〔文章編號〕1005-9202(2016)06-1306-03;
doi:10.3969/j.issn.1005-9202.2016.06.012
通訊作者:劉林林(1970-),女,教授,博士生導師,主要從事惡性腫瘤的免疫治療、化學治療和放射治療的研究。
1吉林大學公共衛生學院
第一作者:賈雪麗(1990-),女,在讀碩士,主要從事惡性腫瘤的免疫治療、化療和放射治療的研究。

