銀耳多糖改善膿毒癥小鼠調節性T細胞的免疫活性①
史振偉 許 焱 李曉璐 劉慶陽
(煤炭總醫院腎內科,北京100028)
?
銀耳多糖改善膿毒癥小鼠調節性T細胞的免疫活性①
史振偉許焱李曉璐劉慶陽②
(煤炭總醫院腎內科,北京100028)
[摘要]目的:探討銀耳多糖(TPS)對膿毒癥小鼠外周血調節性T細胞免疫調節的作用。方法:雄性BALB/c小鼠(20±1)g,采用燒傷后腹腔注射銅綠假單胞菌制作膿毒癥并予以TPS干預,隨機分成5組,分別為正常對照組(未做任何處理),未刺激組(燒傷后銅綠假單胞菌感染未經TPS處理組),TPS低劑量組(燒傷后銅綠假單胞菌感染+50 mg/kg治療組),TPS中劑量組(燒傷后銅綠假單胞菌感染+100 mg/kg治療組),TPS高劑量組(燒傷后銅綠假單胞菌感染+200 mg/kg治療組),從各組的外周血中分離調節性T細胞,并體外培養。自燒傷即刻(PBD0)起,至燒傷后4 d每天監測培養上清液中IL-10、IFN-γ、IL-4的水平。磁珠孵育和磁性分離小鼠外周血的調節性T細胞(CD4+CD25highTregs)和CD4+T細胞,分別加入TPS后進行培養,以不加TPS的細胞作為對照,流式細胞儀分析CD4+CD25highTregs的表型,ELISA法檢測細胞因子的表達。結果:與對照組相比,TPS能顯著降低未刺激組小鼠的IL-10和IL-4的分泌,并顯著增加IFN-γ的分泌,并且IL-10的分泌水平與TPS濃度呈劑量效應關系。體外培養試驗中,與正常對照組相比,未刺激組的CD4+ T細胞增殖和IFN-γ水平顯著降低(P<0.05),IL-4水平顯著升高(P<0.05);與未刺激組相比,TPS刺激組的CD4+T 細胞增殖和IFN-γ水平顯著升高(P<0.05),IL-4水平顯著降低(P<0.05);與未刺激組相比,TPS刺激+抗體1組CD4+T 細胞增殖和IFN-γ水平顯著升高(P<0.05),IL-4水平顯著降低(P<0.05);與未刺激組相比,TPS刺激+抗體2組的CD4+T 細胞增殖和IFN-γ、IL-4水平無顯著性差異。結論:TPS可以通過降低IL-10的分泌抑制CD4+CD25highTregs對CD4+ T淋巴細胞增殖和極化的影響,并誘導CD4+T淋巴細胞向Th1分型,從而使機體免疫活性增強。
[關鍵詞]銀耳多糖;調節性T淋巴細胞;膿毒癥;燒傷;IL-10
研究證明,調節性T細胞在膿毒癥中起重要作用,其主要功能是在患者創傷后抑制T細胞的增殖,并抑制Th1型細胞因子的產生。膿毒癥的免疫反應是誘導促炎反應和抗炎反應達成一個復雜的平衡狀態,從而限制對宿主組織的損傷,調節性T細胞在這種平衡中起了至關重要的作用,如果調節性T細胞的負向免疫調節占了主導地位,平衡將會消失,進而出現無法治愈的免疫抑制。眾所周知,在膿毒癥后期會出現無法控制的免疫抑制狀態,這是多器官功能障礙綜合征甚至死亡的主要原因[1-3]。銀耳多糖(Tremella polysaccharides,TPS)具有免疫調節、抗腫瘤、抗氧化老化、降低血糖、抗凝血血栓形成、抗潰瘍、促進蛋白質合成、抗病毒、促進神經細胞的生長和改善記憶等生物活性,已被證實具有改善免疫抑制狀態的作用[4]。本研究觀察TPS對分泌IL-10的調節性T細胞亞群——CD4+CD25highTregs功能的影響,旨在為探討TPS干預燒傷后膿毒癥后期免疫抑制狀態的機制提供理論依據。
1材料與方法
1.1材料
1.1.1主要試劑TPS(陜西慈緣生物技術有限公司),抗IL-10抗體(美國eBioscience公司),RPMI-1640、胎牛血清(FCS)、谷氨酰胺、青霉素、鏈霉素和HEPES(北京天潤善達生物技術有限公司),小鼠CD4+CD25highTregs微磁珠(德國MiLtenyi Biotec公司),噻唑藍(MTT)和TritonX-100(Sigma公司),異硫氰酸熒光素(FITC)標記抗小鼠CD4、藻紅蛋白,PE標記抗小鼠CD25和純化大鼠抗小鼠CD3和CD28(BD/PharMingen公司),IL-2 酶聯免疫檢測試劑盒、IL-4 酶聯免疫檢測試劑盒和干擾素-γ酶聯免疫檢測試劑盒(Biosource公司),ATCC27853 銅綠假單胞菌 (ATCC 公司,美國)。
1.1.2動物雄性BALB/c小鼠,6~8周齡,體重(20±1)g(中國醫學科學院,北京實驗動物中心)。自由進水進食,人工照明,保持 12 h 開/關。所有實驗動物的護理和使用均嚴格遵守國家研究所健康指南。
1.2方法
1.2.1燒傷后銅綠假單胞菌感染模型建立根據隨機數字表法分三組:假燙對照組;燙傷+細菌組。在小鼠的背部用水浴(37℃)持續接觸 8 s,計算燙傷面積 10%總體表面積(TBSA)背部燙傷;此為假燙組。燙傷細菌組在小鼠的背部用開水(100℃)持續接觸8 s,計算燙傷面積 10%TBSA Ⅲ°;在燒傷后1 d(PBD1),小鼠背部創面中心注射 50 μl的 ATCC27853 銅綠假單胞菌菌液(1×106CFU),此為模型組。在PBD 1、2和3,小鼠腹腔注射TPS(50、100和200 mg/kg)。
1.2.2實驗設計105只小鼠被分為五組,各組分組情況如下:A.假燒傷組 BALB/c小鼠5只;B.燒傷+銅綠假單胞菌感染組 BALB/c小鼠25只;C.燒傷+銅綠假單胞菌感染+TPS(50 mg/kg)治療組 BALB/c小鼠25只;D.燒傷+銅綠假單胞菌感染+TPS(100 mg/kg)治療組 BALB/c小鼠25只;E.燒傷+銅綠假單胞菌感染+TPS(200 mg/kg)治療組 BALB/c小鼠25只。B、C、D、E組再分出4個亞組,每組有5只小鼠,小鼠們分別在燒傷后1、2、3、4 d被處死,另外有5只小鼠被作為正常對照組。在指點時間點處死所有的小鼠,立即收集外周血樣本用以獲得Tregs和T淋巴細胞。
1.2.3磁珠孵育和磁性分選外周血Treg和CD4+T淋巴細胞富集的小鼠外周血T淋巴細胞,不含抗體及磁珠,細胞計數,用于下游實驗。Treg淋巴細胞的純化通過Treg試劑盒選出;CD4+T淋巴細胞使用CD4+T淋巴細胞試劑盒分選得到,操作步驟嚴格按說明書進行。
1.2.4細胞培養細胞在RPMI1640中培養并加入2 nmol/L的L-谷氨酰胺,5 mmol/L的HEPES和100 U/ml青霉素,100 mg/ml鏈霉素(BioWhittaker公司),0.5 mmol/L的丙酮酸鈉,0.05 mmol/L的非必需氨基酸和5%血清。50 ml 抗CD3抗體稀釋到PBS(Life Technologies公司),以5或0.05 mg/ml的指定濃度加入到每個培養孔,放置在37℃下4 h,并然后用PBS洗滌兩次。
1.2.5酶聯免疫吸附分析細胞因子含體積分數10%胎牛血清-RPMI1640完全培養基重懸CD4+CD25highT淋巴細胞,調整細胞密度為1×106個/ml,取0.2 ml接種于96孔細胞培養板,另加TPS處理(200 μg/ml,以不加TPS的細胞作為對照)。24 h后收集上清液,采用ELISA測定IFN-γ、 IL-4水平,嚴格按說明書步驟操作。
1.2.6混合淋巴細胞體外反應檢測脾T淋巴細胞增殖功能及Th1/Th2功能性極化磁珠孵育和磁性分選小鼠燒傷后第二天(PBD2)、第三天(PBD3)及第四天(PBD4)外周血Treg和正常鼠CD4+T淋巴細胞,將CD4+T淋巴細胞分為正常對照組(未作任何處理),未刺激組(加入未經TPS處理的Treg淋巴細胞與CD4+T淋巴細胞混合培養),TPS刺激組(加入經200 μg/ml TPS處理后的Terg淋巴細胞與CD4+T淋巴細胞混合培養),TPS刺激+抗體1組(加入經200 μg/ml TPS處理后的Treg淋巴細胞、IL-10抗體與CD4+T淋巴細胞混合培養)和TPS刺激+抗體2組(加入經200 μg/ml TPS處理后的CD4+CD25highT淋巴細胞、IL-10的同型對照抗體與CD4+T淋巴細胞混合培養)。混合培養24 h后采用含體積分數10%FBS-RPMI1640完全培養基重懸脾T淋巴細胞,調整細胞密度為5×106個/ml,取0.2 ml接種于48孔細胞培養板,另加100 μl 刀豆素A(5 μg/ml)進行刺激。常規培養18 h,加入不同細胞數的Treg淋巴細胞,使培養液中Treg淋巴細胞與脾T淋巴細胞的細胞比例為1∶100,每組3個平行孔。孵育68 h,再向各孔加入10 μl噻唑藍(5 mg/ml),輕微振蕩,繼續培養4 h。加100 μl Triton-異丙醇溶液,37℃溫箱過夜,測定波長540 nm下吸光度值以檢測脾T淋巴細胞增殖功能;分別于刺激后3 d留取上清,應用流式細胞磁珠分析術(Cytometric beads array system,CBA)檢測各組上清中IFN-γ、IL-4水平(分別反映Th1和Th2改變),首先對含IL-4、IFN-γ等兩種CBA微球進行抗體包被,并對所包被的IL-4、IFN-γ抗體進行標染,染色滿意后,采用流式細胞儀進行檢測。
2結果
2.1TPS抑制調節性T細胞IL-10的分泌從各組的外周血中分離調節性T細胞,并在體外培養。自燒傷即刻(PBD0)起,至燒傷后4 d每天監測培養上清液中IL-10的水平,并記錄下來(表1)。未刺激組中IL-10的水平異常增高,TPS顯著降低IL-10水平,并呈劑量依賴性(P<0.05)。
2.2TPS影響調節性T細胞IFN-γ、IL-4的分泌從各組的外周血中分離出調節性T細胞,并在體外培養后,自燒傷即刻(PBD0)起,至燒傷后4 d每天監測培養上清液中的IFN-γ、IL-4(圖1)。圖A中可以看出,與未刺激組比較,不同時間點TPS處理組IFN-γ的水平升高,而IL-4水平降低,并呈現劑量依賴關系(P<0.05)。不同劑量的TPS處理組與未刺激組相比,由CD4+T細胞產生的IL-4的水平顯著增加(P<0.05),與此相反,IFN-γ的水平顯著降低(P<0.05)。
2.3在體外TPS對膿毒癥小鼠的CD4+T細胞的增殖和分化以及IFN-γ、IL-4分泌水平的影響
2.3.1TPS影響膿毒癥小鼠的CD4+T細胞的增殖和分化體外培養試驗中,與正常對照組相比,未刺激組的CD4+T細胞增殖和IFN-γ水平顯著降低(P<0.05),IL-4水平顯著升高(P<0.05);與未刺激組相比,TPS刺激組的CD4+T 細胞增殖和IFN-γ水平顯著升高(P<0.05),IL-4水平顯著降低(P<0.05);與未刺激組相比,TPS刺激+抗體1組CD4+T 細胞增殖和IFN-γ水平顯著升高(P<0.05),IL-4水平顯著降低(P<0.05);與未刺激組相比,高濃度TPS刺激+抗體2組的CD4+T 細胞增殖和IFN-γ、IL-4水平無顯著性差異。見表2。



IL-10BurnsepsisTPS(50mg/kg)TPS(100mg/kg)TPS(200mg/kg)PBD0150±12151±11149±15150±16PBD1321±14291±19275±13237±21PBD2353±18316±21281±18243±19PBD3501±28399±181)298±201)2)252±171)2)PBD4375±17228±19237±16185±22
Note:1)P<0.05,compared to burn sepsis;2)P<0.05 compared to TPS group(50 mg/kg).

圖1 TPS處理后調節性T細胞產生的IFN-γ和IL-4的變化Fig.1 Effect of TPS on CD4+ T cells proliferation in septic miceNote: Compared to burn sepsis,*.P<0.05;compared to TPS group(50 mg/kg),#.P<0.05.

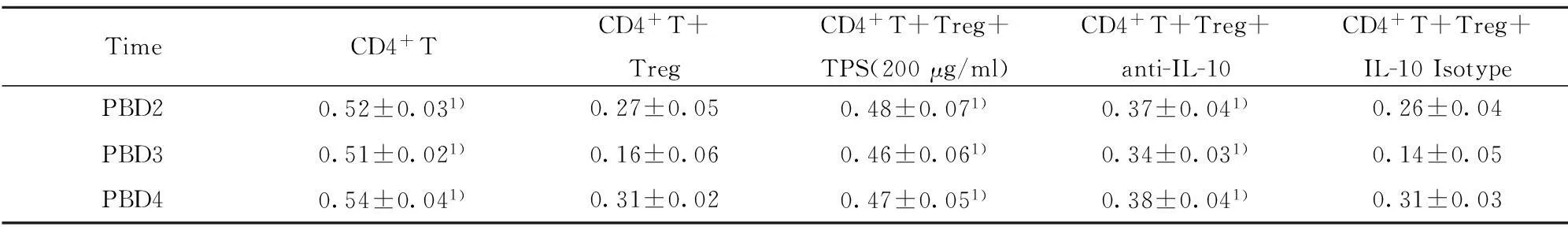
TimeCD4+TCD4+T+TregCD4+T+Treg+TPS(200μg/ml)CD4+T+Treg+anti-IL-10CD4+T+Treg+IL-10IsotypePBD20.52±0.031)0.27±0.050.48±0.071)0.37±0.041)0.26±0.04PBD30.51±0.021)0.16±0.060.46±0.061)0.34±0.031)0.14±0.05PBD40.54±0.041)0.31±0.020.47±0.051)0.38±0.041)0.31±0.03
Note:1)P<0.05,compared to CD4+CD25highT cells+CD4+T cells.

TimeCD4+TCD4+T+TregCD4+T+Treg+TPS(200μg/ml)CD4+T+Treg+anti-IL-10CD4+T+Treg+IL-10IsotypePBD2209±281)108±21199±271)175±191)121±23PBD3211±311)89±17195±251)169±211)95±19PBD4198±271)105±19201±181)181±201)117±16
Note:1)P<0.05,compared to CD4+CD25highT cells +CD4+T cells.
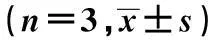
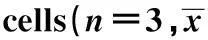
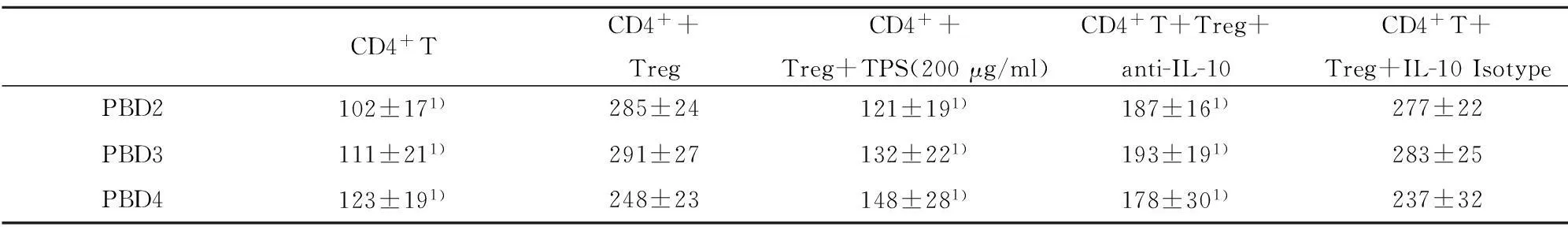
CD4+TCD4++TregCD4++Treg+TPS(200μg/ml)CD4+T+Treg+anti-IL-10CD4+T+Treg+IL-10IsotypePBD2102±171)285±24121±191)187±161)277±22PBD3111±211)291±27132±221)193±191)283±25PBD4123±191)248±23148±281)178±301)237±32
Note:1)P<0.05,compared to CD4+CD25highT cells +CD4+T cells.
2.3.2在體外TPS對CD4+T細胞的IFN-γ、IL-4分泌影響通過表3、4看出,正常對照組、未刺激組、TPS刺激組、TPS刺激+抗體1組和TPT刺激+抗體2組IFN-γ、IL-4的水平,其中TPS刺激組和TPT刺激+抗體1組IFN-γ明顯高于未刺激組(P<0.05),IL-4明顯低于未刺激組(P<0.05),TPS刺激+抗體2組與未刺激組無顯著性差異。
3討論
在過去的20年里,盡管大量抗生素和其他支持治療不斷進展,膿毒癥仍然是重癥監護病房的首要死亡原因。并且這些病人均有免疫功能抑制[5]。膿毒癥中的免疫抑制,亦稱“免疫麻痹”,是以包括單核細胞失活,內毒素耐受,中性粒細胞功能受損,淋巴細胞功能障礙和凋亡為特點[6]。最近的研究主要集中在實驗和臨床膿毒癥病人調節性T細胞表型和功能上[7]。
調節性T細胞比例的持續性增加與較差的長期預后是有一定關聯的。因此推測調節性T細胞的異常變化可能是膿毒癥的一個重要的致病因素。調節性T細胞的免疫抑制機制有待確定,這些細胞通過細胞間的直接接觸或間接通過抗炎介質的分泌(如:IL-10)可以抑制免疫細胞功能[8]。IL-10是一種抗炎細胞因子可以抑制促炎細胞因子的生產。本實驗結果顯示:產生IL-10的調節性T細胞在燒傷膿毒癥小鼠體內顯著增加,CD4+T細胞的增殖被顯著抑制,燒傷后綠膿桿菌感染后Th2細胞的細胞因子IL-4異常增強,IFN-γ明顯下降,以上表明在膿毒癥晚期Th1和Th2之間的應答平衡遭到破壞。因此,我們推測在膿毒癥晚期,調節性T細胞的異常活動不利于膿毒癥的恢復。
體外實驗的結果證實自燒傷后膿毒癥小鼠體內分離出來的調節性T細胞可顯著抑制CD4+T細胞的增殖,并且抗IL-10抗體可部分阻斷調節性T細胞對CD4+T細胞的抑制效果,與體內結果相一致。
有研究表明:中藥作為免疫調節劑可用于提高免疫力。銀耳多糖有免疫調節功能,可對抗化療藥物引起的免疫抑制[4]。目前還不清楚TPS能否通過改善調節性T細胞的異常活動而改善膿毒癥。為此,我們應用銀耳多糖治療遭受燒傷及綠膿桿菌感染的小鼠,觀察了TPS在調節性T細胞的調節免疫活動中的作用,TPS可以通過降低IL-10、IL-4,增加IFN-γ的分泌水平抑制CD4+CD25highTreg對CD4+T淋巴細胞的增殖作用;體外實驗中,在混合淋巴細胞反應之前,CD4+CD25highTreg細胞先用TPS(200 μg/ml)刺激,我們發現,TPS顯著逆轉的CD4+CD25highTreg介導的CD4+T細胞的增殖和分化誘導的調節性T細胞的變化,二者結果一致。因此,TPS可以抑制調節性T細胞的功能,調節T淋巴細胞由Th2轉化為Th1,最終改善膿毒癥預后。
參考文獻:
[1]Mills KH.Regulatory T cells:friend or foe in immunity to infection? Nat Rev Immunol,2004,4(11):841-855.
[2]Vincent JL,Opal SM,Marshall JC,etal.Sepsis definitions:time for change[J].Lancet,2013,381(9868):774-775.
[3]Hotchkiss RS,Monneret G,Payen D.Sepsis-induced immunosupp-ression:from cellular dysfunctions to immunotherapy[J].Nat Rev Immunol,2013,13(12):862-874.
[4]Shi ZW,Liu Y,Xu Y,etal.Tremella polysaccharides attenuated sepsis through inhibiting abnormal CD4+CD25(high) regulatory T cells in mice[J].Cell Immunol,2014,288(1/2):60-65.
[5]Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis[J].N Engl J Med,2003,348(2):138-150.
[6]Cohen J,Vincent JL,Adhikari NK,etal.Sepsis:a roadmap for future research[J].Lancet Infect Dis,2015,15(5):581-614.
[7]Liu QY,Yao YM,Yu Y,etal.Astragalus polysaccharides attenuate postburn sepsis via inhibiting negative immunoregulation of CD4+CD25(high) T cells[J].PLoS One,2011,6(6):e19811.
[收稿2015-06-11修回2015-07-06]
(編輯張曉舟)
Tremella Polysaccharides attenuated sepsis through inhibiting abnormal CD4+CD25highregulatory T cells in mice
SHIZhen-Wei,XUYan,LIXiao-Lu,LIUQing-Yang.
DepartmentofNephrology,ChinaMeitanGeneralHospital,Beijing100028,China
[Abstract]Objective:To determine the effects of TPS on peripheral blood Tregs in sepsis mouse induced by burn plus P.aeruginosa infection.Methods: The experimental mice were separated into five groups randomly,including sham burn group,burn plus P.aeruginosa infection group,burn plus P.aeruginosa infection with TPS (50,100,200 mg/kg) treatment group.Peripheral blood Tregs were isolated with Magnetic Microbeads and cultured in vitro from the day after burn(PBD0) to 4 days after burn(PBD4).IL-10,IFN-γ,IL-4 levels in Tregs culture supernatants were determined by sandwich enzyme-linked immunosorbent assays (ELISA).Purification of CD4+CD25highTregs and CD4+T cells in C57BL/6 mice were administrated by magnetic beads sorting.Tregs and CD4+T cells were cultured in vitro after joining TPS to without TPS cells as a control.The phenotypes of Tregs were analyzed by flow cytometry,and cytokines were measured by ELISA.Results: Vis-a-vis the results of the untreated group,TPS could markedly decrease IL-4 and IL-10 secretion level and significantly increase the secretion of IFN-γ,and the secretion of IL-10 level and concentration of TPS dose effect.Vis-a-vis the results of the untreated group,in vitro experiment,without stimulation of TPS,CD4+T cell proliferation and IFN-γ were significantly reduced(P<0.05)and IL-4 levels increased significantly;CD4+T cell proliferation and IFN-γ were significantly increased and IL-4 levels were significantly reduced in the group of TPS with antibody-1;there was no significant difference in CD4+T cell proliferation and the levels of IFN-γ and IL-4 in the group of TPS with antibody-2.Conclusion: TPS could inhibit the abnormal activities of CD4+CD25highTregs in burn with P.aeruginosa infection mice,at least in part via inhibiting IL-10 secretion,and trigger a shift of Th2 to Th1 with activation of CD4+T cells in burn with P.aeruginosa infection mice.
[Key words]Tremella polysaccharides;Tregs;Sepsis;Burn;IL-10
中圖分類號R5
文獻標志碼A
文章編號1000-484X(2016)03-0313-05
通訊作者及指導教師:劉慶陽(1979年-),男,博士,副研究員,主要從事膿毒癥臨床及基礎研究。
作者簡介:史振偉(1971年-),男,博士,副主任醫師,主要從事腎臟疾病透析治療及基礎研究。
doi:10.3969/j.issn.1000-484X.2016.03.004
①本文為國家自然科學基金(81000847,81272140)、中國博士后面上項目(201150M1530)和中國博士后第五批特別資助項目(2012T50863)。
②同時供職于解放軍總醫院第一附屬醫院全軍燒傷研究所,北京100048。

