添加多酚對(duì)鯉魚肌原纖維蛋白結(jié)構(gòu)及膜性能的影響
張慧蕓,吳靜娟,段 續(xù)(河南科技大學(xué)食品與生物工程學(xué)院,河南 洛陽(yáng) 471023)
?
添加多酚對(duì)鯉魚肌原纖維蛋白結(jié)構(gòu)及膜性能的影響
張慧蕓,吳靜娟,段 續(xù)
(河南科技大學(xué)食品與生物工程學(xué)院,河南 洛陽(yáng) 471023)
摘 要:研究不同添加量(1%、2%、3%、4%、5%)多酚化合物(阿魏酸、鞣酸、迷迭香酸和丁香酸)對(duì)鯉魚肌原纖維蛋白結(jié)構(gòu)和膜特性的影響。結(jié)果表明,與丁香酸、迷迭香酸和阿魏酸相比,添加鞣酸的蛋白成膜液中自由氨基和巰基含量最低,表明鞣酸具有較高的蛋白交聯(lián)能力(P<0.05)。隨著多酚添加量的增加,膜的彈性和拉伸強(qiáng)度逐漸增強(qiáng),斷裂伸長(zhǎng)率逐漸降低(P<0.05),表明添加多酚化合物提高了膜的硬度和強(qiáng)度。在相同質(zhì)量分?jǐn)?shù)條件下,添加鞣酸的鯉魚肌原纖維蛋白膜具有最高的彈性和拉伸強(qiáng)度。添加多酚化合物有效降低了鯉魚肌原纖維蛋白膜的紫外和可見光透過率,降低程度取決于多酚的種類和濃度。添加多酚化合物的鯉魚肌原纖維蛋白膜可用于高脂食品的內(nèi)包裝,防止食品脂質(zhì)氧化、延長(zhǎng)貨架期。
關(guān)鍵詞:多酚;肌原纖維蛋白;結(jié)構(gòu);膜;性能
引文格式:
張慧蕓,吳靜娟,段續(xù).添加多酚對(duì)鯉魚肌原纖維蛋白結(jié)構(gòu)及膜性能的影響[J].食品科學(xué),2016,37(5):35-40.
ZHANG Huiyun,WU Jingjuan,DUAN Xu.Effect of polyphenolic compounds on protein structure and film properties of common carp myofibrillar protein[J].Food Science,2016,37(5):35-40.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605007.http://www.spkx.net.cn
可食性膜是以天然可食性物質(zhì)為原料,通過不同分子間相互作用形成的具有多孔網(wǎng)絡(luò)結(jié)構(gòu)的薄膜,可作為食品成分直接食用。隨著現(xiàn)代食品技術(shù)的發(fā)展和對(duì)綠色食品的推崇,可食性膜已成為食品保鮮與包裝領(lǐng)域研究的熱點(diǎn)[1]。與多糖和脂質(zhì)膜相比 ,蛋白膜具有更廣泛的功能特性,特別是具有更高的分子間結(jié)合潛力[2]。蛋白膜的性質(zhì)是由其微觀結(jié)構(gòu)決定的,蛋白質(zhì)結(jié)構(gòu)和多肽鏈分子間相互作用顯著影響蛋白膜的微觀結(jié)構(gòu)[3]。由于蛋白膜可選擇性阻隔水分轉(zhuǎn)移、氧氣透過、紫外和可見光透過和揮發(fā)性芳香物質(zhì)的損失,用于包裝可延長(zhǎng)食品貨架期,維持食品貯藏期間品質(zhì)[4-5],目前已被應(yīng)用于堅(jiān)果或焙烤食品的涂布膜[6]。
已有研究表明魚肉肌原纖維蛋白和肌漿蛋白可被用作成膜材料。如Chinabhark等[7]采用0.02 g/mL大眼鯛魚肌原纖維蛋白添加50%甘油塑化制備可食性蛋白膜,發(fā)現(xiàn)膜具有較高的拉伸強(qiáng)度和斷裂伸長(zhǎng)率。我國(guó)是一個(gè)漁業(yè)大國(guó),淡水魚類是我國(guó)居民食物的重要組成部分,是主要的動(dòng)物蛋白質(zhì)來(lái)源之一。鯉魚是中國(guó)分布最廣、養(yǎng)殖歷史最悠久的淡水經(jīng)濟(jì)魚類。適當(dāng)開發(fā)來(lái)自鯉魚肉的肌原纖維蛋白,獲得具有營(yíng)養(yǎng)和生物可降解性的食品包裝膜具有一定的應(yīng)用前景。但是,當(dāng)?shù)鞍啄け┞队诔睗駰l件下其機(jī)械性能相對(duì)較差,且與脂質(zhì)膜相比成本較高,限制了其作為食品包裝的應(yīng)用[8-9]。因此需要對(duì)蛋白質(zhì)進(jìn)行結(jié)構(gòu)改性以提高其機(jī)械強(qiáng)度和阻水性,可采用化學(xué)、物理和酶法改性[10],改善蛋白膜的性能。研究表明,不同來(lái)源的酚類化合物可與蛋白質(zhì)發(fā)生相互作用或反應(yīng),使明膠材料的凝膠或膜性能得到改善[11]。多酚可在氧化條件下與肽的氨基側(cè)鏈反應(yīng)形成蛋白交聯(lián)[12]。阿魏酸可通過產(chǎn)生共振穩(wěn)定的自由基中間體與蛋白質(zhì)和多糖交聯(lián)[13]。氧化阿魏酸可與蛋白質(zhì)中的氨基和硫醇基反應(yīng)[14]。而且,阿魏酸自身反應(yīng)形成的二阿魏酸可作為蛋白分子之間的連接橋梁[15]。鞣酸也具有結(jié)合蛋白質(zhì)的能力[16]。與其他交互作用相比,酚類化合物和蛋白質(zhì)共價(jià)鍵產(chǎn)生的共價(jià)交聯(lián)作用更強(qiáng),熱穩(wěn)定性更好。但是,關(guān)于酚類化合物對(duì)魚肌原纖維蛋白結(jié)構(gòu)及其膜性能影響的報(bào)道甚少。本實(shí)驗(yàn)以鯉魚肌原纖維蛋白為原料,甘油為增塑劑,添加具有蛋白交聯(lián)作用的幾種多酚化合物(阿魏酸、鞣酸、迷迭香酸和丁香酸),制備鯉魚肌原纖維蛋白-多酚復(fù)合可食性膜,主要研究多酚添加對(duì)肌原纖維蛋白結(jié)構(gòu)及膜物理和機(jī)械 性能的影響,以期為開發(fā)應(yīng)用新型可食包裝技術(shù)提供理論參考。
1 材料與方法
1.1材料與試劑
鮮活鯉魚購(gòu)于洛陽(yáng)市大張盛德美超市。
三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)、5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB) 美國(guó)Sigma公司;迷迭香酸、丁香酸、阿魏酸(純度>98%) 上海純優(yōu)生物科技有限公司;鞣酸(純度>99%) 河北百味生物科技有限公司;亞硫酸鈉、溴化鈉 天津博迪化工有限公司;所用試劑均為分析純。
1.2儀器與設(shè)備
DHG-9003型電熱恒溫鼓風(fēng)干燥箱 上海精宏實(shí)驗(yàn)設(shè)備有限公司;UV-754型紫外-可見光分光光度計(jì)上海光譜儀器有限公司;TA-XT2i質(zhì)構(gòu)儀 英國(guó)Stable Micro Systems公司;CS-32l便攜式色差儀 日本美能達(dá)公司。
1.3方法
1.3.1鯉魚肌原纖維蛋白的提取
鯉魚肌原纖維蛋白提取參照Chin[15]和Jiang Xinjing[17]等的方法并適當(dāng)修改,提取液采用20 mmol/L、pH 7.5的磷酸鹽緩沖液,漂洗液采用0.1 mol/L NaCl。提取過程在4 ℃條件下操作。
1.3.2鯉魚肌原纖維蛋白成膜液的制備
參考Shiku等[18]的方法,略有修改。配制0.015 g/mL的魚肌原纖維蛋白溶液,攪拌15 min使其充分溶解,冷卻后加入50%的甘油,室溫下攪拌30 min。用1 mol/L NaOH調(diào)節(jié)溶液pH值為11,分別添加0(對(duì)照組)、1%、2%、3%、4%和5%的迷迭香酸、丁香酸、阿魏酸和鞣酸,室溫下連續(xù)充氧攪拌1 h使部分多酚化合物氧化為醌,醌可在堿性條件下與蛋白質(zhì)氨基發(fā)生反應(yīng)[13-14]。得到成膜液用于分析及干燥成膜。
1.3.3添加多酚對(duì)鯉魚肌原纖維蛋白結(jié)構(gòu)的影響
1.3.3.1自由氨基含量的測(cè)定
參考Lertittikul等[19]的方法進(jìn)行自由氨基含量的測(cè)定。取125 μL適當(dāng)稀釋的樣品與2.0 mL 0.212 5 mol/L的磷酸鹽緩沖溶液(phosphate buffer saline,PBS)(pH 8)充分混合,加入1.0 mL質(zhì)量分?jǐn)?shù)0.01%的三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)溶液。混合液放入50 ℃水浴中避光保持30 min后,加入2.0 mL 0.1 mol/L亞硫酸鈉終止反應(yīng)。將混合物放于室溫下冷卻15 min后,采用分光光度計(jì)測(cè)定其420 nm波長(zhǎng)處的吸光度。自由氨基含量根據(jù)L-亮氨酸標(biāo)準(zhǔn)曲線計(jì)算得出,單位為mmol/L。
1.3.3.2總巰基含量的測(cè)定
參考Beveridge等[20]的方法測(cè)定成膜液的總巰基含量。取1.0 mL樣品成膜液加入9 mL鹽酸胍磷酸緩沖液(鹽酸胍6 mol/L,PBS 0.1 mol/L,pH 8.0),取4 mL上述混合液加入0.4 mL 質(zhì)量分?jǐn)?shù)0.1% DTNB ,45 ℃保溫,反應(yīng)25 min,采用分光光度計(jì)測(cè)定其412 nm波長(zhǎng)處的吸光度。巰基含量用摩爾吸光系數(shù)13 600 L/(mol·cm)計(jì)算,表示為每克蛋白質(zhì)所含的摩爾數(shù)。
1.3.4鯉魚肌原纖維蛋白膜的制備
將4 g成膜液倒入有機(jī)玻璃板(5 cm×5 cm)中,在60 ℃的干燥箱中干燥3 h成膜。之后在裝有飽和NaBr溶液的干燥器中(相對(duì)濕度56%,20 ℃)平衡48 h,待測(cè)。
1.3.5添加多酚對(duì)鯉魚肌原纖維蛋白膜性能的影響
1.3.5.1膜機(jī)械性能的測(cè)定
參考Yin等[21]的方法,采用質(zhì)構(gòu)儀TA-XT2i測(cè)定膜的彈性模量(E)、拉伸強(qiáng)度(tensile strength,TS)和斷裂伸長(zhǎng)率(elongation at break,EAB),每種膜測(cè)定5 個(gè)樣品,每個(gè)樣品尺寸為2 cm×5 cm。質(zhì)構(gòu)分析儀初設(shè)夾距為50 mm,拉伸速率設(shè)為30 mm/min。樣品測(cè)試前在25 ℃、50%相對(duì)濕度條件下平衡2 d。彈性模量由膜應(yīng)力應(yīng)變圖的初始斜率測(cè)得,拉伸強(qiáng)度和斷裂伸長(zhǎng)率按下式計(jì)算。

式中:Fmax為最大拉力/N;L為膜樣品的厚度/mm;W為膜樣品的寬度/mm。
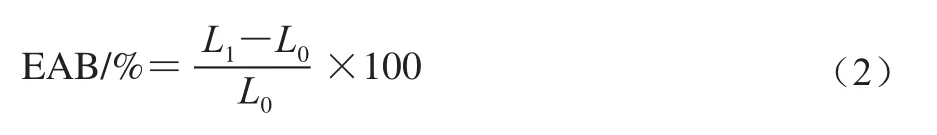
式中:L1為膜斷裂后的長(zhǎng)度/mm;L0為膜斷裂前的長(zhǎng)度/mm。
1.3.5.2顏色值的測(cè)定[22]
使用便攜式色差計(jì)對(duì)其進(jìn)行測(cè)定,參照CIELAB系統(tǒng)表示復(fù)合膜的顏色。將膜樣品平放在白色校正板上,校正板型號(hào)CR-A43,其中L*=94.0,a*=0.313,b*=0.319,測(cè)試記錄+L*值為亮色方向,-L*值為暗色方向、+a*值為紅色方向,-a*值為綠色方向、+b*值為黃色方向,-b*值為藍(lán)色方向以及ΔE值。每個(gè)樣品選擇5 個(gè)點(diǎn)進(jìn)行測(cè)量,一個(gè)點(diǎn)從中央選取,另外沿著膜四周取4 個(gè)點(diǎn),取平均值。
1.3.5.3透光率的測(cè)定
參考Shiku等[23]的方法,用紫外-可見分光光度計(jì)測(cè)定膜在200~800 nm波長(zhǎng)范圍內(nèi)的透光率,每個(gè)樣品重復(fù)測(cè)定3 次,取平均值。
1.4數(shù)據(jù)分析
所得數(shù)據(jù)均為3 次重復(fù)的平均值,用Statistix 8(分析軟件,St Paul,MN)進(jìn)行數(shù)據(jù)分析,平均數(shù)之間差異顯著性(P<0.05)通過最小顯著差值(least s ignificant difference,LSD)進(jìn)行判斷,用Sigmaplot 9.0軟件作圖。
2 結(jié)果與分析
2.1添加多酚對(duì)鯉魚肌原纖維蛋白成膜液中自由氨基含量的影響
添加多酚對(duì)鯉魚肌原纖維蛋白自由氨基含量的影響如圖1所示。添加多酚的成膜液與對(duì)照組相比自由氨基含量較低(P<0.05),且隨著多酚添加量的增加,成膜液中自由氨基含量顯著降低(P<0.05)。這是由于蛋白質(zhì)氨基酸的α-或ε-NH2可與酚類化合物產(chǎn)生共價(jià)交聯(lián)作用,在較大范圍內(nèi)形成了酚-蛋白復(fù)合物,尤其在較高濃度酚類化合物的情況下,酚類化合物的氧化產(chǎn)物——醌具有較強(qiáng)的攻擊氨基活性[13-14]。與丁香酸、迷迭香酸和阿魏酸相比,添加鞣酸的蛋白成膜液中自由氨基含量最低,表明鞣酸具有較高的蛋白交聯(lián)能力(P<0.05)。這是由于鞣酸中羥基含量較高,羥基可被轉(zhuǎn)化為具有交聯(lián)作用的醌[14,24],此外,剩余羥基可通過弱鍵與氨基相互作用[25]。Prigent[26]報(bào)道了酚類化合物的羥基與氨基酸的氮或氧的相互作用,酚類化合物和氨基酸之間亦可發(fā)生疏水相互作用。
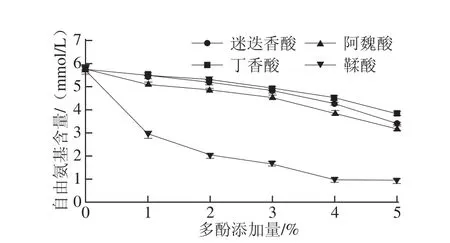
圖1 添加多酚對(duì)鯉魚肌原纖維蛋白自由氨基含量的影響Fig.1 Free amino group contents of film-forming solutions(FFS)containing fish myofibrillar proteins added with various phenolic compounds at different concentrations
2.2添加多酚對(duì)鯉魚肌原纖維蛋白成膜液中總巰基含量的影響
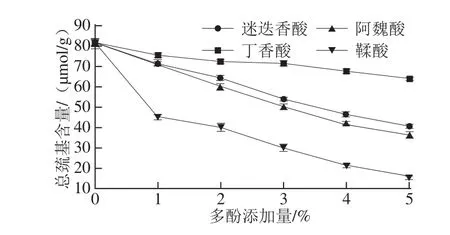
圖2 添加多酚對(duì)鯉魚肌原纖維蛋白總巰基含量的影響Fig.2 Sulfhydryl group contents of film-forming solutions(FFS)containing fish myofibrillar proteins added with various phenolic compounds at different concentrations
添加多酚化合物對(duì)鯉魚肌原纖維蛋白總巰基含量的影響如圖2所示。與對(duì)照組相比,添加多酚化合物的成膜液具有較低的巰基含量(P<0.05)。多酚的添加可能會(huì)引起蛋白質(zhì)巰基和多酚羥基之間的相互作用,形成更好的構(gòu)造。巰基含量的降低可能是由于添加多酚提高了巰基氧化為二硫鍵的程度[26]。而且,多酚氧化產(chǎn)物——醌類化合物亦可直接與巰基相互作用[14],導(dǎo)致巰基被醌類化合物掩蔽。咖啡酸和鞣酸在不同濃度水平下均引起巰基含量的較大降低。添加多酚化合物有助于魚肌原纖維蛋白膜二硫鍵的形成,提高了膜的強(qiáng)度與剛度。
2.3添加多酚對(duì)鯉魚肌原纖維蛋白膜機(jī)械性能的影響
不同添加量的多酚對(duì)鯉魚肌原纖維蛋白膜彈性、拉伸強(qiáng)度和斷裂伸長(zhǎng)率的影響見圖3。如圖3A所示,隨著多酚添加量的增加,膜的彈性均顯著增強(qiáng)(P<0.05)。對(duì)照組膜的彈性值最低,為153.45 MPa,添加1%阿魏酸的蛋白膜彈性值與對(duì)照組差異不顯著(P>0.05)。如圖3B所示,隨著多酚添加量的增加,膜的拉伸強(qiáng)度也逐漸增加(P<0.05),添加3%~5%的迷迭香酸和丁香酸時(shí)膜的拉伸強(qiáng)度增加不再顯著(P>0.05)。膜的強(qiáng)度和剛度增加是由于氧化酚類增強(qiáng)了蛋白膜中非二硫共價(jià)鍵與二硫鍵及非共價(jià)鍵之間的交聯(lián)作用,表1中蛋白成膜液自由氨基和巰基含量的降低也證實(shí)了這一點(diǎn)。
如圖3C所示,添加1%~5%的多酚降低了膜的斷裂伸長(zhǎng)率(P<0.05),添加3%~5%迷迭香酸對(duì)膜斷裂伸長(zhǎng)率的影響差異不再顯著(P>0.05)。多酚的添加增強(qiáng)了膜蛋白鏈的相互作用,使膜的強(qiáng)度和硬度增加,延展性降低,這是由于在堿性條件下酚類化合物可被氧化為醌,醌可作為蛋白交聯(lián)劑與蛋白質(zhì)分子的親核性氨基或巰基側(cè)鏈反應(yīng)形成C—N或C—S共價(jià)鍵[14],還可引起蛋白質(zhì)之間形成非二硫共價(jià)鍵,導(dǎo)致蛋白質(zhì)分子之間的相互連接更加緊密,改善膜的彈性和拉伸強(qiáng)度。此外,多酚化合物的羥基可通過氫鍵與蛋白質(zhì)分子的氫受體結(jié)合。Rattaya等[9]報(bào)道了添加海藻提取物的膠原蛋白膜機(jī)械性能增強(qiáng)主要是由于蛋白質(zhì)和多酚之間的疏水作用和氫鍵結(jié)合力作用。
在相同添加量條件下,添加鞣酸的蛋白膜具有最高的彈性和拉伸強(qiáng)度,其次是迷迭香酸、丁香酸和阿魏酸。這可能是由于與其他多酚化合物相比,鞣酸對(duì)肌原纖維蛋白具有更大的交聯(lián)能力,蛋白成膜液的自由氨基含量測(cè)定結(jié)果也證實(shí)了這一點(diǎn)。這表明不同結(jié)構(gòu)的酚類化合物與蛋白質(zhì)的相互作用不同。添加羥基含量高的多酚化合物有利于蛋白質(zhì)-多酚之間氫鍵的形成和膜網(wǎng)絡(luò)結(jié)構(gòu)的改善[13-14]。Cao Na等[11]報(bào)道了向堿性膠原蛋白成膜液中添加阿魏酸和鞣酸使膜的拉伸強(qiáng)度顯著增加;Friesen等[27]報(bào)道了向堿性大豆分離蛋白成膜液中添加阿魏酸使膜的拉伸強(qiáng)度顯著增加。
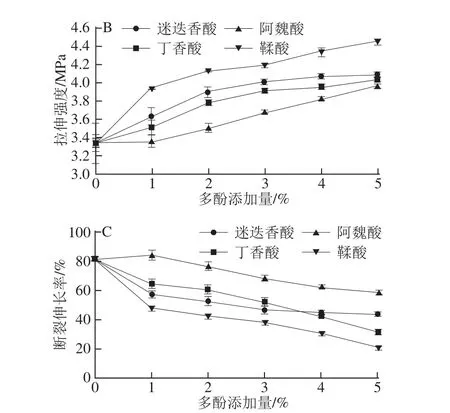
圖3 添加多酚對(duì)鯉魚肌原纖維蛋白膜彈性(A)、拉伸強(qiáng)度(BB)和斷裂伸長(zhǎng)率(CC)的影響Fig.3 Young’s modulus(A),tensile properties(B)and elongation(C)at break of fish myofibrillar protein films incorporated with various phenolic compounds
2.4添加多酚對(duì)鯉魚肌原纖維蛋白膜顏色值的影響
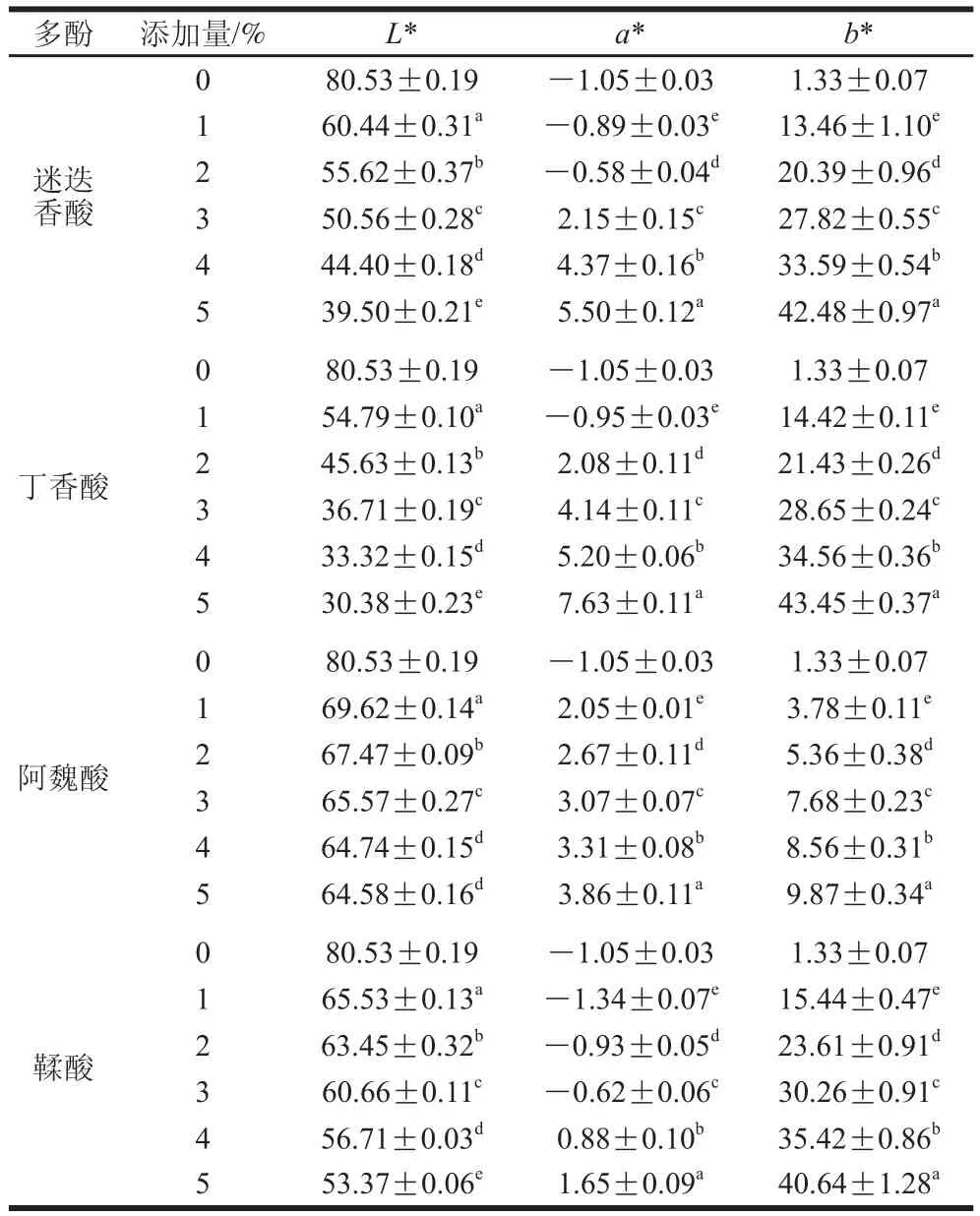
表1 添加多酚對(duì)鯉魚肌原纖維蛋白膜顏色的影響Table 1 Color parameters of fish myofibrillar protein films added with various phenolic compounds at different concentrations
不同添加量多酚化合物對(duì)鯉魚肌原纖維蛋白膜顏色值的影響如表1所示。隨著多酚添加量的增加,膜顏色強(qiáng)度增加。與對(duì)照組相比,添加1%~5%多酚化合物使膜的L*值降低,a*值和b*值升高(P<0.05)。添加4%和5%阿魏酸的蛋白膜L*值差異不顯著(P>0.05)。添加多酚化合物的種類和濃度極大影響了鯉魚肌原纖維蛋白膜的顏色,這是由不同酚類化合物的色素含量、類型及化學(xué)組成不同引起的。Rattaya等[9]報(bào)道了向膠原蛋白膜中添加海藻提取物引起膜顏色的變化是由于海藻提取物中色素的影響。Nuthong等[28]報(bào)道了添加氧化咖啡酸使豬血漿蛋白膜的b*值增加。
2.5添加多酚對(duì)鯉魚肌原纖維蛋白膜透光率的影響
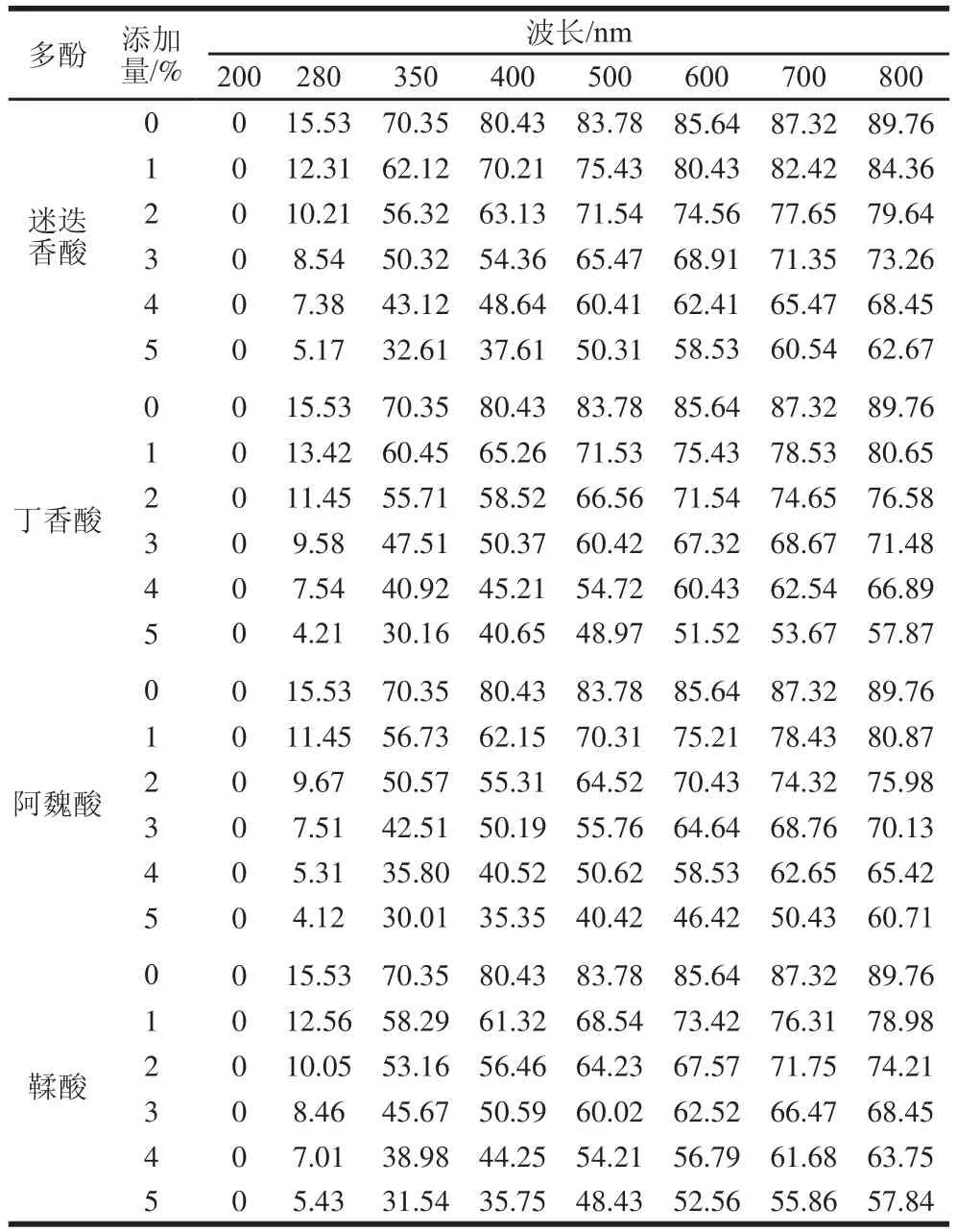
表2 添加多酚對(duì)鯉魚肌原纖維蛋白膜透光率的影響Table 2 Light transmittance of fish myofibrillar protein films added with various phenolic compounds at different concentrations %
添加多酚對(duì)鯉魚肌原纖維蛋白膜紫外光和可見光透光率的影響如表2所示。在200~280 nm波長(zhǎng)范圍內(nèi),添加不同多酚化合物均降低了膜的紫外光透過率。多酚添加量較高的蛋白膜具有較低的紫外光透過率。由于紫外光可使食品產(chǎn)生有害變化特別是脂質(zhì)氧化,因此膜透光率的降低對(duì)食品保藏是有利的。在可見光范圍(350~800 nm)內(nèi),對(duì)照膜的透光率為80%~90%,添加多酚化合物導(dǎo)致膜的透光率降低。膜的光學(xué)特性是膜的重要屬性,影響產(chǎn)品的外觀、適銷性及應(yīng)用性[5],透明度高的可食性膜在食品包裝系統(tǒng)中具有較高的應(yīng)用性和可接受性。隨著多酚化合物添加量的增加,膜的可見光透過率降低。這是由于較高濃度的多酚化合物具有較高的阻光性,導(dǎo)致膜在可見光范圍內(nèi)具有有限的透光率。多酚對(duì)膜可見光透過性的影響取決于多酚的種類、多酚在膜基質(zhì)中的含量和分布,具有不同透光率的膜基質(zhì)形態(tài)亦不同。
3 結(jié) 論
添加多酚化合物可有效加強(qiáng)鯉魚肌原纖維蛋白的交聯(lián)或相互作用,改善鯉魚肌原纖維蛋白膜的性能,提高膜的硬度和強(qiáng)度。由于鞣酸具有較高的蛋白交聯(lián)效率,添加鞣酸的膜具有較高的拉伸強(qiáng)度。添加多酚化合物可對(duì)膜的顏色和透光率產(chǎn)生影響,在紫外和可見光范圍內(nèi),添加多酚化合物增加了膜的阻光性,有利于防止包裝食品的脂質(zhì)氧化。因此可通過選擇性添加酚類化合物改善鯉魚肌原纖維蛋白膜的物理和機(jī)械特性。
參考文獻(xiàn):
[1]SHAH A A,HASAN F,HAMEED A,et al.Biological degradation of plastics:a comprehensive review[J].Biotechnology Advances,2008,26(3):246-265.DOI:10.1016/j.biotechadv.2007.12.005.
[2]TONGNUANCHAN P,BENJAKUL S,PRODPRAN T.Physicochemical properties,morphology and antioxidant activity of film from fish skin gelatin incorporated with root essential oils[J].Journal of Food Engineering,2013,117(3):350-360.DOI:10.1016/j.jfoodeng.2013.03.005.
[3]NUANMANO S,PRODPRAN T,BENJAKULS.Potential use of gelatin hydrolysate as plasticizer in fish myofibrillar protein film[J].Food Hydrocolloids,2015,47:61-68.DOI:10.1016/j.foodhyd.2015.01.005.
[4]馬越,張超,趙曉燕,等.含花青素大豆蛋白可食膜對(duì)油脂貯藏的影響[J].中國(guó)糧油學(xué)報(bào),2010,25(3):22-25.
[5]JONGJAREONRAK A,BENJAKUL S,VISESSANGUAN W,et al.Antioxidative activity and properties of fish skin gelatin films incorporated with BHT and α-tocopherol[J].Food Hydrocolloids,2008,22(3):449-458.DOI:10.1016/j.foodhyd.2007.01.002.
[6]PEELMANA N,RAGAERTA P,de MEULENAERB B,et al.Application of bioplastics for food packaging[J].Trends in Food Science & Technology,2013,32(2):128-141.DOI:10.1016/j.tifs.2013.06.003.
[7]CHINABHARK K,BENJAKUL S,PRODPRAN T.Effect of pH on the properties of protein-based fi lm from bigeye snapper(Priacanthus tayenus)surimi[J].Bioresource Technology,2007,98(1):221-225.DOI:10.1016/j.biortech.2005.11.012.
[8]ARTHARN A,PRODPRAN T,BENJAKUL S.Round scad proteinbased film:storage stability and its effectiveness for shelf-life extension of dried fish powder[J].LWT-Food Science and Technology,2009,42(7):1238-1244.DOI:10.1016/j.lwt.2008.08.009.
[9]RATTAYA S,BENJAKUL S,PRODPRAN T.Properties of fish skin gelatin film incorporated with seaweed extract[J].Journal of Food Engineering,2009,95(1):151-157.DOI:10.1016/j.jfoodeng.2009.04.022.
[10]ZHANG X,DO M D,CASEY P,et al.Chemical cross-linking gelatin with natural phenolic compounds as studied by high-resolutionNMR spectroscopy[J].Biomacromolecules,2010,11(4):1125-1132.DOI:10.1021/bm1001284.
[11]CAO N,FU Y H,HE J H.Mechanical properties of gelatin films cross-linked,respectively,by ferulic acid and tannin acid[J].Food Hydrocolloids,2007,21(4):575-584.DOI:10.1016/j.foodhyd.2006.07.001.
[12]STRAUSS G,GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18:81-89.DOI:10.1016/S0268-005X(03)00045-6.
[13]YANG F,ZHOU B R,ZHANG P,et al.Binding of ferulic acid to cytochrome c enhances stability of the protein at physiological pH and inhibits cytochrome c-induced apoptosis[J].Chemico-Biological Interactions,2007,170(3):231-243.DOI:10.1016/j.cbi.2007.08.005.
[14]OU S Y,WANG Y,TANG S Z,et al.Role of ferulic acid in preparing edible fi lms from soy protein isolate[J].Journal of Food Engineering,2005,70(2):205-210.DOI:10.1016/j.jfoodeng.2004.09.025.
[15]CHIN K B,GO M Y,XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminase·mediated,heat induced porcine myofibrillar protein gel:effect of salt level and transglutaminase incubation[J].Meat Science,2009,8l(3):565-572.DOI:10.1016/j.meatsci.2008.10.012.
[16]INTARASIRISAWAT R,BENJAKUL S,VISESSANGUAN W.Stability of emulsion containing skipjack roe protein hydrolysate modifi ed by oxidised tannic acid[J].Food Hydrocolloids,2014,41(12):146-155.DOI:10.1016/j.foodhyd.2014.03.034.
[17]JIANG X J,ZHANG Z J,CAI H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006,94(4):498-503.DOI:10.1016/j.foodchem.2004.11.046.
[18]SHIKU Y,HAMAGUCHI P Y,TANAKA M.Effect of pH on the preparation of edible films based on fish myofibrillar proteins[J].Fisheries Sciences,2003,69(5):1026-1032.DOI:10.1046/j.1444-2906.2003.00722.x.
[19]LERTITTIKUL W,BENJAKUL S,TANAKA M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.DOI:10.1016/j.foodchem.2005.09.085.
[20]BEVERIDGE T,TOMA S J,NAKAI S.Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science,1974,39(1):49-51.
[21]YIN S,TANG C,WEN Q,et al.Properties of cast films Hemp(Cannabis sativa L.)and soy protein isolates a comparative study[J].Journal of Agricultural and Food Chemistry,2007,55:7399-7404.
[22]葉文斌,樊亮,贠漢伯.添加中草藥對(duì)黃原膠-長(zhǎng)角豆半乳甘露聚糖復(fù)合膜性質(zhì)的影響[J].食品科學(xué),2012,34(13):24-28.DOI:10.7506/spkx1002-6630-201313006.
[23]SHIKU Y,HAMAGUCHI P Y,BENJAKUL S,et al.Effect of surimi quality on properties of edible films based on Alaska Pollack[J].Food Chemistry,2004,86(4):493-499.DOI:10.1016/j.foodchem.2003.09.022.
[24]BALANGE A K,BENJAKUL S,Effect of oxidised tannic acid on the gel properties of mackerel(Rastrelliger kanaguita)mince and surimi prepared by different washing processes[J].Food Hydrocolloids,2009,23:1693-1701.DOI:10.1016/j.foodhyd.2009.01.007.
[25]LANIER T C,PARK J W.Surimi and surimi seafood[M].New York:Marcel Dekker,2000:237-265.
[26]PRIGENT S.Interactions of phenolic compounds with globular proteins and their effects on food related functional properties[D].The Netherlands:Wageningen University,2005.
[27]FRIESEN K,CHANG C,NICKERSON M.Incorporation of phenolic compounds,rutin and epicatechin,into soy protein isolate films:mechanical,barrier and cross-linking properties[J].Food Chemistry,2015,172(4):18-23.DOI:10.1016/j.foodchem.2014.08.128.
[28]NUTHONG P,BENJAKUL S,PRODPRAN T.Effect of phenolic compounds on the properties of porcine plasma protein-based film[J].Food Hydrocolloids,2009,23:736-741.DOI:10.1016/j.foodhyd.2008.08.003.
Effect of Polyphenolic Compounds on Protein Structure and Film Properties of Common Carp Myofibrillar Protein
ZHANG Huiyun,WU Jingjuan,DUAN Xu
(College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471023,China)
Abstract:The objective of this study was to investigate the effects of several polyphenolic compounds(ferullic acid,tannic acid,rosmarinic acid and syringic acid)at various concentrations(1%,2%,3%,4% and 5% based on protein)on structure and properties of fi lm from myofi brillar protein of common carp(Cyprinus carpio).Among all the investigated polyphenolic compounds,tannic acid showed the highest cross-linking capacity on myofi brillar protein as evidenced by in the lowest free amino group and sulfhydryl group contents in the fi lm-forming protein solution.The addition of polyphenolic compounds could enhance mechanical properties of the resulting films.With increasing concentration of polyphenolic compounds added,Young’s modulus(E)and tensile strength(TS)of the fi lms increased,while their elongation at break(EAB)decreased (P<0.05),suggesting stronger and stiffer fi lm structure.At the same concentration used,tannic acid could result in higher mechanical properties(elasticity and tensile strength)of the fi lm when compared with other polyphenolic compounds.The transparency and color of the film were reduced by polyphenolic compounds,depending on the type and concentration.Therefore,polyphenolic compounds can potentially be applied in inner packaging materials for high-fat foods to prevent lipid oxidation,thus prolonging the shelf-life of foods during storage.
Key words:polyphenolic compounds; myofi brillar proteins; structure; fi lm; properties
中圖分類號(hào):TS201.2
文獻(xiàn)標(biāo)志碼:A
文章編號(hào):1002-6630(2016)05-0035-06
DOI:10.7506/spkx1002-6630-201605007 10.7506/spkx1002-6630-201605007.http://www.spkx.net.cn
作者簡(jiǎn)介:張慧蕓(1977—),女,副教授,博士,主要從事天然產(chǎn)物活性研究。E-mail:zhanghuiyun21@163.com
基金項(xiàng)目:河南人才培養(yǎng)聯(lián)合基金項(xiàng)目(C2003)
收稿日期:2015-03-30

