真菌發酵胞外多糖的研究進展
楊同香,吳孔陽,陳俊亮,唐浩國,康懷彬(.河南科技大學食品與生物工程學院,河南 洛陽 4703;.洛陽師范學院生命科學學院,河南 洛陽 470)
?
真菌發酵胞外多糖的研究進展
楊同香1,吳孔陽2,陳俊亮1,唐浩國1,康懷彬1
(1.河南科技大學食品與生物工程學院,河南 洛陽 471023;2.洛陽師范學院生命科學學院,河南 洛陽 471022)
摘 要:真菌胞外多糖具有高黏性、抗氧化、抗病毒和抗腫瘤等多種生物學活性,在食品和醫藥工業等領域應用廣泛。本文結合國內外最新研究成果,綜述了近年來有關產胞外多糖的真菌、影響真菌胞外多糖產量的因素、產胞外多糖的菌株的選育策略以及真菌胞外多糖的功能研究,以期為真菌發酵胞外多糖的研究和應用提供參考。
關鍵詞:真菌胞外多糖;產量;發酵;功能
引文格式:
楊同香,吳孔陽,陳俊亮,等.真菌發酵胞外多糖的研究進展[J].食品科學,2016,37(5):265-270.DOI:10.7506/spkx1002-6630-201605046.http://www.spkx.net.cn
YANG Tongxiang,WU Kongyang,CHEN Junliang,et al.Recent advances in fungal exopolysaccharide fermentation[J].Food Science,2016,37(5):265-270.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605046.http://www.spkx.net.cn
多糖在自然界分布極其廣泛,植物、動物和微生物體內均有存在,胞外多糖(exopolysaccharide,EPS)通常指微生物在生長代謝過程中分泌到細胞外的一類多糖[1-3]。由于微生物EPS具有多元化的多糖結構和不同的流變學特性,在生物技術領域應用前景十分廣闊[4]。近年來,研究人員對微生物EPS開展了廣泛的研究,主要包括菌株的分離和鑒定、產EPS菌株選育、EPS生物合成途徑、工程菌構建、發酵條件的優化、EPS的分離、純化、結構鑒定及其生物學活性的研究等,尤其是對細菌EPS的研究進行了較全面的歸納和總結[4-7],而單就對真菌發酵EPS的研究概述則相對較少。另外,如何獲得高產EPS產生菌以及如何提高EPS產量,也是研究人員一直以來關心的問題。因此,本課題組結合自己的研究工作,從EPS產生菌、影響真菌EPS產量的因素、產EPS的菌株的選育策略等方面對真菌發酵EPS的研究做一簡要概述。
1 真菌EPSS產生菌
目前公開報道產EPS的真菌至少有上百種[8]。以往研究人員主要從陸地(包括極地環境)采樣并分離產EPS的真菌,近些年發現海洋蘊藏著數量豐富且能產生結構新穎EPS的真菌[9]。本文將近5 a有關產EPS真菌的文獻進行歸納,見表1。大多數研究者選擇馬鈴薯葡萄糖瓊脂培養基(potato dextrose agar,PDA)對產EPS真菌的培養和分離。由于不同真菌生長特性差異,培養溫度一般在18~30 ℃。所產EPS的結構也因菌株種屬差異而種類繁多,通常發現的真菌EPS以雜多糖居多,當然也有關于同多糖的報道,如Mukhopadhyay等[10]鑒定了一株產EPS的南極土壤嗜冷真菌Thelebolus sp.IITKGP-BT12,進一步研究發現該EPS為葡聚糖,且在基礎鹽培養基中,多糖產量高達1.94 g/L。

表1 近5 a報道產EPS的真菌Table 1 Exopolysaccharide production by fungi reported in last five years
2 影響真菌EPS產量的因素
研究發現EPS的生物合成是在細胞內進行,然后分泌到細胞外。而這一過程通常受到諸多因素影響,其中對EPS產量的影響主要受到真菌類型、培養基組成以及發酵條件等因素。
2.1真菌類型
對于未研究的和未開發的真菌,不在統計范圍之類,從公開報道的真菌發酵EPS水平來看,擔子菌通常比絲狀真菌和酵母菌EPS的產量要高[8]。本文對近年來真菌發酵EPS的文獻進行歸納(表2),從表2中可以基本了解不同真菌發酵產EPS的能力。
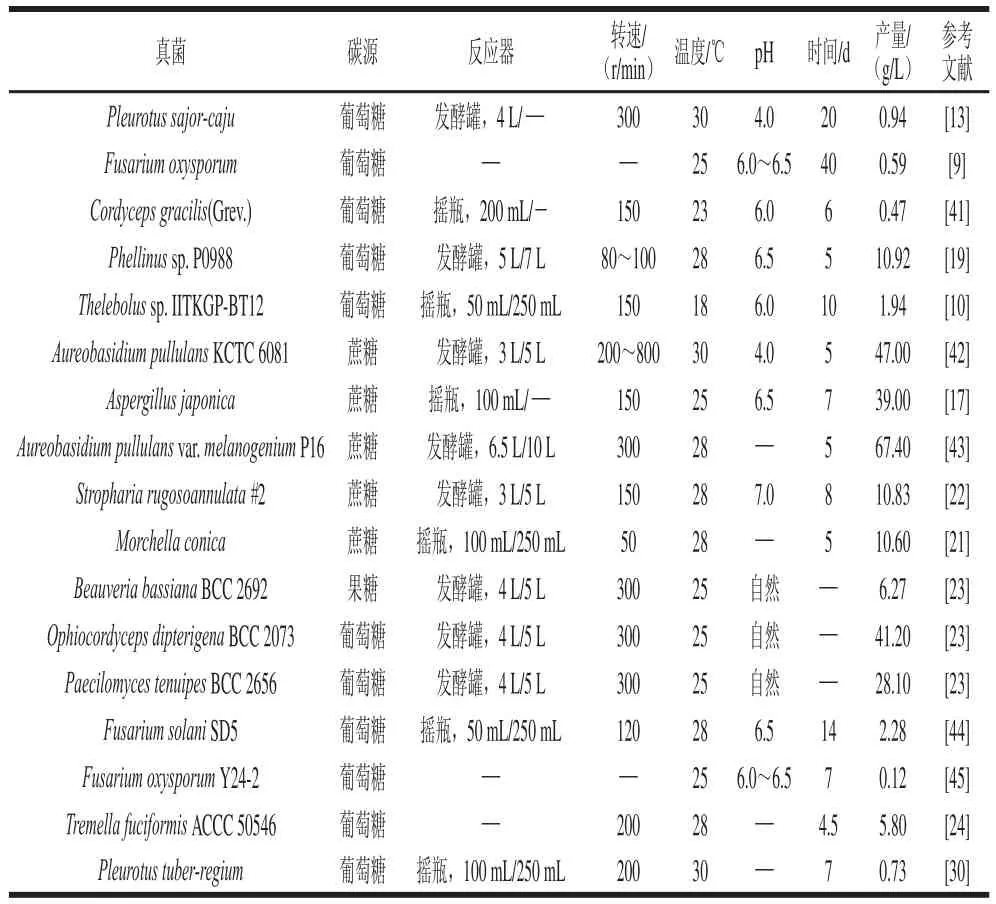
表2 國內外部分真菌EPSS產量Table 2 Overseas studies on the production of fungal exopolysaccharide
2.2培養基組成
研究表明培養基組成對EPS產量的影響至關重要。微生物發酵EPS,對碳源選擇具有一定的偏好性,細菌通常利用蔗糖發酵EPS[32],真菌則通常利用葡萄糖發酵EPS(表2),并且在該條件下可以促進菌絲生長和獲得較多的多糖。對于氮源而言,多數真菌發酵EPS,會考慮使用酵母粉[33],有些會輔以脫脂牛奶作為氮源[34]。不過對于工業化發酵生產EPS,最好還要考慮到原料的價格,Sharma等[35]對A.pullulans RBF 4A3利用5 種不同的農副產品作為營養來源發酵生產普魯蘭多糖進行研究,結果發現添加有玉米漿和葡萄糖的培養基,菌株產多糖水平上升,而且經過單因素條件優化后,普魯蘭多糖的產量提高了14%,質量濃度達到88.59 g/L。相關研究結果表明,磷酸鹽對于真菌發酵EPS這一過程非常重要,其中磷酸二氫鉀和磷酸氫二鉀被認為是最為有效的磷源補充劑,而對于其他的一些無機鹽,硫酸鎂則被認為對真菌發酵EPS有很好促進作用[8]。另外,在真菌發酵EPS過程中,添加某些因子也可以提高真菌發酵EPS水平。這些因子包括植物油、脂肪酸、表面活性劑、核苷酸和維生素等。比如Sheng Long等[36]研究了尿嘧啶對Aureobasidium pullulans CGMCC1234發酵多糖的影響,當菌株發酵48 h時,向培養基中添加5 mmol/L的尿嘧啶,結果發現與不加尿嘧啶的對照組相比,Aureobasidium pullulans CGMCC1234普魯蘭多糖質量濃度達到49.07 g/L,提高了30%。Sheng Long等[37]發現在培養基中加入體積分數為0.5%的吐溫-80可以顯著提高Aureobasidium pullulans CGMCC1234普魯蘭多糖的產量。事實上,其他研究結果也表明吐溫-80能夠促進對多種真菌EPS的合成,并從蛋白質組學角度去闡述吐溫-80的作用機制[38-39]。
培養基的組分可以直接影響菌體的生長狀況,菌體生長狀況與EPS產量是否有關聯,尚無統一的論證。培養基中的某些成分盡管能夠促進菌體生長,但會減少EPS產量。Wu Shengjun等[25]研究發現來源于Aureobasidium pullulans CJ001所產的普魯蘭多糖,與細胞生物量沒有相關性,而這與某些細菌EPS產量與生物量相關的結論不一致[40],這有助于研究人員更好地認識菌株類型和培養基差異對真菌發酵EPS的影響。
2.3發酵條件
菌株深層培養技術在商業上被認為是真菌發酵多糖十分有效的方法,且未出現顯著的污染問題[46]。大量研究表明真菌發酵EPS需要在好氧條件下完成,溶氧限制將影響EPS產量。Ruperez等[47]通過靜息培養和深層培養兩種方式比較了Aspergillus parasiticus發酵EPS的能力,結果發現深層培養條件下所得到的EPS產量是靜息培養條件下的2.3 倍。目前有關真菌發酵EPS條件研究,多集中于對發酵培養基和發酵產EPS條件的優化,所涉及的實驗方法采用常規的統計方法,包括單因素試驗、正交試驗、部分因子試驗以及中心組合試驗等優化EPS產量[23,41,44]。不同于細菌生長周期快,真菌發酵EPS通常需要較長的時間,一般需要1 周左右,多的甚至需要發酵20 d(表2)。
3 EPS菌株的選育策略
獲得高產EPS的菌株是發酵優化的前提。對于真核微生物而言,當傳統微生物育種技術難以對某些特定菌株的產多糖水平有較大提高時,有必要開發新的菌種選育技術。當然,研究人員需要根據菌株自身特性及實驗室條件來設計合理的選育路線。通常情況下,可以在傳統育種技術基礎上,通過改良或引入新開發的高效微生物進化育種技術獲得高產EPS突變株。比如Liu Bin等[48]采用常溫常壓等離子體技術對海洋Crypthecodinium cohnii進行突變選育,獲得一株高產EPS突變子M7,EPS產量達到1.02 g/L,較出發菌株提高了33.85%。DNA改組技術也可獲得高產EPS的突變株,Kang Jianxiong等[49]通過在紫外/甲基磺酸乙酯誘變基礎上,通過DNA改組技術獲得Aureobasidium pullulans突變株F3-2,EPS產量較野生型菌株提高了168%,極大地提高了EPS產量。另外通過控制菌株生長的外部環境,可以在不同程度上提高真菌發酵EPS的產量,比如限制氮源種類和添加量,不僅可以減少投入成本,還可以極大促進EPS的合成[50]。
4 真菌EPS的功能研究
由表1可知,不同真菌所產EPS具有多樣性的結構類型,因其結構的獨特性,使得真菌EPS具有豐富的生物學功能和極其廣泛的工業應用價值[51]。
4.1抗腫瘤及免疫調節活性
活性真菌多糖通常被描述為生物反應調節劑,主要是基于它們能夠觸發免疫系統針對癌細胞的非特異性反應[21,52]。Ikekawa[53]通過小鼠喂養真姬菇實驗發現,實驗組小鼠患癌比例(3/36)遠小于對照組(21/36),并認為抑制腫瘤的機制由于免疫增強作用所致,Wasser[54]也認同這一觀點,認為食用一些大型真菌可以預防腫瘤的發生和轉移。事實上,對于癌癥的預防和治療,從臨床實踐中發現,大型真菌EPS與化學療法、外科手術結合起來被認為是非常有效的方法。在動物模型和人類臨床實踐中,香菇多糖的研究最為透徹,在化學療法治療之前,通過給患癌病人注射香菇多糖,可以很好地改善治療效果[54]。最新研究發現,翅鱗傘菌株(Pholiota squarrosa Quel.)AS5.245 水溶性胞外多糖(water-soluble exopolysaccharide,PEPS)-1對植入小鼠Heps肝癌細胞具有抗腫瘤活性,并猜測這種特性很可能是PEPS-1通過刺激宿主的免疫應答反應實現,但是PEPS-1的結構與功能的關系以及分子作用機制還需進一步研究[11]。除此之外,Aureobasidium pullulans所產的普魯蘭多糖及其各種衍生物也成為研究人員用于治療肝、肺、腦、脾等相關腫瘤疾病治療的潛在藥物[55-56]。比如Li Huanan等[57]通過合成普魯蘭多糖衍生物(普魯蘭多糖-多柔比星結合物),研究該物質對人肝癌細胞的影響,并認為該結合物有望成為靶向藥物載體安全用于給藥體系。
4.2抗炎癥及抗菌作用
大型真菌所產的一些多糖,其治療效果已得公認,比如鳳尾菇EPS具有鎮痛和抗炎作用[13]。Smiderle等[58]從Pleurotus pulmonarius中分離出一種3-O-甲基-半乳甘露聚糖,發現該多糖對醋酸誘發小鼠扭體反應具有鎮痛作用,盡管與吲哚美辛鎮痛作用相似,但地塞米松和吲哚美辛在一定程度上抑制炎癥應答反應,而3-O-甲基-半乳甘露聚糖則不存在這種現象,不過由3-O-甲基-半乳甘露聚糖引起的鎮痛作用機制仍然不清楚。Silveira等[13]首次報道了來源于Pleurotus sajor-caju的甲基化EPS可以減輕角叉菜所致小鼠足腫脹,表明這種EPS很可能成為一種有效的鎮痛和抗炎癥藥劑。此外,研究發現真菌EPS具有抗細菌和抗病毒作用[52,59-60],比如香菇EPS輔助治療抗藥性的肺結核,可以提高中性粒細胞對結核菌的吞噬作用,而葡聚糖和靈芝多糖分別對風疹病毒和乙型肝炎病毒具有一定的抗性。
4.3抗氧化活性
天然抗氧化劑因在疾病預防與治療、延緩衰老過程中發揮重要作用而廣為人知,在這些天然抗氧化劑中,多糖通常被認為是抗氧化性最強的一種[61]。有研究表明真菌EPS具有抗氧化功能,可以清除自由基,比如金針菇EPS[12]、血紅密孔菌EPS[62]和被毛孢屬真菌EPS[14]。多糖的抗氧化活性主要取決其結構特征,包括分子質量大小、單糖組成及糖苷鍵連接方式等,這往往是多種因素共同作用的結果[63]。即使對于同一來源的真菌EPS,分離得到不同分子質量及單糖組成的EPS,其抗氧化性也有一定的差別。Zheng Jianqiang等[61]純化了來源于Boletus aereus的EPS,獲得3 種EPS,分別命名為Fr-I、Fr-II和Fr-III,通過體外抗氧化活性實驗,發現Fr-I是其中抗氧化活性最高的EPS。
4.4益生功能
開發促進腸道有益菌群增殖,抑制有害微生物生長的益生元備受研究人員青睞,目前已經上市的各種功能性低聚糖種類繁多,包括低聚木糖、低聚半乳糖、低聚果糖等[64-65],該類益生元因進入末端結腸保留時間因素限制其應有功效[66-67]。而研究發現真菌EPS在人腸道不易被消化分解,具有防止細胞脫水、吞噬、減少血液中葡萄糖釋放速率和膽固醇的積累[23,52]。另外,還有研究表明來源于釀酒酵母的可溶性和不可溶性葡聚糖具有顯著降血脂的功效[52]。
5 結 語
開發能夠應用于工業上的新型EPS,歷來會引起科研人員的興趣,隨著真菌EPS研究的深入以及EPS高通量篩選平臺的建立[2,68],勢必會有更多新型的EPS被發現,其相應的生理學功能也將會被闡述。盡管近年來真菌EPS研究取得了豐碩的成果,但是有關真菌EPS生物合成途徑和相關酶的基因調控和表達研究還相對較少,而這對于提高EPS產量研究具有很強的理論指導意義。另外EPS工業規模化生產過程中,如果菌株所利用的碳源單一,勢必會增加EPS的生產成本、缺乏市場競爭力,進一步開發利用工農業廢棄物,如漁業殼多糖水解物、甘蔗糖蜜等有可能提高真菌發酵EPS水平。本課題組已著手此方面研究,以期獲得這方面特性的菌株以及具有特殊生物學活性的EPS。
參考文獻:
[1]ZHAO W,LIU W L,LI J J,et al.Preparation of animal polysaccharides nanofibers by electrospinning and their potential biomedical applications[J].Journal of Biomedical Materials Research Part A,2015,103(2):807-818.DOI:10.1002/jbm.a.35187.
[2]RüHMANN B,SCHMID J,SIEBER V.High throughput exopolysaccharide screening platform:from strain cultivation to monosaccharide composition and carbohydrate fingerprinting in one day[J].Carbohydrate Polymers,2015,122:212-220.DOI:10.1016/j.carbpol.2014.12.021.
[3]PATIL S P,SHIRSATH L P.Production of exopolysaccharide by an osmotolerant,thermostable and metal resistant Bacillus subtilis[J].International Journal of Current Microbiology and Applied Science,2015,4(2):965-971.
[4]FINORE I,di DONATO P,MASTASCUSA V,et al.Fermentation technologies for the optimization of marine microbial exopolysaccharide production[J].Marine Drugs,2014,12(5):3005-3024.DOI:10.3390/md12053005.
[5]RYAN P M,ROSS R P,FITZGERALD G F,et al.Sugar-coated:exopolysaccharide producing lactic acid bacteria for food and human health applications[J].Food Function,2015,6(3):679-693.DOI:10.1039/c4fo00529e.
[6]ISLAM S T,LAM J S.Synthesis of bacterial polysaccharides via the Wzx/Wzy-dependent pathway[J].Canadian Journal of Microbiology,2014,60(11):697-716.DOI:10.1139/cjm-2014-0595.
[7]RUAS-MADIEDO P,de LOS REYES-GAVIL?N C.Invited review:methods for the screening,isolation,and characterization of exopolysaccharides produced by lactic acid bacteria[J].Journal of Dairy Science,2005,88(3):843-856.DOI:10.3168/jds.S0022-0302(05)72750-8.
[8]MAHAPATRA S,BANERJEE D.Fungal exopolysaccharide:production,composition and applications[J].Microbiology Insights,2013,6(1):1-16.DOI:10.4137/MBI.S10957.
[9]CHEN Y L,MAO W J,TAO H W,et al.Preparation and characterization of a novel extracellular polysaccharide with antioxidant activity,from the mangrove-associated fungus Fusarium oxysporum[J].Marine Biotechnology,2015,17(2):219-228.DOI:10.1007/s10126-015-9611-6.
[10]MUKHOPADHYAY S K,CHATTERJEE S,GAURI S S,et al.Isolation and characterization of extracellular polysaccharide Thelebolan produced by anewly isolated psychrophilic antarctic fungus Thelebolus[J].Carbohydrate Polymers,2014,104:204-212.DOI:10.1016/j.carbpol.2014.01.034.
[11]ZHAO H Z,WANG J,LüF X,et al.Chemical characterization and antitumor activity of an exopolysaccharidefrom Pholiota squarrosa Quel.AS 5.245[J].Food Science and Biotechnology,2015,24(2):659-664.DOI:10.1007/s10068-015-0086-z.
[12]MA Z,CUI F Y,GAO X,et al.Purification,characterization,antioxidant activity and anti-aging of exopolysaccharides by Flammulina vel utipes SF-06[J].Antonie Van Leeuwenhoek,2015,107(1):73-82.DOI:10.1007/s10482-014-0305-2.
[13]SILVEIRA M L,SMIDERLE F R,AGOSTINI F,et al.Exopolysaccharide produced by Pleurotus sajor-caju:its chemical structure an d anti-inflammatory activity[J].International Journal of Biological Macromolecules,2015,75(4):90-96.DOI:10.1016/j.ijbiomac.2015.01.023.
[14]MENG L,SUN S S,LI R,et al.Antioxidant activity of polysacchari des produced by Hirsutella sp.and relation with their chemical characteristics[J].Carbohydrate Polymers,2015,117:452-457.DOI:10.1016/j.carbpol.2014.09.076.
[15]CHEN X,SIU K C,CHEUNG Y C,et al.Structureand properties of a(1-->3)-beta-D-glucan from ultrasound-degraded exopolysaccharides of a medicinal fungus[J].Carbohydrate Polymers,2014,106:270-275.DOI:10.1016/j.carbpol.2014.02.0 40.
[16]OSINSKA-JAROSZUK M,JASZEK M,MIZERSKA DUDKA M,et al.Exopolysaccharide from Ganoderma applanatum as a promising bioactive compound with cytostatic and antibacterial properties[J].BioMed Research International,2014,2014:1-10.DOI:10.1155/2014/743812.
[ 17]MISHRA B,SUNEETHA V.Biosynthesis and hyper production of pullulan by a newly isolated strain of Aspergillus japonicus-VITSB1[J].World Journal of Microbiologyand Biotechnology,2014,30(7):2045-2052.DOI:10.1007/s11274-014-1629-9.
[18]GUO S D,MAO W J,YAN M X,et al.Galactomannan with novel structure produced by the coral endophytic fungus Aspergillus ochraceus[J].Carbohydrate Polymers,2014,105:325-333.DOI:10.1016/j.c arbpol.2014.01.079.
[19]MA X K,ZHANG H,PETERSON E C,et al.Enhancing exopolysaccharide antioxidant formation and yield from Phellinus species through medium optimization studies[J].Carbohydrate Polymers,2014,107:214-220.DOI:10.1016/j.carbpol.2014.02.077.
[20]LILLO L,CAB ELLO G,CéSPEDES C L,et al.Structural studies of the exopolysaccharide produced by a submerged culture of entomopathogenic fungus Metarhizium anisopliae[J].Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas,2014,1 3(4):359-365.
[21]SU C A,XU X Y,LIU D Y,et al.Isolation and characterization of exopolysaccharide with immunomodulatory activity from fermentation broth of Morchella conica[J].Daru Journal of Pharmaceutical Sciences,2013,21(1):1-6.DOI:10.1186/2008-2231-21-5.
[22]ZHAI X H,ZHAO A J,GENG L J,et al.Fermentation characteristics and hypoglycemic activity of an exopolysaccharide produced by submerged culture of Stropharia rugosoannulata #2[J].Annals of Microbiology,2013,63(3):1013-1020.DOI:10.1007/s13213-012-0555-z.
[23]PRATHUMPAI W,RACHATHEWEE P,KHAJEERAM S,et al.Optimization,characterization and in vitro evaluation of entomopathogenic fungal exopolysaccharides as prebiotic[J].Advances in Biochemistry,201 3,1(2):13-21.
[24]ZHU H,TIAN B Z,LIU W,et al.A three-stage culture process for improved exopolysaccharide production by Tremella fuciformis[J].Bioresource Technology,2012,116:526-528.DOI:10.1016/j.biortech.2012.03.117.
[25]WUS J,CHEN J,PAN S K.Optimization of fermentation conditions for the production of pullulan by a new strain of Aureobasidium pullulans isolated from sea mud and its characterization[J].Carbohydrate Polymers,2012,87(2):1696-1700.DOI:10.1016/j.carbpol.2011.0 9.078.
[26]MAHAPATRA S,BANERJEE D.Structural elucidation and bioactivity of a novel exopolysaccharide from endophytic Fusarium solani SD5[J].Carbohydrate Polymers,2012,90(1):683-689.DOI:10.1016/j.carbpol.2012.05.097.
[27]HE P X,GE NG L J,MAO D B,et al.Production,characterization and antioxidant activity of exopolysaccharides from submerged culture of Morchella crassipes[J].Bioprocess and Biosystems Engineering,2012,35(8):1325-1332.DOI:10.1007/s00449-012-0720-6.
[28]GAO C J,WANG Z Y,SU T T,et al.Optimisation of exopolysaccharide production by Gomphidius rutilus and its antioxidant activities in vitro[J].Carbohydrate Polymers,2012,87(3):2299-2305.DOI:10.1016/j.carbpol.2011.10.064.
[29]MARIBEL C M,HUMBERTO H S,GUSTAVO F G L,et al.Production and partial characterization of an exopolysaccharide from Ustilago maydis in submerged culture[J].African Journal of Biotechnology,2012,11(27):7079-7087.DOI:10.5897/AJB11.4047.
[30]ZHANG B B,CHEUNG P C.Use of stimulatory agents to enhance the production of bioactive exopolysaccharide from Pleurotus tuberregium by submerged fermentation[J].Journal of Agricultural and Food Chemistry,2011,59(4):1210-1216.DOI:10.1021/jf104425w.
[31]YE M,QIU T,PENG W,et al.Purification,characterization and hypoglycemic activity of extracellular polysaccharides from Lachnum calyculiforme[J].Carbohydrate Polymers,2011,86(1):285-290.DOI:10.1016/j.carbpol.2011.04.051.
[32]LIANG T W,WANG S L.Recent advancesin exopolysaccharides from Paenibacillus spp.:production,isolation,structure,and bioactivities[J].Marine Drugs,2015,13(4):1847-1863.DOI:10.3390/md13041847.
[33]FENG Y L,LI W Q,WU X Q,et al.Statistical op timization of media for mycelial growth and exo-polysaccharide production by Lentinus edodes and a kinetic model study of two growth morphologies[J].Biochemical Engineering Journal,2010,49(1):104-112.DOI:10.1016/j.bej.2009.12.002.
[34]HUANG H C,LIU Y C.Enhancement of polysaccharide production by optimization of culture conditions in shake flask submerged cultivation of Grifola umbellata[J].Journal of the Chinese Institute of Chemical Engineers,2008,39(4):307-311.DOI:10.1016/j.jcice.2008.01.003.
[35]SHARMA N,PRASAD G S,CHOUDHURY A R.Utilization of corn steep liquor for biosynthesis of pullulan,an important exopolysaccharide[J].Carbohydrate Polymers,2013,93(1):95-101.DOI:10.1016/j.c arbpol.2012.06.059.
[36]SHENG L,ZHU G L,TONG Q Y.Effect of uracil on pullulan production by Aureobasidium pullulans CGMCC1234[J].Carbohydrate Polymers,2014,101(30):435-437.DOI:10.1016/j.carbpol.2013.09.063.
[37]SHENG L,ZHU G L,TONG Q Y.Mechanismstudy of Tween 80 enhancing the pullulan production by Aureobasidium pullulans[J].Carbohydrate Polymers,2013,97(1):121-123.DOI:10.1016/j.carbpol.2013.04.058.
[38]ZHANG B B,CHEN L,CHEUNG P C.Proteomic insights into the stim ulatory effect of Tween 80 on mycelial growth and exopolysaccharide production of an edible mushroom Pleurotus tuber-regium[J].Biotechnology Letters,2012,34(10):1863-1867.DOI:10.1007/s10529-012-0975-7.
[39]TU G W,WANG Y K,JI Y C,et al.Th e effect of Tween 80 on the polymalic acid and pullulan production by Aureobasidium pullulans CCTCC M2012223[J].World Journal of Microbiology and Biotechnology,2015,31(1):219-226.DOI:10.1007/s11274-014-1779-9.
[40]LIU J,LUO J G,YE H,et al.Production,characterization and antioxidant activities in vitro of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3[J].Carbohydrate Polymers,2009,78(2):275-281.DOI:10.1016/j.carbpol.2009.03.046.
[41]SHARMA S K,GA UTAM N,ATRI N S.Optimization,composition,and antioxidant activities of exo- and intracellular polysaccharides in submerged culture of Cordyceps gracilis(Grev.)Durieu & Mont[J].Evidence-Based Complement ary and Alternative Medicine,2015,2015:1-8.DOI:10.1155/2015/462864.
[42]SEO C,LEE H W,SURESH A,et al.Improvement of fermentative production of exopolysaccharides from Aureobasidium pullulans under various conditions[J].Korean Journal of Chemical Engineering,2014,31(8):1433-1 437.DOI:10.1007/s11814-014-0064-9.
[43]MA Z C,FU W J,LIU G L,et al.High-level pullulan production by Aureobasidium pullulans var.melanogenium P16 isolated from mangrove system[J].Applied Microbiology and Biotechnology,2014,98(11):4865-4873.DOI:10.1007/s00253-014-55 54-5.
[44]MAHAPATRA S,BANERJEE D.Optimization of a bioactive exopolysaccharide production from endophytic Fusarium solani SD5[J].Carbohydrate Polymers,2013,97(2):627-634.DOI:10.1016/j.carbpol.2013.05.039.
[45]GUO S D,MAO W J,LI Y L,et al.Structural elucidation of the exopolysaccharide produced by fungus Fusarium oxysporum Y24-2[J].Carbohydrate Research,2013,365:9-13.DOI:10.1016/j.carres.2012.09.026.
[46]POKHREL C,OHGA S.Submerged culture cond itions for mycelial yield and polysaccharides production by Lyophyllum decastes[J].Food Chemistry,2007,105(2):641-646.DOI:10.1016/j.foodchem.2007.04.033.
[47]RUPEREZ P,LEAL J A.Extracellular galactosaminogalactan from Aspergillus parasiticus[J].Transactions of the British Mycological Society,1981,77(3):621-625.DOI:10.1016/S0007-1536(81)80111-8.
[48]LIU B,SUN Z,MA X N,et al.Mutation breeding of extracellular polysaccharide-producing microalga Crypthecodinium cohnii by a novel mutagenesis with atmospheric and room temperature plasma[J].International Journal of Molecular Sciences,2015,16(4):8201-8212.DOI:10.3390/ijms16048201.
[49]KANG J X,CHEN X J,CHENW R,et al.Enhanced production of pullulan in Aureobasidium pullulans by a new process of genome shuffling[J].Process Biochemistry,2011,46(3):792-795.DOI:10.1016/j.procbio.2010.11.004.
[50]WANG D H,CHEN F F,WEI G Y,et al.The mechanism of improved p ullulan production by nitrogen limitation in batch culture of Aureobasidium pullulans[J].Carbohydrate Polymers,2015,127(8):325-331.DOI:10.1016/j.carbpol.2015.03.079.
[51]SINGH R S,SAINI G K.Pullulan-hyperproducing color variant strain of Aureobasidium pullulans FB-1 newly isolated from phyl loplane of Ficus sp.[J].Bioresource Technology,2008,99(9):3896-3899.DOI:10.1016/j.biortech.2007.08.003.
[52]GIAVASIS I.Bioactive fungal polysaccharides as potential functional ingredients in food and nutraceuticals[J].Current Opinion in Biotech nology,2014,26:162-173.DOI:10.1016/j.copbio.2014.01.010.
[53]IKEKAWA T.Beneficial effects of edible and medicinal mushrooms on health care[J].International Journal of Medicinal Mushrooms,2001,3(4):1-8.DOI:10.1615/IntJMedMushr.v3.i4.20.
[54]WASSER S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Applied Microbiology and Biotechnology,2002,60(3):258-274.DOI:10.1007/s00253-002-1076-7.
[55]SINGHR S,KAUR N,KENNEDY J F.Pullulan and pullulan derivatives as promising biomolecules for drug and gene targeting[J].Carbohydrate Polymers,2015,123(6):190-207.DOI:10.1016/j.carbpol.2015.01.032.
[56]SC OMPARIN A,SALMASO S,BERSANI S,et al.Novel folated and non-folated pullulan bioconjugates for anticancer drug delivery[J].European Journal of Pharmaceutical Sciences,2011,42(5):547-558.DOI:10.1016/j.ejps.2011.02.012.
[57]LI H N,BIAN S Q,HUANG Y H,et al.High drug loading pH-sensitive pullulan-DOX conjugate nanoparticles for hepatic targeting[J].Journal of Biomedical Materials Research Part A,2014,102(1):150-159.DOI:10.1002/jbm.a.34680.
[58]SMIDERLE F R,OLSEN L M,CARBONERO E R,et al.A 3-O-methylated mannogalactan from Pleurotus pulmonarius:structure and antinociceptive effect[J].Phytochemistry,2008,69(15):2731-2736.DOI:10.1016/j.phytochem.2008.08.006.
[59]EO S K,K IM Y S,LEE C K,et al.Possible mode of antiviral activity of acidic protein bound polysaccharide isolated from Ganoderma lucidum on herpes simplex viruses[J].Journal of Ethnopharmacology,2000,72(3):475-481.DOI:10.10 16/S0378-8741(00)00266-X.
[60]MASTROMARINO P,PETRUZZIELLO R,MACCHIA S R,et al.Antiviral activity of natural and semisynthetic polysaccharides on the early steps of rubella virus infection[J].Journal of Antimicrobial Chemotherapy,199 7,39(3):339-345.DOI:10.1093/jac/39.3.339.
[61]ZHENG J Q,WANG J Z,SHI C W,et al.Characterization and antioxidant activity for exopolysaccharide from submerged culture of Boletus aereus[J].Process Biochemistry,2014,49(6):1047-1 053.DOI:10.1016/j.procbio.2014.03.009.
[62]CAO J,ZHANG H J,XU C P.Culture characterization of exopolysaccharides with antioxidant activity produced by Pycnoporus sanguineus in stirred-tank and airlif t reactors[J].Journal of the Taiwan Institute of Chemical Engineers,2014,45(5):2075-2080.DOI:10.1016/j.jtice.2014.05.005.
[63]HE P X,GENG L J,WANG J Z,et al.Purification,chara cterization and bioactivity of an extracellular polysaccharide produced from Phellinus igniarius[J].Annals of Microbiology,2012,62(4):1697-1707.DOI:10.1007/s13213-012-0427-6.
[64]FALONY G,V ERSCHAEREN A,de BRUYCKER F,et al.In vitro kinetics of prebiotic inulin-type fructan fermentation by butyrate-producing colon bacteria:implementation of online gas chromatography for quantitative analysis ofcarbon dioxide and hydrogen gas production[J].Applied and Environmental Microbiology,2009,75(18):5884-5892.DOI:10.1128/AEM.00876-09.
[65]HERNOT D C,BOILEAU T W,BAUER L L,et al.In vitro fermentation profiles,gas productionrates,and microbiota modulation as affected by certain fructans,galactooligosaccharides,and polydextrose[J].Journal of Agricultural and Food Chemistry,2009,57(4):1354-1361.DOI:10.1021/jf802484j.
[66]DOUGLAS L C,SANDERS ME.Probiotics and prebiotics in dietetics practice[J].Journal of the American Dietetic Association,2008,108(3):510-521.DOI:10.1016/j.jada.2007.12.009.
[67]SAULNIER D M,SPINLER J K,GIBSON G R,et al.Mechanisms of probiosisand prebiosis:considerations for enhanced functional foods[J].Current Opinion in Biotechnology,2009,20(2):135-141.DOI:10.1016/j.copbio.2009.01.002.
[68]SEVIOUR R J,MCNEIL B,FAZENDA M L,et al.Operating bioreactors for microbial exopolysaccharide produ ction[J].Critical Reviews in Biotechnology,2011,31(2):170-185.DOI:10.3109/07388 551.2010.505909.
Recent Advances in Fungal Exopolysaccharide Fermentation
YANG Tongxiang1,WU Kongyang2,CHEN Junliang1,TANG Haoguo1,KANG Huaibin1
(1.College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471023,China; 2.College of Life Science,Luoyang Normal University,Luoyang 471022,China)
Abstract:Fungal exopolysaccharide possesses high viscosity,and antioxidant,antiviral and antitumor activity,which is widely used in the food and pharmaceutical industries.In this review,we summarizes the latest progress made in China and abroad in studying exopolysaccharide-producing strains,factors influencing the production of fungal exopolysaccharide,breeding strategies for exopolysaccharide production and the function of fungal exopolysaccharide,aiming to provide some references for further investigation and application of fungal exopolysaccharide.
Key words:fungal exopolysaccharide; production; fermentation; function
中圖分類號:Q939.9
文獻標志碼:A
文章編號:1002-6630(2016)05-0265-06
DOI:10.7506/spkx1002-6630-201605046
作者簡介:楊同香(1983—),女,講師,博士,研究方向為乳品科學與工程。E-mail:txyamy@163.com
基金項目:河南省高等學校重點科研基金項目(15A180050);河南科技大學博士科研啟動基金項目(13480043);河南科技大學青年科學基金項目(2015QN038)
收稿日期:2015-06-12

