銨鹽對紫色紅曲霉合成代謝紅曲色素及桔霉素的影響
岳建明,楊 強,肖 瀟,尹 勝,張 嬋,王成濤,*,胡濟美,趙吉興(.北京工商大學 北京市食品添加劑工程技術研究中心,食品營養與人類健康北京高精尖創新中心,北京 00048;.中國國際工程咨詢公司,北京 00048;.山東中惠生物科技股份有限公司,山東 濱州 5706)
?
銨鹽對紫色紅曲霉合成代謝紅曲色素及桔霉素的影響
岳建明1,楊 強1,肖 瀟1,尹 勝1,張 嬋1,王成濤1,*,胡濟美2,趙吉興3
(1.北京工商大學 北京市食品添加劑工程技術研究中心,食品營養與人類健康北京高精尖創新中心,北京 100048;2.中國國際工程咨詢公司,北京 100048;3.山東中惠生物科技股份有限公司,山東 濱州 251706)
摘 要:研究紫色紅曲霉(Monascus purpureus)Y20液態發酵過程中不同銨鹽對目的產物紅曲色素及有害物質桔霉素的合成代謝的影響。在發酵培養基中添加不同銨鹽,檢測M.purp ureus Y20發酵液中紅曲紅色素、紅曲黃色素及桔霉素含量,分析其變化及原因。結果表明:M.purpureus Y20發酵過程中發酵液pH值相對較穩定,未添加銨鹽的對照組發酵液基本維持在pH 4.8;添加CH3COONH4、NH4H2PO4、C6H5O7(NH4)3的發酵液pH>6;添加NH4NO3、(NH4)2SO4、NH4Cl的發酵液初始pH<5.5,發酵過程中持續降低至pH 2.5左右;含有0.3 mol/L NH4+的(NH4)2SO4的發酵液中桔霉素含量降為0.05 mg/L,較對照組降低88.6%;含有0.1~0.3 mol/L NH4+的NH4Cl發酵液中桔霉素含量降為0.05 mg/L;含有0.3 mol/L NH4+的NH4NO3發酵液未檢出桔霉素,紅曲黃色素含量較對照組升高31.0%、紅曲紅色素含量降低11.6%;添加CH3COONH4、NH4H2PO4、C6H5O7(NH4)3的發酵液無桔霉素檢出,但菌體干質量較小,色價較低。因此,添加銨鹽可影響發酵液pH值,影響M.purpureus Y20對營養物質吸收和代謝,改變紅曲色素的組成比例和抑制桔霉素的生成;添加適量(NH4)2SO4、NH4Cl、NH4NO3有利于促進紅曲黃色素的生物合成,阻礙桔霉素的生成。
關鍵詞:紫色紅曲霉;紅曲紅色素;紅曲黃色素;桔霉素;銨鹽
引文格式:
岳建明,楊強,肖瀟,等.銨鹽對紫色紅曲霉合成代謝紅曲色素及桔霉素的影響[J].食品科學,2016,37(5):102-107.
YUE Jianming,YANG Qiang,XIAO Xiao,et al.Effect of addition of ammonium salts to culture medium on the biosynthesis and metabolism of pigments and citrinin in Monascus purpureus[J].Food Science,2016,37(5):102-107.(in Chinesewith English abstract)DOI:10.7506/spkx1002-6630-201605019.http://www.spkx.net.cn
紅曲在中國已有300a以上的食用歷史。紅曲色素作為重要食品著色劑已被亞洲及歐美各國廣泛使用[1-2],也是我國傳統出口產品。隨著紅曲產品的推廣,人們對紅曲的研究也不斷深入,紅曲產品中一些有害物質,逐漸引起人們的關注。1995年,Blanc等[3]用質譜、核磁共振、紫外及熒光分析等多種方法對紅曲產品中的抑菌因子Monascidin A進行定性分析和結構測定,證明Monascidin A是桔霉素(citrinin)。研究證實,桔霉素是一種真菌毒素,作用的主要靶器官是腎臟,能引起實驗動物的腎臟腫大、尿量增多、腎小管擴張和上皮細胞變性壞死等癥狀,對人體有較大危害[4-6]。我國國家標準(GB/T 5009.222—2008《紅曲類產品中桔青霉素的測定》)建立了桔霉素檢測方法,但并未對桔霉素控制指標做出限定。歐美各國針對我國出口的紅曲產品制定新標準,嚴格限制其中的桔霉素含量。如德國要求從中國進口的紅曲必須有安全生產菌種及不含桔霉素的證明[7]。因此如何降低紅曲產品中桔霉素的含量,已經成為紅曲色素研究領域的重點和限制出口的瓶頸問題,亟待解決。
紅曲色素是紅曲霉的次級代謝產物,主要包括紅曲紅色素、紅曲黃色素2 種色素,從結構上看包括脂肪酸和多聚酮2個部分,通過多聚酮合成途徑,產生生色團;脂肪酸合成途徑產生中長鏈脂肪酸,經轉酯化作用將其連接到生色團上[8-9]。紅曲色素和桔霉素合成的關鍵酶同為聚酮體合成酶(polyketide synthetases,PKSs),因此兩者的生成量成一定的正相關[10]。目前國內外對紅曲色素合成代謝有一些報道,從紅曲色素合成關鍵酶、發酵工藝控制、誘變育種、基因工程等多個層面開展研究[11-13]。本實驗研究紫色紅曲霉的紅曲色素合成代謝途徑及其調控機制,發現銨鹽對紫色紅曲霉發酵過程中有害物質桔霉素的生成、紅曲色素的合成代謝有調控作用。研究結果對于紅曲色素代謝調控具有一定指導意義,有利于我國傳統紅曲產業的發展。
1 材料與方法
1.1菌株與試劑
紫色紅曲霉(Monascus purpureus)Y20,由食品質量與安全北京實驗室選育。
大米粉成都半夏科技有限公司;葡萄糖、KH2PO4、MgSO4、NaNO3(均為分析純) 國藥集團化學試劑有限公司;蛋白胨、瓊脂、酵母提取物 北京奧博星生物技術有限責任公司;豆粕粉、玉米漿、麥芽浸粉 天津市利發隆化工科技有限公司;甲醇、乙腈(色譜純) 賽默飛世爾科技(北京)有限公司;桔霉素標品(純度≥98%) 美國Sigma公司;NH4NO3、(NH4)2SO4、NH4Cl、CH3COONH4、NH4H2PO4、C6H5O7(NH4)3(均為分析純) 西隴化工股份有限公司。
1.2 儀器與設備
HDL潔凈工作臺 北京東聯哈爾儀器制造有限公司;BSA224S電子天平 賽多利斯科學儀器(北京)有限公司;HZQ-F160全溫振蕩培養箱 太倉市試驗設備廠;TGL-10C高速臺式離心機 上海安亭科學儀器廠;PHS-3D 型pH計 上海三信儀表廠;UV-2450紫外-可見分光光度計、LC-20AT高效液相色譜 日本島津公司;HH-4恒溫水浴鍋 江蘇省榮華儀器制造有限公司。
1.3方法
1.3.1培養基的制備和紫色紅曲霉的培養
斜面培養基:葡萄糖2%、蛋白胨0.3%、酵母提取物0.4%、麥芽浸粉2%、瓊脂2%、KH2PO40.2%、NaNO30.2%、MgSO40.1%,121 ℃滅菌20 min。
種子培養基:大米粉4%、蛋白胨0.8%、豆粕粉0.5%、KH2PO40.2%、NaNO30.2%、MgSO40.1%,接種搖瓶培養,裝液量為50 mL/250 mL三角瓶,121 ℃滅菌20 min。
發酵培養基:大米粉7.7%、葡萄糖7.5%、豆粕粉0.2%、KH2PO40.05%、NaNO30.18%、MgSO40.1%、玉米漿0.35%,裝液量為200 mL/500 mL,121 ℃滅菌20 min。NH4NO3、(NH4)2SO4、NH4Cl、CH3COONH4、NH4H2PO4、C6H5O7(NH4)3分別按照NH4+濃度0.1、0.2、0.3、0.4 mol/L添加。
試管斜面刮取適量新鮮菌絲體,30 ℃、200 r/min搖瓶培養2 d;將種子液按體積分數10%接種到發酵培養基,33 ℃、200 r/min搖瓶培養8 d[14]。
1.3.2色價的測定
量取1 mL發酵液加入9 mL 70%的乙醇溶液,恒溫水浴鍋60 ℃浸提1 h,4 000 r/min離心10 min,取上清液稀釋至2 000倍,紫外分光光度計測定410、505 nm波長處的吸光度。410 nm波長處測定為紅曲黃色素含量,510 nm波長處測定紅曲紅色素含量[15-16]。實驗組發酵液中分別添加NH4NO3、(NH4)2SO4、NH4Cl、CH3COONH4、NH4H2PO4、C6H5O7(NH4)3至NH4+濃度為0.1~0.4 mol/L,探究銨鹽對紅曲色素合成代謝的影響。
紅曲色素的色價/U=吸光度×稀釋倍數
1.3.3生物量的測定
將烘干的3層紗布稱質量,將10 mL發酵液通過紗布過濾,蒸餾水沖洗至洗出液無色,將紗布置于烘箱中過夜烘干至恒質量,精密電子天平稱量得菌體干質量,以單位體積發酵液中的菌體干質量計算生物量[17-18]。
1.3.4桔霉素含量的測定
取1 mL發酵液加入9 mL無水乙醇,210 W,40 Hz超聲處理20 min后,恒溫水浴鍋60 ℃浸提1 h。將發酵液4 000 r/min離心10 min,取上清液0.45 ?m有機濾膜過濾。
液相色譜條件:YMC-Triart C18色譜柱(250 mm×4.6mm,5?m);熒光檢測器的激發波長為λex=331 nm,發射波長λem=500nm;V(乙腈)∶V(水)=35∶65作為流動相,磷酸調節pH2.5;柱溫28℃;流速1.2mL/min;進樣量20?L。
精確稱取桔霉素標準品0.001 g,50 mL容量瓶中甲醇定容配制20 mg/L標準溶液,分別稀釋為0.05、0.2、2、4、8、12 mg/L標準溶液,高效液相色譜(high performance liquid chromatography,HPLC)檢測繪制桔霉素標準曲線[19-20]。根據桔霉素標準品質量濃度和峰面積求回歸方程和相關系數,其標準曲線方程為:Y=36 537X+7 247(R2=0.9997),式中:X為桔霉素質量濃度/(mg/L);Y為峰面積。表明桔霉素在0.05~12 mg/L范圍內線性關系良好。向發酵液中添加桔霉素標樣溶液至2 mg/L,5 次測定桔霉素質量濃度為(1.932±0.011)mg/L,變異系數為0.57%,平均回收率為96.6%,說明該方法準確性、精密度良好。
2 結果與分析
2.1M.purpureus Y20的酸堿耐受性
用乳酸調節培養基不同的起始pH值,其余條件與液體發酵培養基相同。測得第8天M.purpureus Y20發酵液pH值與發酵液的菌體生物量關系如圖1所示。

圖1 不同pH值發酵條件下M.purpurreeuuss Y20 的生物量Fig.1 Biomass of M.purpureus Y20 under different pH conditions
由圖1可知,M.purpureus Y20的最適pH值在4.5左右。當pH>6.5和pH<2.5時,紅曲霉菌體的生長均受到較大程度抑制。
2.2不同銨鹽對M.purpureus Y20發酵液pH值的影響

圖2 不同銨鹽對M.purpurreeuuss Y20發酵過程中pH值的影響Fig.2 Effect of ammonium salts on pH during M.purpureus Y20 fermentation
由圖2(圖示僅給出效果明顯的2 種NH4+濃度:0.1 mol/L和0.3 mol/L)可知,未添加銨鹽的對照組發酵液pH值在發酵前期稍有下降,發酵中后期基本維持在4.8左右,這表明紫色紅曲霉發酵過程中發酵液pH值相對穩定;添加CH3COONH4、NH4H2PO4、C6H5O7(NH4)3的實驗組發酵液初始pH>7,發酵過程中維持pH>6,是因為這3 種銨鹽的陰離子同為弱酸根離子,在水溶液中電離溶液成弱堿性;添加NH4NO3、(NH4)2SO4、NH4Cl實驗組發酵液初始pH<5.5,是因為這3 種銨鹽的陰離子同為強酸根離子,NH4+在水溶液中電離成弱酸性。添加銨鹽的實驗組的pH值在發酵過程中均持續下降,這可能是因為NH4+作為氮源被微生物利用時,NH4+被跨膜吸收,導致胞內H+跨膜交換外流[21],使發酵液pH值下降,且以添加(NH4)2SO4的發酵液pH值變化最為明顯。這表明發酵液pH值對微生物的營養物質吸收和代謝有重要調控作用,也可能影響某些關鍵代謝酶基因表達水平、代謝產物形成、分泌。
2.3 銨鹽對M.purpureus Y20生物量的影響

圖3 不同銨鹽及其濃度對M.purpurreeuuss Y20生物量的影響Fig.3 Effect of ammonium salt type and concentration on biomass of M.purpureus Y20
由圖3可知,相比于對照組,添加NH4NO3、(NH4)2SO4、NH4Cl的實驗組發酵后生物量均有所提高,且3個實驗組之間生物量差別不大,結合圖1、2分析,表明這3 種銨鹽提供的氮源和低pH值的環境有利于M.purpureus Y20的生長,Said等[22]在研究紅曲色素代謝調控時也得到相似結論。添加CH3COONH4、NH4H2PO4、C6H5O7(NH4)3的實驗組較對照組,生物量明顯偏少,結合圖1、2分析,表明較高pH值環境不利于紫色紅曲霉生長、代謝,導致菌體生物量偏低。
2.4銨鹽對紅曲色素合成代謝的影響
2.4.1銨鹽對紅曲黃色素合成代謝的影響
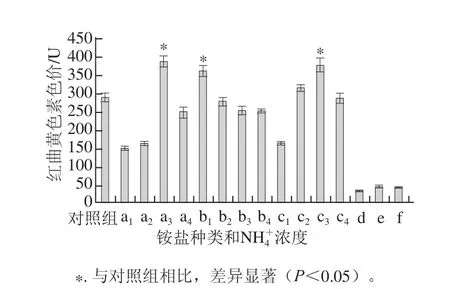
圖4 不同銨鹽及其濃度對紅曲黃色素合成代謝的影響Fig.4 Effect of ammonium salt type and concentration on yellow pigment biosynthesis
由圖4可知,分別含有0.3、0.1、0.3 mol/L NH4+的(NH4)2SO4、NH4Cl、NH4NO3發酵液較對照組相比,紅曲黃色素產量差異顯著(P<0.05),分別提高了33.1%、24.1%、31.0%,表明該濃度的這3 種銨鹽對紅曲黃色素生物合成有促進作用,可能是因為銨鹽作為氮源被菌體利用時,降低發酵液的pH值有利于紅曲黃色素的生物合成,Yongsmith等[23]也有相似結論。添加相同NH4+濃度的CH3COONH4、NH4H2PO4、C6H5O7(NH4)3發酵液紅曲黃色素色價均低于50 U,明顯低于對照組及其他3 種銨鹽量實驗組,結合圖2、3分析,較高pH值環境(發酵過程中維持pH>6)抑制M.purpureus Y20菌體生長,進而影響了紅曲黃色素的生物合成。
2.4.2銨鹽對紅曲紅色素合成代謝的影響

圖5 不同銨鹽及其濃度對紅曲紅色素合成代謝的影響Fig.5 Effect of ammonium salt type and concentration on red pigment biosynthesis
由圖5可知,含有0.1~0.4 mol/L NH4+的NH4NO3、(NH4)2SO4、NH4Cl、CH3COONH4、NH4H2PO4、C6H5O7(NH4)3實驗組的紅曲紅色素產量均較未添加銨鹽對照組有一定降低,表明銨鹽對M.purpureus Y20的紅曲紅色素生物合成存在一定抑制作用,其中含有0.3、0.1、0.3 mol/L NH4+的(NH4)2SO4、NH4Cl、NH4NO3發酵液紅曲色素產量分別降低了9.5%、8.5%和11.6%,可能是因為銨鹽作為氮源被菌體利用時,降低發酵液的pH值不利于紅曲紅色素的生物合成,Zhou Bo等[24]也有相似結論。添加相同NH4+濃度CH3COONH4、NH4H2PO4、C6H5O7(NH4)3的發酵液紅曲紅色素色價均低于50 U,明顯低于對照組的378 U,可能是較高pH值環境抑制M.purpureus Y20生長,也影響紅曲紅色素的生物合成。
2.5銨鹽對桔霉素合成代謝的影響
按照1.3.4節的檢測條件,對各實驗組發酵液中桔霉素含量進行HPLC分析。由圖6a可知,對照組桔霉素生成量隨著發酵時間延長逐漸增加,發酵第8天達到0.44 mg/L;含有0.1~0.4 mol/L NH4+的(NH4)2SO4發酵液,其桔霉素含量第4天或第5天達到峰值,之后逐漸下降;其中含有0.3 mol/L NH4+的(NH4)2SO4發酵液在第4天達到峰值0.17 mg/L,第8天時桔霉素質量濃度降為0.05 mg/L,該產量較對照組降低了88.6%,也明顯低于Zhou Bo等[24]報道的桔霉素質量濃度為0.81 mg/L。由圖6b可知,含有0.1~0.4 mol/L NH4+的NH4Cl實驗組桔霉素含量在第5天達到最大值,第8天檢測結果均不超過0.05 mg/L。由圖6c可知,含有0.1、0.2 mol/L NH4+的NH4NO3實驗組桔霉素也呈先升高后降低趨勢;含有0.3 mol/L NH4+的NH4NO3發酵液第5天后未檢出桔霉素,紅曲黃色素產量較對照組提高31.0%(圖4)。這可能是銨鹽作為氮源被消耗時,降低了發酵液pH值,使發酵體系處于pH<3的酸性環境中,影響相關代謝酶活性,抑制桔霉素生成代謝或加速其作為中間代謝產物的分解,Shi Kan等[25]也有相似結論。
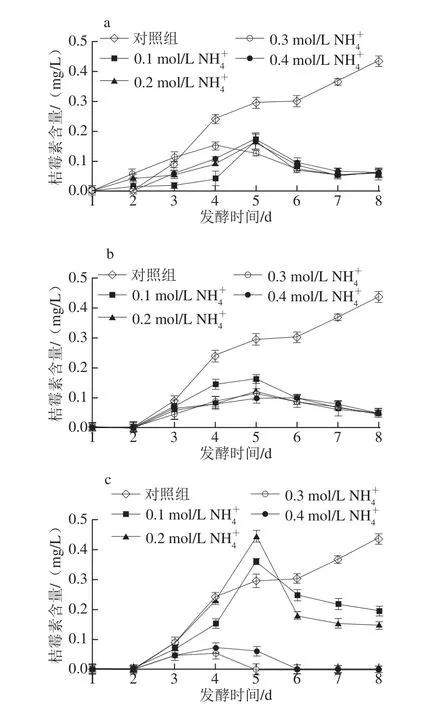
圖6 不同NNHH4+濃度的((NNHH4)2SSOO4(aa) 、NNHH4Cl(bb )、NNHH4NNOO3(cc)發酵液對桔霉素合成代謝的影響Fig.6 Effect of(NH4)2SO4(a),NH4Cl(b),NH4NO3(c)with different NH+4concentrations contained in culture medium on citrinin biosynthesis
含有NH4+0.1~0.4 mol/L的CH3COONH4、NH4H2PO4、C6H5O7(NH4)3發酵液連續8 d均無桔霉素檢出(未圖示),同時該條件下的生物量很小,原因可能是這3 種銨鹽維持發酵液的較高pH值環境,抑制M.purpureus Y20的生長,影響桔霉素代謝生成。
3 結 論
添加銨鹽改良M.purpureus Y20液態發酵培養基組分,研究銨鹽對紅曲色素、桔霉素合成代謝的影響。與未添加銨鹽對照組相比,添加NH4NO3、(NH4)2SO4、NH4Cl實驗組的菌體生物量、紅曲黃色素產量均有所提高;紅曲紅色素、桔霉素產量均有所降低。含有0.3 mol/L NH4+的(NH4)2SO4發酵液桔霉素質量濃度降為0.05 mg/L,較對照組降低88.6%,紅曲黃色素升高33.1%,紅曲紅色素降低9.5%;含有0.1 mol/L NH4+的NH4Cl發酵液桔霉素質量濃度降為0.05 mg/L,紅曲黃色素升高24.1%,紅曲紅色素降低8.5%;含有0.3 mol/L NH4+的NH4NO3發酵液紅曲黃色素升高31.0%,紅曲紅色素降低11.6%,未檢出桔霉素。說明這3 種銨鹽提供的低pH值環境有利于M.purpureus Y20生長,促進紅曲黃色素生物合成,抑制桔霉素、紅曲紅色素的生成。含有NH4+0.1~0.4 mol/L的CH3COONH4、NH4H2PO4、C6H5O7(NH4)3發酵液均無桔霉素檢出,但菌體生物量較小,色價均低于50 U,說明這3 種銨鹽抑制了M.purpureus Y20的生長,從而影響紅曲色素和桔霉素的代謝生成。上述結果推測:添加銨鹽影響發酵液pH值環境,可通過抑制桔霉素生成、改變紅曲色素合成代謝等方面調控M.purpureus Y20的營養物質吸收和代謝;添加適量NH4NO3、(NH4)2SO4、NH4Cl有利于提高紅曲黃色素的生物合成,抑制桔霉素的生成。研究結果為從代謝層面研究銨鹽對紅曲色素和桔霉素的調控機理提供了思路和技術數據。
參考文獻:
[1]WANG W,CHEN Q,ZHANG X,et al.Comparison of extraction methods for analysis of citrinin in red fermented rice[J].Food Chemistry,2014,157(8):408-412.DOI:10.1016/j.foodchem.2014.02.060.
[2]潘榮華,鄭立忠,姜嘉善,等.紅曲中桔霉素的檢測及控制[J].現代生物醫學進展,2013,13(36):7160-7164.
[3]BLANC P J,LAUSSAC J P,le BARS J,et al.Characterization of monascidin A from Monascus as citrinin[J].International Journal of Food Microbiology,1995,27(2/3):201-213.DOI:10.1016/0168-1605(94)00167-5.
[4]FENGY L,SHAOY C,ZHOU Y X,et al.Monacolin K production by citrinin-free Monascus pilosus MS-1 and fermentation process monitoring[J].Engineering in Life Sciences,2014,14(5):538-545.
[5]唐僖,宋航.紅曲中桔霉素的檢測控制及無桔霉素紅曲產業化[J].中國釀造,2009,28(9):1-6.DOI:10.3969/j.issn.0254-5071.2009.09.001.
[6]黃艷梅,劉道峰,賴衛華,等.集成免疫磁珠富集和免疫層析的黃曲霉毒素M-1快速檢測法[J].分析化學,2014(5):654-659.
[7]KANG B Y,ZHANG X H,WU Z Q,et al.Production of citrininfree Monascus pigments by submerged culture at low pH[J].Enzyme and Microbial Technology,2014,55:50-57.DOI:10.1016/j.enzmictec.2013.12.007.
[8]TAN Y Y,HSU W H,SHIH T W,et al.Proteomic insight into the effect of ethanol on citrinin biosynthesis pathway in Monascus purpureus NTU 568[J].Food Research International,2014,64:733-742.DOI:10.1016/j.foodres.2014.08.004.
[9]張慧娟,朱效剛,毛鵬,等.溶氧對紅曲菌發酵生物合成橙色素的影響[J].食品科學技術學報,2015,33(6):72-77.
[10]TAKEO S,HIROSHI K,SHINJI I,et al.Polyketide synthase gene responsible for citrinin biosynthesis in Monascus purpureus[J].Applied and Environmental Microbiology,2005,71(7):3453-3457.
[11]YANG J,CHEN Q,WANG W P,et al.Effect of oxygen supply on Monascus pigments and citrinin production in submerged fermentation[J].Journal of Bioscience & Bioengineering,2015,119(5):564-569.DOI:10.1016/j.jbiosc.2014.10.014.
[12]劉暢,葛鋒,劉迪秋,等.紅曲桔霉素控制對策[J].中國生物工程雜志,2009,29(11):117-122.
[13]張曉偉,王昌祿,陳勉華,等.理化因子對紅曲色素色價的影響及桔霉素的光降解性[J].食品科學,2013,34(15):17-21.
[14]楊強,郎天丹,岳建明,等.紅曲黃色素的分離純化與表征[J].食品工業科技,2015,16(2):308-312.
[15]TAKAHASHI R,CHYSIRICHOTE T,ASAMI K,et al.Effect of oxygen mass transfer between the gas and liquid phases on the production of Monascus red pigments by Monascus ruber[J].Journal of Chemical Engineering of Japan,2013,46(8):546-549.DOI:10.1252/jcej.13we083.
[16]穆洪霞,丁雪梅,黃六斌,等.紅曲霉發酵不同底物產色素的研究進展[J].中國釀造,2014,33(1):1-4.
[17]HASSAN H,GERARD G,FRAN?OIS J M.Effect of the cultivation mode on red pigments production from Monascus ruber[J].International Journal of Food Science and Technology,2015,508(34):154-157.DOI:10.1111/ijfs.12803.
[18]張嬋,楊強,張樺林,等.超聲輔助法優化提取紅曲紅、紅曲黃色素[J].食品與生物技術學報,2014,33(8):805-813.
[19]WANG S C,ZHAO S X,MU H X,et al.Effect of Lactococcus lactis subsp.on production of pigment and citrinin by Monascus[J].Proceedings of the 2012 International Conference on Applied Biotechnology(ICAB 2012),2014,251(36):1591-1599.DOI:10.1007/978-3-642-37925-3_170.
[20]李秀利,曹學麗.紅腐乳中桔霉素的HPLC-FLD分析方法研究[J].食品科學技術學報,2014,32(4):75-80.
[21]van MARIS A J A,KONINGS W N,van DIJKEN J P,et al.Microbial export of lactic and 3-hydroxypropanoic acid:implications for industrial fermentation processes[J].Metabolic Engineering,2004,6(4):245-255.DOI:10.1016/j.ymben.2004.05.001.
[22]SAID F M,BROOKS J,CHISTI Y.Optimal C:N ratio for the production of red pigments by Monascus ruber[J].World Journal of Microbiology and Biotechnology,2014,30(9):2471-2479.DOI:10.1007/s11274-014-1672-6.
[23]YONGSMITH B,THONGPRADIS P,KLINSUPA W,et al.Fermentation and quality of yellow pigments from golden brown rice solid culture by a selected Monascus mutant[J].Applied Microbiology and Biotechnology,2013,97(20):8895-8902.DOI:10.1007/s00253-013-5106-4.
[24]ZHOU B,ZHU M J,WANG J F,et al.Effect of ammonium salts on Monascus yellow and red pigments and citrinin production[J].Journal of Chongqing Institute of Technology(Natural Science),2009,23(1):46-53.
[25]SHI K,SONG D,CHEN G,et al.Controlling composition and color characteristics of Monascus pigments by pH and nitrogen sources in submerged fermentation[J].Journal of Bioscience and Bioengineering,2015,120(2):145-154.DOI:10.1016/j.jbiosc.2015.01.001.
Effect of Addition of Ammonium Salts to Culture Medium on the Biosynthesis and Metabolism of Pigments and Citrinin in Monascus purpureus
YUE Jianming1,YANG Qiang1,XIAO Xiao1,YIN Sheng1,ZHANG Chan1,WANG Chengtao1,*,HU Jimei2,ZHAO Jixing3
(1.Beijing Engineering and Technology Research Center of Food Additives,Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Technology and Business University,Beijing 100048,China; 2.China International Engineering Consulting Corporation,Beijing 100048,China; 3.Shandong Zhonghui Biotechnology Co.Ltd.,Binzhou 251706,China)
Abstract:The effects of adding different kinds of ammonium salts to the culture medium on the biosynthesis and metabolism of pigments and citrinin in M.purpureus Y20 during liquid-state fermentation were studied by examining changes in the contents of monascus red pigment,monascus yellow pigment and citrinin.Also,we elaborated the underlying causes for the changes.The results showed that pH values of the fermentation broth of M.purpureus Y20 without added ammonium salt remained stable at 4.8 during fermentation,while those obtained with the addition of CH3COONH4,NH4H2PO4or C6H5O7(NH4)3were maintained at greater than 6.The initial pH of the culture medium with the addition of NH4NO3,(NH4)2SO4or NH4Cl was below 5.5,and then decreased to around 2.5 during fermentation.The final citrinin content of the groups with 0.15 mol/L(NH4)2SO4and 0.1-0.3 mol/L NH4Cl,respectively,during fermentation dropped to 0.05 mg/L,indicating an 88.6% reduction when compared with the controlgroupwith no added ammonium salt.No citrinin was detected in the fermentation broth with 0.3 mol/L NH4NO3added,and a 31.0% increase of yellow pigment content and an 11.6% decrease of red pigment content were observed compared with the control group.Similarly,no citrinin was detected in the fermentation broth with the addition of CH3COONH4,NH4H2PO4,or C6H5O7(NH4)3,but color value and biomass were lower,suggesting that the addition of ammonium salts could affect the pH environment of the fermentation,book=103,ebook=110and plays an importantrole in reducing citrinin and changing the proportions of monascuspigments.The addition of NH4NO3,NH4Cl and(NH4)2SO4can contribute to the biosynthesis of monascus yellow pigment and the inhibition of citrinin.
Key words:Monascus purpureus; monascus red pigment; monascus yellow pigment; citrinin; ammonium salts
中圖分類號:TS26
文獻標志碼:A
文章編號:1002-6630(2016)05-0102-06
DOI:10.7506/spkx1002-6630-201605019 10.7506/spkx1002-6630-201605019.http://www.spkx.net.cn
*通信作者:王成濤(1969—),男,教授,博士,研究方向為食品生物技術。E-mail:wct5566@163.com
作者簡介:岳建明(1991—),男,碩士研究生,研究方向為食品生物技術。E-mail:970084896@qq.com
基金項目:國家自然科學基金青年科學基金項目(31301411;31401669);北京市科技計劃項目(Z151100001215008);北京市屬高校創新能力提升計劃項目(014213201 6);2015年北京工商大學研究生科研能力提升計劃項目
收稿日期:2015-08-13

