尿素合成塔化學爆炸的可能性分析(三)
?
尿素合成塔化學爆炸的可能性分析(三)
沈華民
(中國化工學會化肥專業委員會上海200336)
4尿塔化學爆炸能量
塔器內發生化學爆炸時,其條件比燃燒更為嚴格,除了需具備發生燃燒的3個充分條件(可燃氣、助燃氣及火源)外,還被2個必要條件所限制,即爆炸濃度極限和能量極限,且兩者必須同時存在,才可能在有火源時被激發進而發生化學爆炸。換言之,只有當塔器內處于爆炸濃度極限范圍之內的氣體產生足夠的能量,此能量源自可燃氣與助燃氣在火源的激發下發生連鎖氧化反應而釋放出的化學反應能量,最終導致塔內壓力急劇升高而摧毀塔器。現以處于短期停車工況條件下、爆炸濃度極限范圍內的3個合成氣(E4,E6和E8)為研究對象,對尿塔物系爆炸能量進行研究。
4.1基礎數據
4.1.1尿塔設備參數
設備條件:體積40 m3,塔徑Φ1 400 mm,塔高26.4 m。
工藝條件:操作壓力20.0 MPa,正常氨碳比4.0~4.1,非正常氨碳比2.5,水碳比0.65。
原料:φ(CO2)為98.0%~98.5%,其余為惰氣H2和N2,且H2/N2=2(體積比);常規加O2量占CO2體積總量的0.5%,過量加O2量為1.0%;w(NH3)99.80%,w(N2)0.10%,w(H2)0.01%,w(CH4)0.09%。
原料入塔量(以生成1 t尿素計):1 333.75 kg NH3(50 ℃),733 kg CO2(125 ℃),1 275.75 kg甲銨液(100 ℃)。
生產負荷:16.67 t/h[I=10 t/(m3·d)]。
4.1.2標準態燃爆氣反應能量[11- 12]
標準態:壓力為0.101 3 MPa(即1 atm),溫度為25 ℃(298 K)。
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(g)+
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+
4.2爆炸能量
爆炸能量是一個多變量函數,主要有爆炸氣的體積和氣相組分2個重要參數。
體積參數:處于爆炸極限濃度范圍內的氣相體積越大,則爆炸釋放的能量就越大。
爆炸氣成分參數:氣相組分中燃爆氣種類、含量、與助燃氣的比例以及燃爆反應狀態等因素與爆炸能量密切相關。種類因素:氫氣是強燃爆氣,其含量越多,爆炸能量越大;氨是弱燃爆氣,爆炸釋放的能量較小。比例因素:若爆炸氣體積組成為2/3 H2和1/3 O2,爆炸能量必然是最大的。當爆炸氣體的組成和含量確定時,則氣相體積成為衡量爆炸能量最主要的參數。現以E4,E6和E8為研究對象,3個處于爆炸極限濃度范圍內的合成氣組分和含量均已確定,故這些氣體的體積計算已成為計算爆炸能量的關鍵。
尿塔爆炸能量的計算分3步進行:第1步,求取尿塔合成氣的體積;第2步,對合成氣中的氧量分配給H2,NH3及CH4;第3步,計算爆炸能量。
4.2.1爆炸氣相體積
本研究對象為短期停車工況下爆炸性混合氣(E4,E6和E8)的體積,即當尿塔處于由開車狀態轉變為短期停車狀態時靜態尿塔上部氣相空間的體積[圖12(b)中的G區]。
首先考察工業生產條件下尿塔內進行的合成反應過程。工業尿素合成理論指出,從尿塔塔底到塔頂的物流基本上呈氣液兩相流的形式進行合
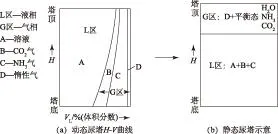
圖12 尿塔動態向靜態演變示意
成反應,并向上運動直至塔頂[圖12(a)]。在氣相物流中有1股惰氣物流[圖12(a)中D],由原料CO2,NH3及防腐空氣帶入系統的H2,O2,N2,CH4等組分構成,這些物質在尿素合成的液相物流中的溶解度極小,基本可以忽略。因此,可以認為進入系統的惰性物質在塔中幾乎全部存在于氣相中,故而從塔底到塔頂形成了1股惰氣物流,成為計算靜態尿塔上部空間氣相體積的基礎。
當切斷尿塔進、出口閥進入短停狀態時,尿塔由動態轉變為靜態,物系隨之發生如下變化:封閉在尿塔內存在于縱向物流中的惰氣會因重力作用全部轉入靜態尿塔上部空間;同時,靜態氣液平衡也隨之建立。靜態尿塔氣相空間總體積VS由惰氣總體積VI和尿素合成液相物系的平衡態氣相2個部分構成,若惰氣總體積及靜態物系壓力、溫度、氨碳比及水碳比已知時,氣相總體積VS可按下式求得:
(1)
式中:VS——氣相空間總體積,m3(標態);
VI——氣相空間中惰氣總體積,m3(標態);
P——操作壓力,MPa;
P平——靜態尿塔物系壓力,MPa;
GI——原料CO2,NH3及防腐空氣帶入系統的惰氣總量,m3/t(標態);
Z——負荷,t/h;
τ——物料在尿塔的停留時間,h;
PI——靜態尿塔惰氣分壓,MPa。
對于氣相組分及含量皆已知的合成混合氣,VS也可用下式計算:
(2)
式中:YI——惰氣總摩爾分率;
YH2,YO2,YN2,YCH4——分別為H2,O2,N2,CH4的摩爾分率。
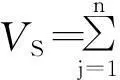
(3)
式中:Vj——合成混合氣各組分分體積,m3(標態)或kmol;
Yj——合成混合氣各組分摩爾分率。
以E4為例計算如下:GI=26.52m3/t(標態),Z=16.67t/h,τ=0.5h,YI=0.5;代入式(1)可得VS=442m3(標態)。
當各組分摩爾分率已知時,各組分分體積可用式(3)計算。對于NH3:
VNH3=VS·YNH3=203.32(m3,標態)
=9.07(kmol)
同理,可求得VCO2,VH2O,VH2,VN2,VCH4和VO2分別為0.39,0.39,2.31,5.62,0.60和1.33 kmol。
4.2.2氧量分配
由爆炸濃度范圍圖可知,合成混合氣是從爆炸上限進入爆炸極限范圍內并成為爆炸性氣體的。因此,在氣相中基本上是氧量供應不足,燃爆氣是過量的,即在合成混合氣中的氧量不可能全部滿足燃爆反應的需求。
本案例中有3種燃爆組分(NH3,H2,CH4),如何將不足的氧量科學合理分配至每一種燃爆組分中,排除主觀性頗為重要,本文從分子運動學原理來確定分配原則。由于尿素合成氣是均一氣體混合物,按各氣體分子間碰撞概率均等的原則,故將氧量按燃爆組分含量多少進行統一分配。
首先計算各單個燃爆氣在總燃爆氣中所占的比例:
(4)
k=1,2和3,分別代表NH3,H2和CH4。
式中:Fk——單個燃爆氣在總燃爆氣中的摩爾分率;
Yk——氣體摩爾分率。
單個燃爆氣分配得的氧量計算式為:
(5)
式中:Wk——單個燃爆氣分配得的氧量,m3(標態)或kmol;
VO2——總氧量,按式(3)計算,m3(標態)或kmol。
仍以E4為例,由式(4)計算出NH3,H2和CH4占總燃爆氣的分率FNH3,FH2和FCH4分別為0.756 9,0.193 0和0.050 1,再用式(5)計算求得單個燃爆氣(NH3,H2,CH4)分得的氧量分別為1.006 7,0.256 7和0.066 6 kmol。
4.2.3燃爆反應能量的校正[13- 14]
本文已提供了標準狀態下3個單質化合物燃爆反應能量,但由于合成物系處于壓力20.0 MPa和溫度180 ℃狀態下,故而必須將標準態的反應焓變(即釋放能量)轉換成合成物系狀態下的反應焓變。
4.2.3.1以H2為例(180 ℃)
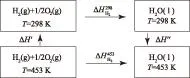
圖13 180 ℃條件下反應焓變的計算過程設計
由蓋斯定律:
(1)ΔH′的計算
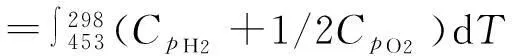
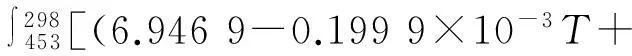
4.808×10-7T2)+1/2(6.095 4+32 533×10-3T-10.171×10-7T2)]dT
=-1 541(cal/mol)
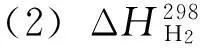
=-286.0 kJ/mol
(3)ΔH″的計算
ΔH″的計算過程設計如下:
298 K373 K 373 K453 K453 K
ΔH″=ΔH1+ΔH2+ΔH3+ΔH4
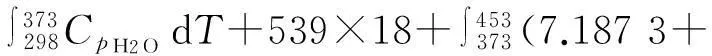
2.37×10-3T+2.08×10-7T2)dT-481×18
=2 969(cal/mol)
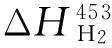
=-66 890(cal/mol)
=-279.6(kJ/mol)
4.2.3.2CH4的校正計算(180 ℃)
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+
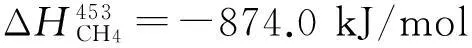
4.2.3.3NH3的校正計算(180 ℃)
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(l)+
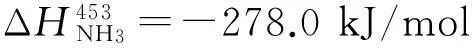
4.2.4爆炸能量計算
爆炸反應與燃燒反應都是由于氧化反應而釋放出大量化學反應能量,因燃燒反應而釋放出的能量稱為燃燒熱,因爆炸性氣體釋放出的能量稱為爆炸能量。
爆炸反應的反應通式如下:
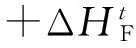
單個可爆氣釋放的化學能量計算式為:
(6)
式中:Q——爆炸能量,kJ;
VO2——物系氧量,mol;
a——反應助燃物O2的反應系數。
對于混合可爆氣,物系總的爆炸能量表達式為:
(7)
式中:QS——物系總的爆炸能量,kJ;
k=1,2和3,分別代表NH3,H2和CH4。
對于合成氣E4,3個爆炸性氣體(NH3,H2,CH4)的爆炸能量分別由式(6)計算如下。
(1)QNH3的計算
NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(l)+
278.0 kJ/mol
QNH3=278.0×1.006 7×103/(7/4)
=1.60×105(kJ)
(2)QH2的計算
H2(g)+1/2O2(g)=H2O(l)+279.6 kJ/mol
QH2=279.6×0.256 7×103/0.5
=1.44×105(kJ)
(3)QCH4的計算
CH4(g)+2O2(g)=CO2(g)+2H2O(l)+874.0 kJ/mol
QCH4=874.0×0.066 6×103/2
=0.29×105(kJ)
由式(7)求得E4總的爆炸能量QS=3.33×105(kJ)。
4.2.5計算結果
合成可爆氣E4的各項計算結果匯總如表8所示。按上述方法,同樣可對另外2個合成爆炸性氣體E6和E8進行計算,計算結果匯總分別列于表9和表10。
表8E4計算結果匯總
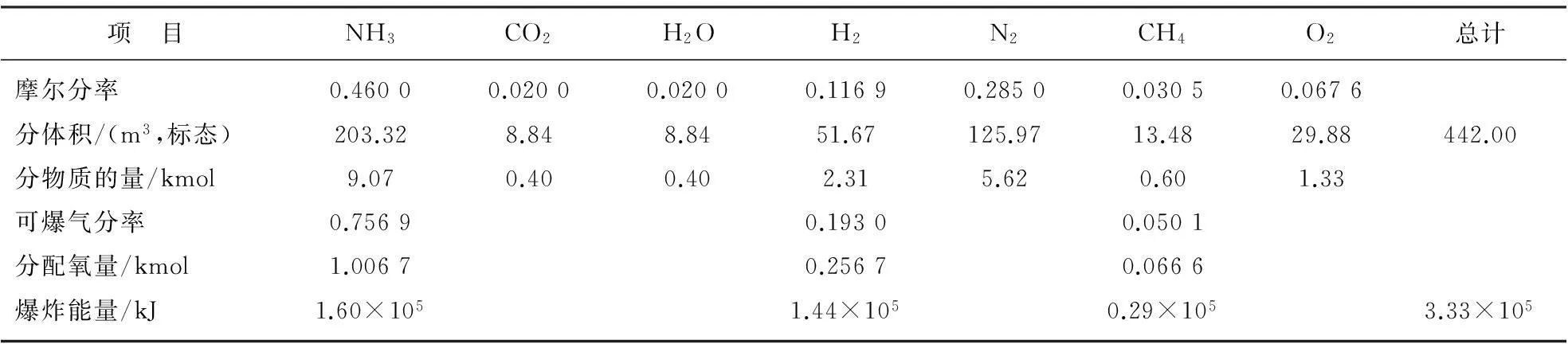
項 目NH3CO2H2OH2N2CH4O2總計摩爾分率0.46000.02000.02000.11690.28500.03050.0676分體積/(m3,標態)203.328.848.8451.67125.9713.4829.88442.00分物質的量/kmol9.070.400.402.315.620.601.33可爆氣分率0.75690.19300.0501分配氧量/kmol1.00670.25670.0666爆炸能量/kJ1.60×1051.44×1050.29×1053.33×105
表9E6計算結果匯總
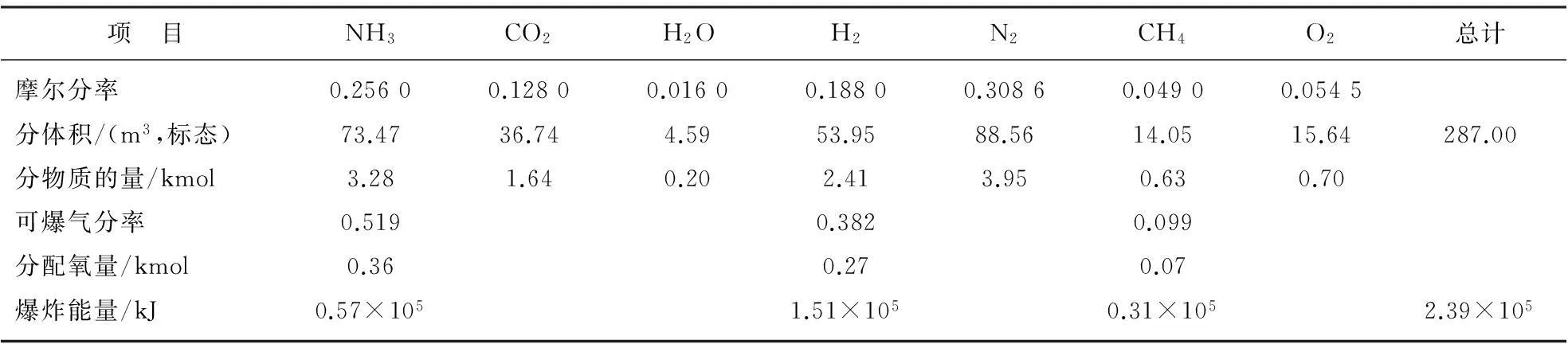
項 目NH3CO2H2OH2N2CH4O2總計摩爾分率0.25600.12800.01600.18800.30860.04900.0545分體積/(m3,標態)73.4736.744.5953.9588.5614.0515.64287.00分物質的量/kmol3.281.640.202.413.950.630.70可爆氣分率0.5190.3820.099分配氧量/kmol0.360.270.07爆炸能量/kJ0.57×1051.51×1050.31×1052.39×105
表10E8計算結果匯總
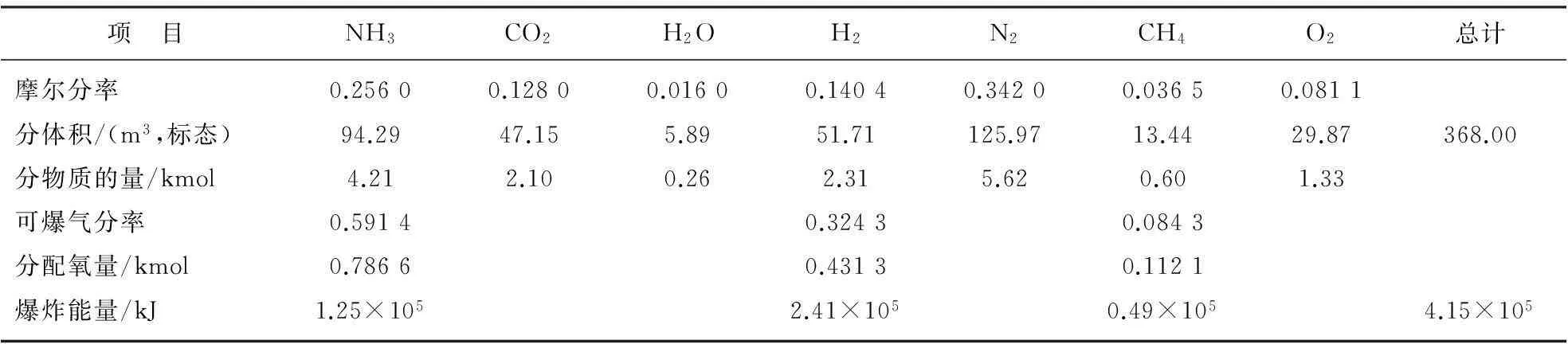
項 目NH3CO2H2OH2N2CH4O2總計摩爾分率0.25600.12800.01600.14040.34200.03650.0811分體積/(m3,標態)94.2947.155.8951.71125.9713.4429.87368.00分物質的量/kmol4.212.100.262.315.620.601.33可爆氣分率0.59140.32430.0843分配氧量/kmol0.78660.43130.1121爆炸能量/kJ1.25×1052.41×1050.49×1054.15×105
4.3討論
4.3.1破壞功
破壞功由上部塔段拋射功[15]、中部塔段平射功[16]和筒體撕裂功[15]3個部分組成。
(1)上部塔段拋射功:包括第1~第8節筒體,約100 t,飛出約86 m,計算得W3n=1.715 8×105kJ。
(2)中部塔段平射功:第9節筒體斜向飛出12.5 m,計算得W2n=3.068 0×104kJ。
(3)筒體撕裂功:第9節筒體上下兩焊縫環向撕裂,解得W1n=1.660 0×104×2=3.3200×104(kJ)。
上述3個部分之和得總破壞功WS=2.354 6×105kJ。
4.3.2爆炸能量與破壞功的比較
爆炸能量大于破壞功。由于在爆炸能量轉化為對塔器破壞功時有損耗,故而爆炸能量不可能全部轉化為破壞功,其轉化效率η=WS/QS。本文所計算得到的中型尿塔E4,E6和E8的爆炸能量QS分別為3.33×105,2.39×105和4.15×105kJ,因而轉化效率分別為70%,98%和57%。
本文關于化學爆炸能量的計算值與破壞功量文獻計算值之間的合理對接,說明兩者具有因果關系的,從而也證明了尿塔的爆炸屬于化學爆炸。
收稿日期(待續,2015- 06- 19)

