磷酸鞘氨醇對胰腺癌PANC1細胞遷移、侵襲能力的影響
田波 隋淑靜 孟茜茜 劉培培 林寒 辛磊 李兆申 王洛偉
200433 上海,第二軍醫大學長海醫院消化內科(田波、孟茜茜、劉培培、林寒、辛磊、李兆申、王洛偉);泰安市中心醫院消化內一科(隋淑靜)
?
·論著·
磷酸鞘氨醇對胰腺癌PANC1細胞遷移、侵襲能力的影響
田波隋淑靜孟茜茜劉培培林寒辛磊李兆申王洛偉
200433上海,第二軍醫大學長海醫院消化內科(田波、孟茜茜、劉培培、林寒、辛磊、李兆申、王洛偉);泰安市中心醫院消化內一科(隋淑靜)
【摘要】目的觀察磷酸鞘氨醇(S1P)干預對胰腺癌PANC1細胞侵襲、轉移能力的影響。方法采用20、40、80、100、150、200 nmol/L S1P干預PANC1細胞24 h,以未干預細胞作為對照組。另采用S1P特異性受體拮抗劑VPC23019 10 μmol/L 預處理1 h后再應用100 nmol/L S1P干預PANC1細胞24 h(VPC+S1P組),同時設單用S1P干預(S1P組)、單用VPC23019處理(VPC組)及未處理的對照組。采用熒光定量PCR和蛋白質印跡法檢測各組細胞N-Cadherin mRNA和蛋白表達,采用劃痕實驗和Transwell小室檢測細胞的遷移、侵襲能力。結果對照組及20、40、80、100、150、200 nmol/L S1P干預組細胞N-Cadherin mRNA表達量分別為1.000±0.061、1.240±0.106、1.547±0.085、1.827±0.114、2.160±0.164、1.767±0.146、1.493±0.163,以100 nmol/L S1P干預組的表達量最高,各干預組均顯著高于對照組,差異有統計學意義(P值均<0.05)。對照組、S1P組、VPC組、VPC+S1P組細胞N-Cadherin mRNA表達量分別為1.000±0.114、2.273±0.341、0.920±0.096、0.340±0.110;對照組、S1P組、VPC+S1P組N-Cadherin蛋白表達量分別為1.000±0.176、2.167±0.242、0.510±0.151,細胞遷移率分別為(32.5±2.6)%、(57.5±3.3)%、(11.2±3.5)%,穿膜細胞數分別為(79±4.3)、(168±5.7)、(55±3.7)個/200倍視野。S1P組較對照組顯著增加,VPC+S1P組較S1P組及對照組顯著減少,差異均有統計學意義(P值均<0.05)。結論S1P干預可增強胰腺癌PANC1細胞的遷移、侵襲能力,應用S1P特異性受體拮抗劑VPC23019預處理可完全阻斷S1P的作用,其機制可能與下調N-Cadherin基因表達有關。
【關鍵詞】胰腺腫瘤;鞘氨醇;VPC23019;N-Cadherin;細胞系,腫瘤
Fund program:Natural Science Foundation of China(30700360)
磷酸鞘氨醇(sphingosine 1-phosphate,S1P)是細胞膜鞘磷脂的代謝產物,通過與S1P異三聚體G蛋白耦聯受體(S1PR)結合介導機體炎癥反應、細胞增殖遷移、血管生成等多種生理活動,同時在多種惡性腫瘤發生和發展過程中具有重要作用。研究表明,當S1P與S1PR1/S1PR3結合時,腫瘤的侵襲轉移能力提高,而沉默受體表達或拮抗受體的方法可以有效降低S1P誘導的腫瘤侵襲轉移。N-Cadherin是連接細胞骨架、增強細胞運動性的鈣黏蛋白,與腫瘤細胞間黏附蛋白的表達、微血管生成密切相關[1]。正常細胞從緊密連接的極性上皮細胞轉化為非極性的、能自由侵襲的細胞時N-Cadherin表達相應增加,抑制N-Cadherin的表達可以降低腫瘤發生轉移的能力[2-3]。因此,本研究應用S1P特異性受體拮抗劑VPC23019處理S1P刺激后的胰腺癌PANC1細胞,觀察其對癌細胞侵襲轉移能力的影響,探討其可能機制。
材料和方法
一、熒光定量PCR法檢測細胞N-Cadherin mRNA表達
人胰腺癌細胞株PANC1為長海醫院保存,常規培養、傳代。取對數生長期細胞,待培養至70%融合狀態時用無血清DMEM培養過夜。加入終濃度為20、40、80、100、150、200 nmol/L的S1P(Sigma公司)干預24 h,以未處理細胞作為對照組,每組設3個復孔。另取對數生長期細胞,分為對照組、S1P組、VPC組、VPC+S1P1組、VPC+S1P2組。S1P組應用100 nmol/L S1P干預24 h,VPC組應用10 μmol/L VPC23019處理24 h,VPC+S1P1組、VPC+S1P2組分別用1、10 μmol/L VPC23019預處理1 h后再應用100 nmol/L S1P干預24 h,以未處理細胞作為對照組,每組設3個復孔。
收集上述各組細胞,采用Trizol試劑提取細胞總RNA,先逆轉成cDNA,再行熒光定量PCR檢測N-Cadherin mRNA表達量。N-Cadherin引物序列為5′-AGCCAACCTTAACTGAGGAGT-3′和5′-GGCAAG-TTGATTGGAGGGATG-3′,擴增產物136 bp;內參GAPDH引物序列為5′-ATGACATCAAGAAGGTGGTG-3′和5′-CATACCAGGAAATGAGCTTG-3′,擴增產物197 bp。引物由上海吉瑪制藥技術有限公司合成。PCR反應參數:95℃ 20 s,95℃ 10 s、60℃ 20 s、72℃ 10 s,40次循環。實驗重復3次,取均值。由儀器自帶軟件獲取Ct值,以對照組細胞N-Cadherin mRNA表達量為1,計算處理組細胞N-Cadherin mRNA相對表達量。
二、劃痕實驗檢測細胞遷移能力
取對數生長期細胞,以5×105/孔接種于6孔板,分為對照組、S1P組、VPC+ S1P組(VPC預處理濃度為10 μmol/L),每組設3個復孔。培養至約90%融合時棄去培養液,用10 μl的移液槍頭在平板中間劃一條橫線,PBS沖洗3次,按上述分組配制無血清DMEM培養液培養24 h。在處理當時(0 h)及培養24 h時測量劃痕的距離。
細胞遷移率=[(0 h劃痕距離-24 h劃痕距離)/0 h劃痕距離]×100%
三、Transwell小室檢測細胞侵襲能力
Transwell小室購自Costar公司。每個小室的聚碳酸酯膜上加50 μl用無血清DMEM培養液稀釋的Matrigel,待其充分聚合,Transwell下室加入600 μl含10% FBS的DMEM培養液,Transwell上室加100 μl用無血清DMEM培養液稀釋的5×105/ml的細胞懸液。實驗分為對照組、S1P組、VPC+S1P組(VPC預處理濃度為10 μmol/L),每組3個小室。培養48 h后取出Transwell小室隔膜,用棉簽拭去膜表面的Matrigel,無水乙醇固定細胞,PBS沖洗晾干,然后用0.1%結晶紫染色10 min,去除多余結晶紫染液,光鏡下隨機選取5個200倍視野,計數穿膜細胞數,取均值。
四、蛋白質印跡法檢測N-Cadherin蛋白表達
取上述各組培養48 h的PANC1細胞,用RIPA裂解液制備細胞總蛋白,測定蛋白濃度,常規行蛋白質印跡法檢測N-Cadherin蛋白表達,以β-actin為內參。兔抗人N-Cadherin、β-actin抗體均購自Abcam公司,工作濃度分別為1∶5 000,1∶3 000。最后ECL顯影,膠片曝光、顯影、定影。用凝膠圖像軟件分析系統掃描膠片,以目的條帶與內參條帶的灰度值比表示蛋白的相對表達量。
五、統計學處理
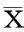
結果
一、各組PANC1細胞N-Cadherin mRNA表達量的變化
對照組細胞N-Cadherin mRNA表達量為1.000±0.061;20、40、80、100、150、200 nmol/L S1P干預組細胞N-Cadherin mRNA表達量分別為1.240±0.106、1.547±0.085、1.827±0.114、2.160±0.164、1.767±0.146、1.493±0.163,其中100 nmol/L S1P干預組的表達量最高。各干預組均顯著高于對照組,差異有統計學意義(P值分別0.027、0.001、0.000、0.000、0.001、0.008)。
VPC23019預處理實驗中,對照組、S1P組、VPC組、VPC+S1P1組、VPC+S1P2組細胞N-Cadherin mRNA表達量分別為1.000±0.114、2.273±0.341、0.920±0.096、0.617±0.057、0.340±0.110。VPC組與對照組的差異無統計學意義(P=0.405)。S1P組較對照組顯著增加,VPC+S1P1組、VPC+S1P2組較S1P組顯著下降,差異均有統計學意義 (P值分別為0.004、0.006、0.002)。
二、各組PANC1細胞N-Cadherin蛋白表達量的變化
對照組、S1P組、VPC+S1P組N-Cadherin蛋白相對表達量分別為1.000±0.176、2.167±0.242、0.510±0.151。S1P組較對照組顯著增加,VPC+S1P組較S1P組及對照組均顯著減少,差異均有統計學意義(P值分別為0.003、0.001、0.022)。
三、各組PANC1細胞遷移能力的變化
對照組、S1P組、VPC+S1P組細胞遷移率分別為(32.5±2.6)%、(57.5±3.3)%、(11.2±3.5)%,S1P組較對照組顯著增加,VPC+S1P組較S1P組及對照組均顯著下降,差異均有統計學意義(P值分別為0.001、0.000、0.001),見圖1。
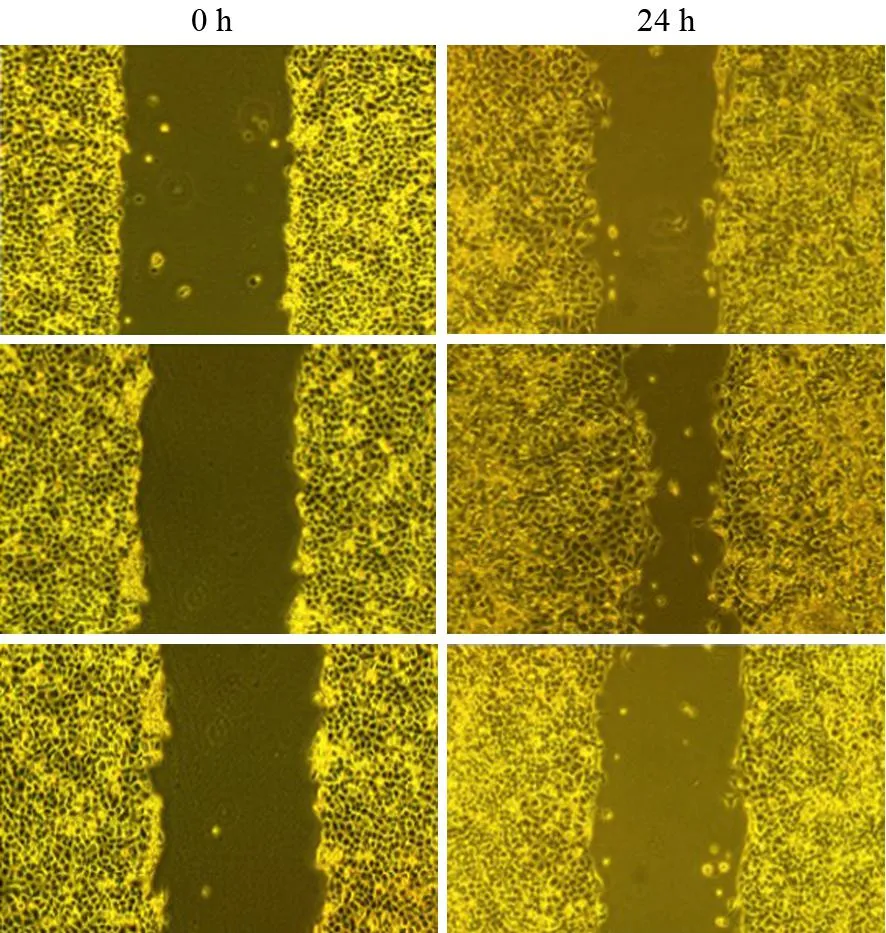
圖1 對照組(上)、S1P組(中)、VPC+S1P組(下)細胞遷移情況(×40)
四、各組PANC1細胞侵襲能力的變化
對照組、S1P組、VPC+S1P組穿膜細胞數分別為(79±4.3)、(168±5.7)、(55±3.7)個/200倍視野。S1P組穿膜細胞數較對照組顯著增加,VPC+S1P組較S1P組及對照組均顯著減少,差異均有統計學意義(P值分別為0.000、0.006、0.000),見圖2。
討論
脂類代謝的異常與胰腺癌的發生和發展關系密切,許多脂類及脂代謝關鍵酶的血漿濃度和胰腺癌患者的病理分期、對放化療的敏感性及預后密切相關[4-5]。S1P是一種由細胞膜鞘磷脂受鞘氨醇激酶催化生成的代謝產物,通過與細胞膜表面S1P受體(S1PR)結合,發揮生物學作用。S1PR為G蛋白耦聯受體家族成員,迄今共發現5型,其中S1PR1~3廣泛分布于人體各種組織中,對血管生成、免疫調節等機體生理活動起著重要作用[4-5]。血漿中S1P大部分以與脂蛋白結合的形式存在,極少部分為游離狀態。以往多項研究[6-8]證明,S1P通過與乳腺癌、前列腺癌等惡性腫瘤細胞表面受體結合影響腫瘤細胞增殖和侵襲、轉移能力,其生物學活性受結合受體類型、S1P濃度等因素影響。當S1P與S1PR1、3兩個受體相結合時會增加腫瘤的惡性程度,而與S1PR2結合則可拮抗該作用。Sutphen等[9]報道,卵巢癌患者血漿S1P濃度與腫瘤惡性進程密切相關,腫瘤切除后血漿S1P濃度明顯下降。
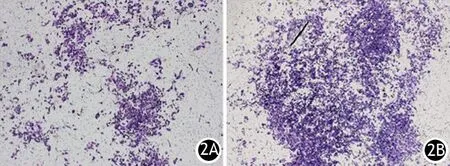
圖2對照組(2A)、S1P組(2B)、VPC+S1P組(2C)穿膜細胞(×40)
N-Cadherin是一種在細胞膜之間接觸層面高表達,并且可以內在連接細胞骨架,增強細胞運動性的鈣黏蛋白,其高表達可以導致胰腺癌轉移侵襲能力增強、腫瘤的分化程度降低等,是胰腺癌上皮間質轉化的重要作用分子[2]。VPC23019為一種人工合成的S1PR1、3受體拮抗劑,其化學結構與S1P有一定的相似,可以特異性抑制S1P與S1PR1、3的結合,阻滯部分S1P下游通路的激活[10]。
本研究結果顯示,S1P干預PANC1細胞后,N-Cadherin蛋白表達量增加,以100 nmol/L S1P干預時的表達量增加最明顯,同時PANC1細胞的侵襲、轉移能力增強。單用VPC處理PANC1細胞,N-Cadherin mRNA表達不受影響,但用VPC預處理后再用S1P干預細胞時N-Cadherin mRNA及蛋白表達量較單用S1P干預組顯著下降,細胞的侵襲轉移能力顯著被抑制,而且也較對照組細胞下降,提示S1P干預PANC1細胞后通過增加N-Cadherin基因表達而抑制癌細胞的侵襲、轉移能力,用S1PR1、3受體拮抗劑預處理則可完全阻斷S1P的作用。因此,采用特異性阻滯S1P通路抑制胰腺癌細胞的侵襲轉移能力可能成為治療胰腺癌的新靶點。
參考文獻
[1]Blaschuk OW, Devemy E. Cadherins as novel targets for anti-cancer therapy[J]. Eur J Pharmacol, 2009, 625(1-3): 195-198.DOI: 10.1016/j.ejphar.2009.05.033.
[2]Nakajima S, Doi R, Toyoda E, et al. N-cadherin expression and epithelial-mesenchymal transition in pancreatic carcinoma[J]. Clin Cancer Res, 2004, 10(12 Pt 1): 4125-4133.DOI:10.1158/1078-0432.ccr-0578-03.
[3]Cheng ZX, Wang DW, Liu T, et al. Effects of the HIF-1alpha and NF-kappaB loop on epithelial-mesenchymal transition and chemoresistance induced by hypoxia in pancreatic cancer cells[J]. Oncol Rep, 2014, 31(4): 1891-1898.DOI:10.3892/or 2014.3022.
[4]Milstien S, Spiegel S. Targeting sphingosine-1phosphate: a novel avenue for cancer therapeutics[J]. Cancer cell, 2006, 9(3): 148-150.DOI:10.1016/j.ccr.2006.02.025.
[5]Swierczynski J, Hebanowska A, Sledzinski T. Role of abnormal lipid metabolism in development, progression, diagnosis and therapy of pancreatic cancer[J]. World J Gastroenterol, 2014, 20(9): 2279-2303.DOI:10.3748/wjg.v20.i9.2279.
[6]Visentin B, Vekich JA, Sibbald BJ, et al. Validation of an anti-sphingosine-1-phosphate antibody as a potential therapeutic in reducing growth, invasion, and angiogenesis in multiple tumor lineages[J]. Cancer cell, 2006, 9(3): 225-238.DOI:10.3410/f.1033771.387964.
[7]Du W, Takuwa N, Yoshioka K, et al. S1P(2), the G protein-coupled receptor for sphingosine-1-phosphate, negatively regulates tumor angiogenesis and tumor growth in vivo in mice[J]. Cancer Res, 2010, 70(2): 772-781.DOI:10.1158/0008-5472.CAN-09-2722.
[8]Sekine Y, Suzuki K, Remaley AT. HDL and sphingosine-1-phosphate activate stat3 in prostate cancer DU145 cells via ERK1/2 and S1P receptors, and promote cell migration and invasion[J]. Prostate, 2011, 71(7): 690-699.DOI:10.1002/pros.21285.
[9]Sutphen R, Xu Y, Wilbanks GD, et al. Lysophospholipids are potential biomarkers of ovarian cancer[J]. Cancer Epidemiol, Biomarkers Prev, 2004, 13(7): 1185-1191.
[10]Davis MD, Clemens JJ, Macdonald TL, et al. Sphingosine 1-phosphate analogs as receptor antagonists[J]. J Biol Chem, 2005, 280(11): 9833-9841.DOI:10.1074/jbc.M412356200.
(本文編輯:呂芳萍)
The influence of sphingosine 1-phosphate on migration and invasion of pancreatic cancer PANC1 cells
TiaoBo,SuiShujing,MengQianqian,LiuPeipei,LinHan,XinLei,LiZhaoshen,WangLuowei.DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai, 200433China
【Abstract】ObjectiveTo observe the influence of sphingosine 1-phosphate (S1P) on cell migration and invasion in pancreatic cancer PANC1 cells. MethodsDifferent concentrations (20, 40, 80, 100, 150, 200 nmol/L) of S1P was used to treat PANC1 cells for 24 h and untreated cells were used as control. Cells were pretreated by 10 μmol/L VPC23019 for 1 h and then treated by 100 nmol/L S1P in VPC+S1P group, only treated by S1P in S1P group, and only treated by VPC23019 in VPC group, and untreated in control group. Fluorescent quantitative PCR and Western blot were used to detect N-Cadherin mRNA and protein expression, and wound healing test and transwell chambers were used to detect cell migration and invasion.
ResultsN-Cadherin mRNA expression in control, 20, 40, 80, 100, 150, 200 nmol/L S1P group was 1.000±0.061,1.240±0.106,1.547±0.085,1.827±0.114,2.160±0.164,1.767±0.146,1.493±0.163, and 100 nmol/L S1P stimulated the highest N-Cadherin expression. N-Cadherin mRNA expression in control, S1P, VPC and VPC+S1P group was 1.000±0.114,2.273±0.341, 0.920±0.096, 0.340±0.110, respectively. N-Cadherin protein expression in control, S1P, VPC+S1P group was 1.000±0.176, 2.167±0.242, 0.510±0.151; cell migration rate was (32.5±2.6)%, (57.5±3.3)%,(11.2±3.5)%; and the transmembrane cell numbers were 79±4.3,168±5.7, 55±3.7 cell2 in each view a maginification of 200 times. Cell migration and invasion in S1P group were significantly increased, and those in VPC+S1P group were dicreased when compared with S1P and control group (allP<0.05). ConclusionsS1P can increase the migration and invasion ability of PANC1 cells, and pretreatment of S1P specific inhibitor VPC23019 could completely abolish the function of S1P.The molecular mechanism may be associated with reducing the expression of N-Cadherin.
【Key words】Pancreatic neoplasms;Sphingosine;VPC23019;N-Cadherin;Cell line, tumor
(收稿日期:2015-12-29)
Corresponding author:Wang Luowei, Email: phdwang@hotmail.com
基金項目:國家自然科學基金(30700360)
通信作者:王洛偉,Email:phdwang@hotmail.com
DOI:10.3760/cma.j.issn.1674-1935.2016.02.001
共同第一作者:隋淑靜

