大黃素聯合吉西他濱抑制胰腺癌細胞系PANC- 1細胞增殖能力的研究*
王 婧, 趙 磊, 車娟娟, 李卉惠, 龐歆橋, 吳 軍, 馬妮娜
(首都醫科大學附屬北京友誼醫院腫瘤科, 北京 100050)
大黃素聯合吉西他濱抑制胰腺癌細胞系PANC- 1細胞增殖能力的研究*
王 婧, 趙 磊, 車娟娟, 李卉惠, 龐歆橋, 吳 軍, 馬妮娜△
(首都醫科大學附屬北京友誼醫院腫瘤科, 北京 100050)
目的:驗證大黃素聯合吉西他濱(gemcitabine,GEM)抑制胰腺癌細胞系PANC- 1細胞增殖的作用,探討大黃素促PANC- 1細胞凋亡的抗腫瘤作用機制。方法: MTT方法檢測大黃素單藥以及與吉西他濱聯合應用對PANC- 1細胞增殖能力的影響。ELISA方法測定細胞上清IL- 6水平。RT- PCR方法檢測大黃素處理后PANC- 1細胞內侵襲相關基因MMP- 9的表達情況。Western blot方法分別檢測大黃素以及吉西他濱處理PANC- 1后凋亡相關蛋白Bax和Bcl- 2的表達水平。結果: MTT檢測結果顯示,加藥處理細胞72h后,大黃素組(40μmol/l)PANC- 1細胞抑制率為31%,GEM組(20μmol/l)的抑制率為35%,聯合用藥組的抑制率為49%,與對照組相比差異有統計學意義(P<0.05)。IL- 6濃度大黃素組為(22.41±2.27)ng/ml,聯合用藥組為(15.44±3.91)ng/ml。實驗組均顯著低于對照組,差異有統計學意義(P<0.05)。大黃素組、聯合用藥組MMP- 9 mRNA表達水平顯著低于對照組,GEM組較對照組相比差異無統計學意義(P>0.05)。大黃素組、GEM組、聯合用藥組Bax表達水平上調,但Bcl- 2差異無統計學意義。大黃素組、GEM組、聯合用藥組的Bax/Bcl- 2分別為2.71±0.25, 4.73±0.17, 5.72±0.36,均顯著高于對照組1.14±0.15,結論: 體外研究結果顯示大黃素能夠抑制腫瘤PANC- 1細胞增殖,具有促細胞凋亡的作用,與吉西他濱聯合應用具有協同效應。
大黃素; 胰腺癌; 凋亡
大黃是臨床常用中藥之一,具有瀉下等多種功效。我們在臨床中發現,大黃類藥物在治療胰腺癌患者腹部脹滿不適有良好療效。課題組既往研究證實[1],大黃對胰腺的保護機制可能與降低胰酶、減少炎性介質、保護胰腺細胞、保護胃腸道等有關。大黃素是大黃的有效活性成分,本實驗擬通過研究大黃素與吉西他濱(gemcitabin, GEM)聯合作用對胰腺癌細胞增殖能力的影響,探討大黃素促腫瘤細胞的分子機制,為臨床應用提供理論依據。
1 材料與方法
1.1 細胞株
人胰腺癌細胞株PANC- 1由首都醫科大學附屬北京友誼醫院樣本庫提供,培養傳代于含10%胎牛血清的1640培養基中,置于5%CO2,37℃溫箱,選擇對數生長期的細胞進行實驗。
1.2 藥物與試劑
大黃素購于Sigma公司(St. Louis, USA),使用dimethylsulfoxide (DMSO)溶解至0.2mmol/l,-20℃分裝保存,二甲基亞砜(Dimethyl Sulphoxide,DMSO)的終濃度小于0.1%。吉西他濱(Gemcitabine,GEM)購自禮來公司(Ely Lilly),使用生理鹽水溶解至50g/L保存。1640培養基購自美國hyclone公司;胎牛血清購自ExCell公司。基質金屬蛋白酶- 9(matrix metalloproteinases- 9,MMP- 9)和GAPDH引物由北京奧克鼎盛生物技術有限公司合成,逆轉錄試劑盒和熒光實時定量PCR試劑盒購自Takara公司。
1.3 實驗分組
本研究共分為4組,A組:對照組(0.1%DMSO),B組:GEM組(GEM,20μmol/l)、C組:大黃素組(Emodin,40μmol/l),D組:聯合用藥組(GEM,20μmol/l+Emodin,40μmol/l),每組設置4個復孔。
1.4 MTT法檢測細胞活力
將對數生長期的PANC- 1細胞鋪于96孔板內,每孔50μl細胞懸液(含1× 104個細胞),加入1640培養液50μl,使終體積為100μl。待培養72h細胞充分貼壁后進行分組實驗,分為對照組、GEM組、大黃素組和聯合用藥組,干預72h作為實驗終止時間,每孔加入MTT溶液 20μl,37℃孵育4h,然后吸出上清,每孔各加入DMSO 150μl震蕩10分鐘,震蕩混勻后,使用酶標儀測量波長為490nm處的OD值。計算公式為:細胞增殖率=實驗組平均OD值/對照組平均OD值×100%。實驗重復3次。
1.5 ELISA法測定白介素- 6(interleukin- 6,IL- 6)表達
分別收集4組細胞上清液進行檢測,選取美國Rapid Bio公司ELISA試劑盒,儀器:酶標儀(SLT型,奧地利),按照說明書進行檢測。(1)提前20min取出試劑盒,平衡至室溫。從密封袋中取出IL- 6抗體包被板; (2)分別將標本和不同濃度的標準品加入相應孔中,用封板膠紙封住反應孔,37℃孵箱孵育90 min;(3)去除孔內液體,每孔加洗滌液350μl,靜置30s后甩干液體,在吸水紙上拍干,洗板5次;(4)除空白孔外,加入生物素化抗體工作液100μl/孔,用封板膠紙封住反應孔,37℃孵箱孵育60 min,洗板5次;(5)除空白孔外,加入酶結合物工作液100μl/孔,用封板膠紙封住反應孔,37℃孵箱孵育30min,洗板5次,(6)加入顯色劑100pil;fL,避光37℃孵箱孵育15~20min。(7)加入終止液100μl/孔,混勻后即刻(5min內)測量波長為450nnm處的A450值。
1.6 RT- PCR法檢測細胞內MMP- 9 mRNA表達
培養收集4組胰腺癌PANC- 1細胞,用TRIzol試劑提取細胞總RNA,并逆轉錄為cDNA,用PCR試劑盒進行擴增。GAPDH循環次數為25,退火溫度為60 ℃,MMP- 9循環次數為30,退火溫度為58℃。PCR產物經1.5%瓊脂糖凝膠電泳分離目的條帶和內參,條帶經紫外光顯色灰度掃描,檢測4組胰腺癌PANC- 1細胞系MMP- 9的mRNA表達。引物序列如表1。
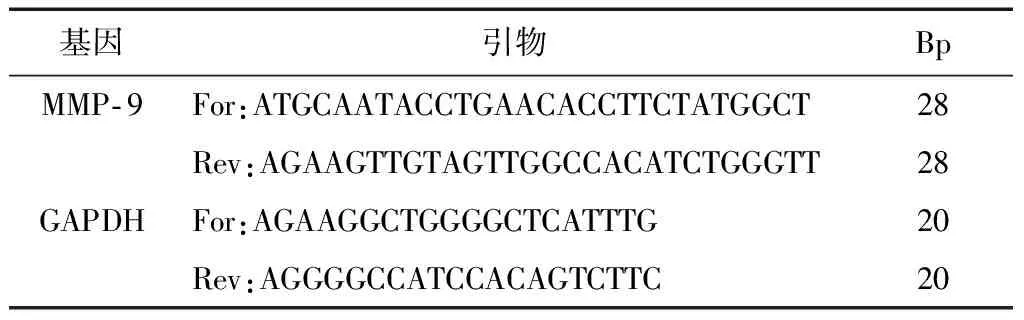
表1 MMP- 9 PCR引物序列
1.7 Western blot法檢測細胞內凋亡蛋白BCL- 2、Bax表達
取對數生長期的PANC- 1細胞接種于6孔板,待細胞貼壁,加藥處理后繼續放入37℃溫箱培養24h。用RIPA裂解液提取細胞總蛋白,BCA法測定蛋白濃度后,每個樣品上樣30μg,行蛋白電泳,電轉移到PVDF膜(美國MiLLipore公司)上,封閉后順序加一抗(1 ∶1 000),二抗(1 ∶5 000),進行雜交,ECL化學發光試劑盒(美國MiLLipore公司)檢測雜交信號。
1.8 統計學方法
2 結 果
2.1 大黃素、GEM以及聯合用藥對PANC- 1細胞增殖能力的影響
應用不同濃度大黃素(10μmol/l、20μmol/l、40μmol/l、80μmol/l、160μmol/l)對PANC- 1細胞進行刺激,MTT方法檢測結果顯示:單用大黃素刺激胰腺癌細胞,其對增殖能力的抑制作用呈劑量依賴性(見圖1)。10μmol/l大黃素抑制率為17%,40μmol/l大黃素抑制率為49%,隨著大黃素濃度的增加,抑制率增加。根據IC50值,選擇40 μmol/l為大黃素濃度,加藥處理細胞72h后,大黃素組PANC- 1細胞抑制率為31%,,GEM組的抑制率為35%,聯合用藥組的抑制率為47%,與對照組相比差異有統計學意義(P<0.05),見圖2。
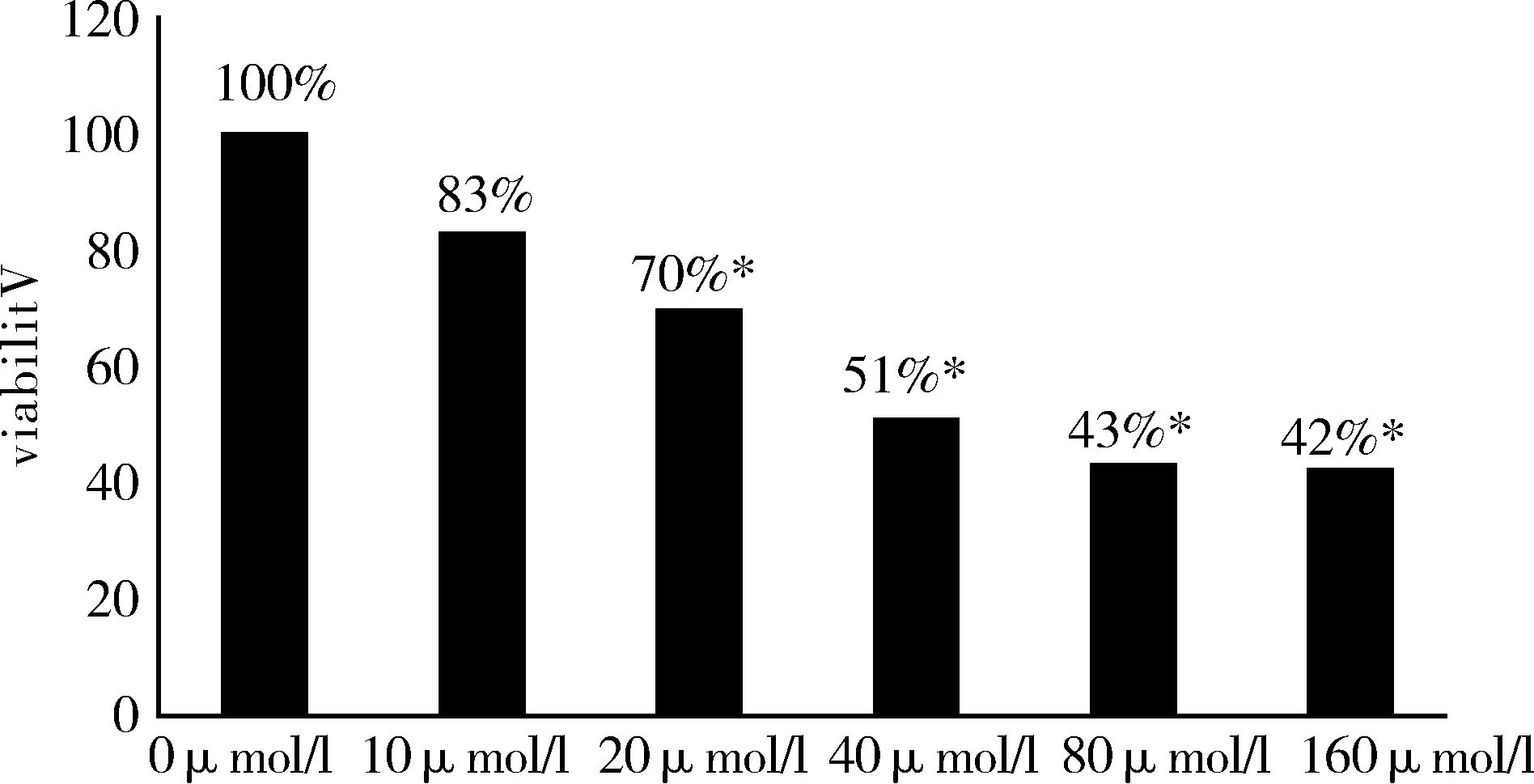
圖1 不同濃度大黃素對PANC- 1細胞的增殖抑制作用
*與對照組(0μmol/l)相比,差異有統計學意義(P<0.05)
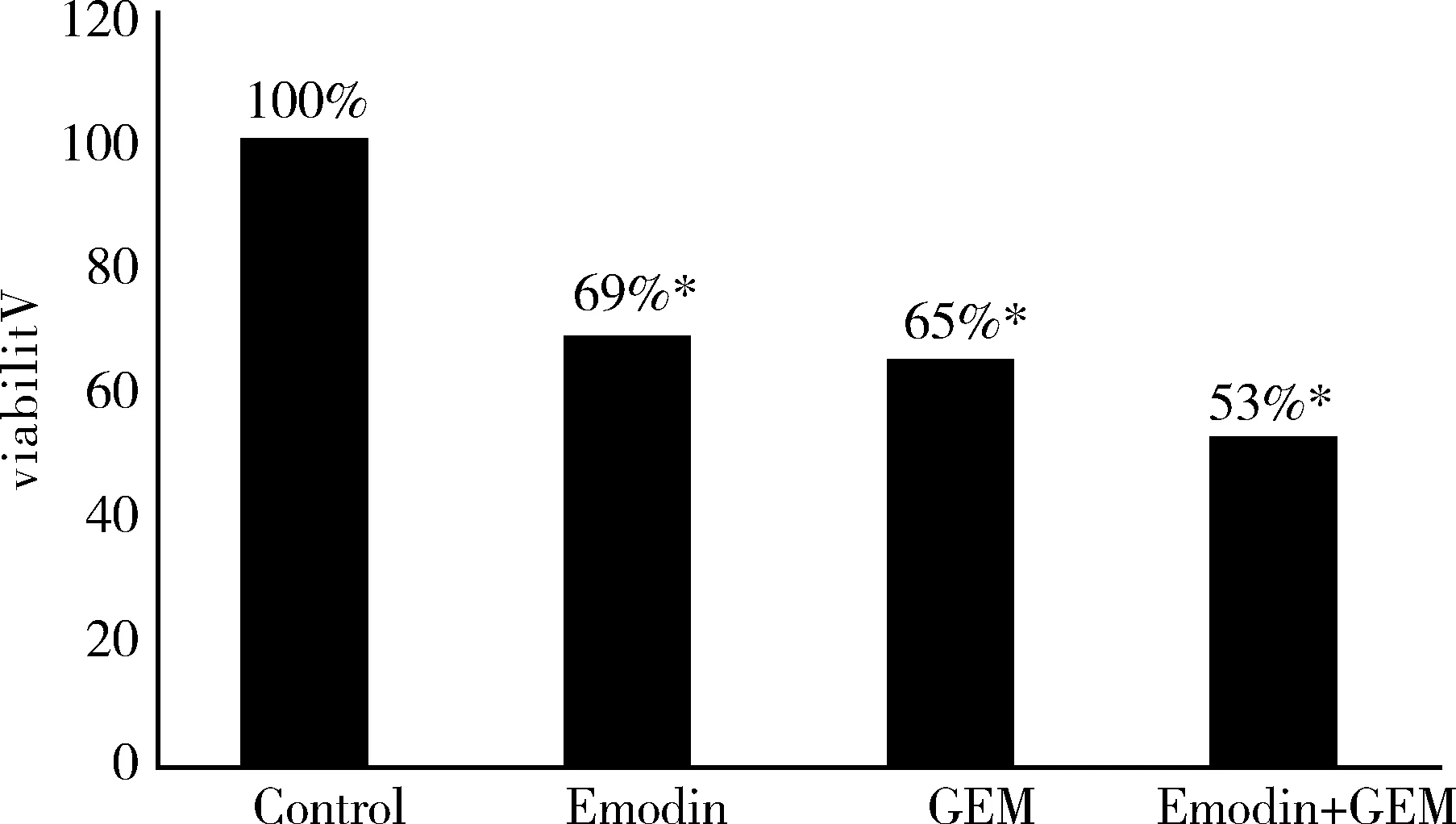
圖2 不同組別藥物干預對PANC- 1細胞的增殖抑制作用
*與對照組(0μmol/l)相比,差異有統計學意義(P<0.05)
2.2 大黃素、GEM以及聯合用藥對PANC- 1細胞上清液中IL- 6的影響
72h時取細胞上清,測定IL- 6濃度,結果發現,空白對照組IL- 6濃度為(27.27±0.74)ng/ml,大黃素組為(22.59±0.64)ng/ml,GEM組為(20.44±0.69)ng/ml,聯合用藥組為(15.62±0.68)ng/ml。實驗組均顯著低于對照組,差異有統計學意義(P<0.05)。GEM組顯著低于大黃素組,二者有統計學差異(P<0.05),聯合用藥組顯著低于大黃素組及GEM組(P<0.01)。見表2,圖3。

圖3 大黃素組、GEM組以及聯合用藥組PANC- 1細胞上清液中IL- 6水平
2.3 大黃素、GEM以及聯合用藥組細胞內MMP- 9 mRNA表達
通過RT-PCR方法測定PANC- 1細胞內MMP- 9 mRNA表達水平,計算各組MMP- 9與對照組的比值,大黃素組、GEM組、聯合用藥組MMP- 9 mRNA表達水平均低于對照組。 大黃素組和聯合用藥組低于GEM組,差異有統計學意義(P<0.01)。大黃素組和聯合用藥組之間差異無統計學意義(P>0.05)。見表3,圖4。

表3 大黃素組、GEM組以及聯合用藥組PANC- 1細胞內MMP- 9 mRNA水平
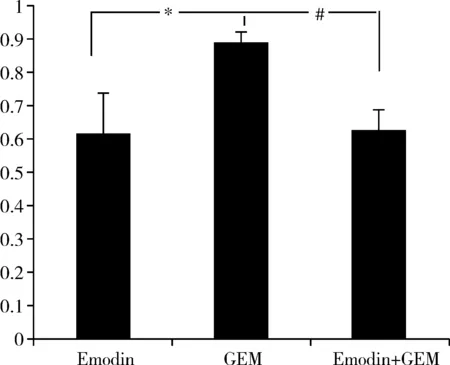
圖4 大黃素組、GEM組以及聯合組PANC- 1細胞MMP- 9水平
2.4 大黃素、GEM以及聯合用藥組細胞內凋亡蛋白Bcl- 2、Bax表達
Western blot方法檢測發現:用藥物干預PANC- 1細胞72h后,提取總蛋白,檢測凋亡相關蛋白Bax、Bcl- 2的表達水平, 對照組、大黃素組、GEM組及聯合用藥組的Bax/Bcl- 2比值分別為 1.14±0.15, 2.71±0.25, 4.73±0.17, 5.72±0.36,實驗組均顯著高于對照組,其中以聯合用藥組比值最高,差異有統計學意義(P<0.05)。見圖5。
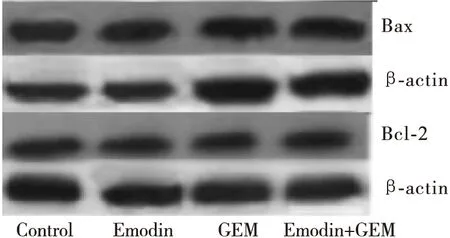
圖5 不同用藥組細胞內凋亡蛋白Bax、Bcl- 2的表達
3 討 論
胰腺癌是惡性度較高的腫瘤之一,其發病率在全球范圍內呈上升趨勢。胰腺癌的早期診斷困難,90%患者發現時已經是晚期,失去了最佳治療時機。胰腺癌病程短、進展快、死亡率高,其中位生存時間僅為6個月。盡管目前腫瘤的治療發展日新月異,但胰腺癌的診療瓶頸一直難以突破,胰腺癌患者整體預后不容樂觀,亟待大量的基礎研究及臨床試驗進一步研發療效更確切、毒副作用更小的治療方案[2]。
我們既往研究證實,大黃對胰腺的保護機制可能與降低胰酶、減少炎性介質、保護胰腺細胞、保護胃腸道以及減少其他器官功能障礙等有關[1]。大黃素是大黃的主要有效成分,能夠起到保護胰腺的作用。近年來,諸多學者研究發現大黃素可抑制腫瘤細胞的增殖,其機制包括抑制腫瘤新生血管生成[3]、抑制上皮間質轉化、促進細胞凋亡[4-5]、抑制抑癌基因P16、RASSF1A、ppENK的甲基化[6]、抑制化療藥物的耐藥性產生等機制有關。本項研究結果發現,大黃素和/或GEM處理細胞72h后,大黃素組PANC- 1細胞抑制率為31%,GEM組的抑制率為35%,GEM+大黃素組的抑制率為47%,與對照組相比差異有統計學意義,提示大黃素能夠抑制胰腺癌細胞增殖,與GEM聯合使用抑制作用更為明顯。
IL- 6是核因子- κB(nuclear factor- kappa B, NF- κB)信號通路的下游炎癥介質,它通過激活轉錄信號轉導因子和激活因子3傳遞信號,阻斷炎癥過程中的細胞凋亡,進而促進腫瘤細胞繼續生長[7]。本研究測定IL- 6濃度發現,大黃素組為(22.59±0.64)ng/ml,GEM組為(20.44±0.69)ng/ml,聯合用藥組為(15.62±0.68)ng/ml。實驗組均顯著低于對照組,差異有統計學意義(P<0.05)。提示大黃素可抑制胰腺癌PANC- 1細胞IL- 6水平,與GEM聯合應用時顯著降低IL- 6水平。
MMP家族能夠降解細胞外基質,破壞基底膜的完整性,從而引起腫瘤的轉移和侵襲。在MMP家族中,MMP- 9在各種惡性腫瘤中普遍存在,與腫瘤的轉移、侵襲關系密切。因此,盡早抑制MMP- 9的表達可以減少腫瘤轉移的風險,從而成為一個腫瘤治療靶點[8]。本研究觀察了大黃素、吉西他濱用藥后胰腺癌細胞MMP- 9水平的差異,結果顯示大黃素組、大黃素+GEM組的MMP- 9顯著下降,提示大黃素能夠抑制MMP- 9的水平,有助于減少腫瘤的侵襲。
凋亡在生物學和醫學領域是重要的研究內容,諸多化療藥物和活性成分能夠促進細胞凋亡而起到抑制腫瘤的作用[9]。Bcl- 2和Bax是Bcl- 2基因家族的主要成員,在功能性調控凋亡過程中起重要作用。Bcl- 2是凋亡控制基因,可以維持細胞的正常形態抑制腫瘤的發生。Bax是促進腫瘤細胞發生凋亡的蛋白,Bax/Bcl- 2的比值變化可以反應凋亡促進或抑制。課題組對大黃素與胰腺癌細胞Bax/Bcl- 2信號通路的關系進行研究,結果顯示藥物干預組Bax/Bcl- 2顯著上調,提示大黃素、GEM均有促進腫瘤細胞凋亡的作用,兩藥聯用凋亡作用更為顯著。
綜上所述,本研究初步證實了由于大黃素能夠下調IL- 6、MMP- 9的水平,上調凋亡相關通路過程中Bax/Bcl- 2蛋白的表達來實現對胰腺癌PANC- 1細胞抑制增殖、抑制腫瘤細胞侵襲和轉移作用,與GEM聯合應用抑制腫瘤細胞增殖的作用更為明顯,可起到協同效應,從而為大黃素在臨床上的應用奠定了更堅實可行的實驗基礎。
[1] 王 婧,陰赪宏,路 琴,等.大黃素對重癥急性胰腺炎大鼠血清瘦素的影響[J]. 中華急診醫學雜志, 2007, 16(11):1141-1145.
[2] 馬 欣,易 成. 胰腺癌的化療進展[J]. 腫瘤預防與治療,2015,28(4):228-231.
[3] Lin SZ, Wei WT, Chen H, et al. Antitumor activity of emodin against pancreatic cancer depends on its dual role: Promotion of apoptosis and suppression of angiogenesis [J]. Plos One, 2012,7(8): e42146.
[4] Ying J, Xu H, Wu D, et al. Emodin induces apoptosis of human osteosarcoma cells via mitochondria- and endoplasmic reticulum stress-related pathways[J]. Int J Clin Exp Pathol, 2015,8(10):12837-12844.
[5] Zu C, Zhang M, Xue H, et al. Emodin induces apoptosis of human breast cancer cells by modulating the expression of apoptosis-related genes[J]. Oncol Lett, 2015,10(5):2919-2924.
[6] Zhang H, Chen L, Bu HQ, et al. Effects of emodin on the demethylation of tumor-suppressor genes in pancreatic cancer PANC- 1 cells[J]. Oncol Rep, 2015,33(6):3015-3023.
[7] 陸海燕, 黃建鳴, 張國楠. 雌激素調節IL-6的表達與卵巢癌發生、發展關系的研究進展[J]. 腫瘤預防與治療, 2012, 25(3):202-205.
[8] Li W, Yu KN, Bao L, et al. Non-thermal plasma inhibits human cervical cancer HeLa cells invasiveness by suppressing the MAPK pathway and decreasing matrix metalloproteinase-9 expression[J]. Sci Rep, 2016,6:19720.
[9] Rengarajan T, Nandakumar N, Rajendran P, et al. D-pinitol promotes apoptosis in MCF-7 cells via induction of p53 and Bax and inhibition of Bcl-2 and NF-κB[J]. Asian Pac J Cancer Prev, 2014,15(4):1757-1762.
Inhibitory Effect of Emodin and Gemcitabine on Proliferation of Pancreatic Cancer Cell Line PANC- 1*
Wang Jing, Zhao Lei, Che Juanjuan, et al
(DepartmentofOncology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective: To investigate the antitumor mechanisms of emodin with gemcitabine in the pancreatic cancer cell line PANC- 1 by proliferation, migration and invasion. Methods: The cell proliferation of PANC- 1 intervened by emodin with or without gemcitabine was detected by 4-methyl-teerazolium (MTT). IL- 6 was measured by ELISA from cellular supernatant. The expression of the gene MMP- 9 was detected by RT-PCR. Bax and Bcl- 2 protein were detected by western blot. Results: The PANC- 1 cell inhibition rate was 31% in Emodin group (40μmol/l), 35% in the GEM group (20μmol/l), and 49% in the combination group . Statistically significant differences were observed between these three groups with the control group(P<0.05). IL- 6 concentration of emodin group and combination group was (22.41±2.27) ng/ml and (15.44±3.91) ng/ml, respectively. IL- 6 concentration of the experimental groups were significantly lower than that of the control group with statistically significant difference (P<0.05). MMP- 9 mRNA expression level of emodin group and combination group were significantly lower than that of the control group. Bax/Bcl- 2 of emodin group, GEM group and combination group were (2.71±0.25),(4.73±0.17), and (5.72±0.36) respectively, which were significantly higher than that of control group (1.14±0.15). Conclusion: In vitro studies show that emodin can inhibit the proliferation and stimulate the apoptosis of pancreatic cancer cell line PANC- 1, furthermore, when comined with gemcitabine, emodin has stronger antitumor effect.
Emodin; Pancreatic Cancer; Apotosis
2015- 02- 15
2016- 06- 22
*國家自然科學基金資助( 81000187);北京市醫院管理局“青苗”計劃專項經費資助(QML20150107);北京市中醫藥科技發展資金項目資助(QN2015-08);首都衛生發展科研專項基金資助(2016);首都醫科大學基礎-臨床合作課題資助項目(14JL31);首都醫科大學附屬北京友誼醫院院啟動基金資助(yyqdkt2014-10)
王 婧(1981-),女,山東人,博士,主治醫師,主要研究方向:惡性腫瘤的綜合診治。
△馬妮娜,副主任醫師,E-mail: manina1970@sina.com
R735.9;R730-3
A
10.3969/j.issn.1674- 0904.2016.03.002

