巨噬細胞極化在大鼠肝硬化發生發展中的作用*
田小霞, 張慧英△, 陳云霞, 李旭炯, 王黎敏, 孟 麗, 來麗娜, 趙中夫, 韓德五, CHENG Ji
(長治醫學院 1病理生理學教研室, 2微生物學教研室, 3生理學教研室, 4機能綜合實驗室, 5藥理學教研室, 6肝病研究所,山西 長治 046000; 7山西醫科大學肝病研究所,山西 太原030001; 8南加州大學Keck醫學院肝病中心, 美國 加利福尼亞州 洛杉磯 90089)
?
巨噬細胞極化在大鼠肝硬化發生發展中的作用*
田小霞1,張慧英1△,陳云霞2,李旭炯3,王黎敏4,孟麗2,來麗娜5,趙中夫6,韓德五7,CHENG Ji8
(長治醫學院1病理生理學教研室,2微生物學教研室,3生理學教研室,4機能綜合實驗室,5藥理學教研室,6肝病研究所,山西 長治 046000;7山西醫科大學肝病研究所,山西 太原030001;8南加州大學Keck醫學院肝病中心, 美國 加利福尼亞州 洛杉磯 90089)
[摘要]目的: 探討在大鼠肝硬化發病過程中,巨噬細胞的極化狀態及其與腸源性內毒素血癥-內質網應激反應之間的關系。方法: 36只雄性SD大鼠隨機分為正常對照組和肝硬化模型組。各組動物分別于造模第4周末、6周末和8周末處死取材。ELISA法檢測大鼠血漿中ALT、內毒素、Hcy的水平和肝組織勻漿中iNOS、TNF-α、IL-6、Arg-1、IL-10的水平;肝組織切片行HE染色和VG染色;實時熒光定量PCR法檢測大鼠肝組織中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1 的mRNA表達。結果: 與相應的正常對照組相比,肝硬化模型組動物血漿中ALT、內毒素、Hcy水平和肝組織中Grp78的mRNA表達在4周、6周和8周均隨病程進展逐漸升高(P<0.05);肝組織中NF-κB、IRF5 和CD86的mRNA表達以及iNOS、TNF-α、IL-6的水平均顯著升高(P<0.05),且它們的變化趨勢為6周水平最高,4周次之,8周最低;肝組織中CD206 和TGF-β1的mRNA表達以及Arg-1、IL-10的水平在4周未見明顯變化,在6~8周逐漸升高(P<0.05)。相關性分析結果顯示,血漿中內毒素水平與肝組織中Grp78的mRNA表達顯著相關(P<0.01);血漿中內毒素水平和肝組織中Grp78的mRNA表達均與肝組織中CD86和CD206 的mRNA表達顯著相關(P<0.01)。結論: 肝損傷-腸源性內毒素血癥-內質網應激-巨噬細胞極化途徑可能是肝纖維化乃至肝硬化發病的重要機制。
[關鍵詞]肝硬化; 肝纖維化; 巨噬細胞; 內質網應激; 內毒素
肝內巨噬細胞包括肝血竇內的枯否細胞和來自血液的單核細胞,它們具有可塑性和多能性,在不同微環境的影響下,可分化為不同表型并表現出功能上的差異,現已明確的2種巨噬細胞極化類型分別為經典活化的M1型巨噬細胞和選擇性活化的M2型巨噬細胞,二者是巨噬細胞一系列功能變化的其中2個極端狀態。巨噬細胞極化發生在多種生理及病理過程中,對于維持機體健康具有十分重要的意義[1-2]。目前的研究表明,巨噬細胞極化在肝纖維化發生發展過程中具有重要作用[3-5],而在動物模型體內巨噬細胞極化狀態的研究卻不多。本項研究繼續以復合致病因素誘導的肝硬化大鼠模型為研究對象,觀察在肝硬化發生發展過程的不同階段巨噬細胞的極化狀態,并初步探討影響巨噬細胞極化過程的可能機制。
材料和方法
1主要試劑
丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、內毒素、同型半胱氨酸(homocysteine,Hcy)的ELISA檢測試劑盒購自上海藍基生物科技有限公司;誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、精氨酸酶-1(arginase-1,Arg-1)和白細胞介素-10(interleukin-10,IL-10)的ELISA檢測試劑盒購自上海科鑒生物科技有限公司。總RNA提取試劑RNAiso Plus,反轉錄試劑盒Prime ScriptTMRT Master Mix,實時熒光定量聚合酶鏈式反應(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)試劑盒SYBR?Premix Ex TaqTMII購自TaKaRa;葡萄糖調節蛋白78(glucose-regulated protein 78,Grp78)、核因子-kappa B(nuclear factor-kappa B,NF-κB)、干擾素調節因子(interferon-regulatory factor,IRF)5、CD86、CD206、轉化生長因子-β1(transforming growth factor-β1,TGF-β1)和18S RNA引物由上海生工生物工程股份有限公司合成。
2實驗方法
2.1實驗動物及標本制備36只清潔級健康雄性SD大鼠購自中國人民解放軍軍事醫學科學院實驗動物中心,體重180~220 g。隨機將大鼠分為正常對照(normal control,N)組和肝硬化模型(model,M)組,每組18只動物。肝硬化模型組采用復合致病因素法復制[6]:以摻入膽固醇(飼料重量0.5%)的玉米面做飼料,前2周摻入豬油(飼料重量20%),首次皮下注射CCl4原液(每100g體重0.5mL),之后每隔3 d皮下注射40% CCl4油溶液(每100 g體重0.3 mL),以4%(體積比)乙醇作為飲用水。正常對照組動物飼以標準飼料和飲用水。將每一組動物隨機分為3批,每批6只,分別于造模第4周末、6周末和8周末,全麻、無菌、無內毒素條件下取材。腹主動脈采集血液,3 000 r/min離心15 min后,吸取血漿,置-80 ℃保存備用;每次取肝臟同一區域組織用10% 中性甲醛固定,石蠟包埋,組織切片用于HE染色和VG染色;取部分肝組織立即置于液氮,后轉移至-80 ℃凍存,用于相關基因的檢測。
2.2肝組織HE染色和VG染色以石蠟包埋的組織標本制備5 μm厚連續切片,行HE染色和VG染色。
2.3血漿和肝組織勻漿中指標檢測嚴格按照ELISA試劑盒操作說明,分別測定血漿中ALT、內毒素、Hcy的水平和肝組織勻漿中iNOS、TNF-α、IL-6、Arg-1、IL-10的水平。
2.4實時熒光定量PCR用TaKaRa的RNAiso Plus試劑提取肝組織總RNA。用酶標儀檢測RNA樣品純度(A260/A280值在1.7~2.1)。按照TaKaRa逆轉錄試劑盒說明,利用逆轉錄-聚合酶鏈反應合成cDNA,反轉錄條件為37 ℃ 15 min,85 ℃ 5 s,產物保存于-20 ℃。以cDNA為模板,Primer Express 2.0和Beacon Designer軟件設計引物,具體序列見表1。采用SYBR?Green I 熒光染料實時定量PCR法對目的基因進行檢測。反應條件:95 ℃ 30 s,Grp78 62 ℃ 20 s/NF-κB 57 ℃ 15 s/IRF5 58 ℃ 15 s/CD86 58.5 ℃ 20 s/CD206 59.5 ℃ 20 s/TGF-β1 57.5 ℃ 15 s/18S RNA 61.5 ℃ 20 s,72 ℃ 1 min,共35個循環。以18S RNA為內參照,結果采用2-ΔΔCt值表示[7]。

表 1 RT-qPCR引物序列
3統計學處理
數據用均數±標準差(mean±SD)表示,采用SPSS 19.0統計分析軟件對數據進行單因素方差分析和組間LSD-t檢驗,采用Pearson相關分析做相關性檢驗,以P<0.05為差異有統計學意義。
結果
1肝組織HE染色和VG染色
各正常對照組:肝細胞索排列整齊,肝小葉結構完整清晰。肝硬化模型4周組,可見肝細胞脂肪變性,肝細胞索排列紊亂,未見明顯的膠原纖維沉積;模型6周組,炎性反應進一步加重,部分肝小葉結構消失,可見增生的條索狀纖維間隔;模型8周組,纖維組織增生形成纖維間隔,分割正常的小葉結構形成假小葉,見圖1、2。
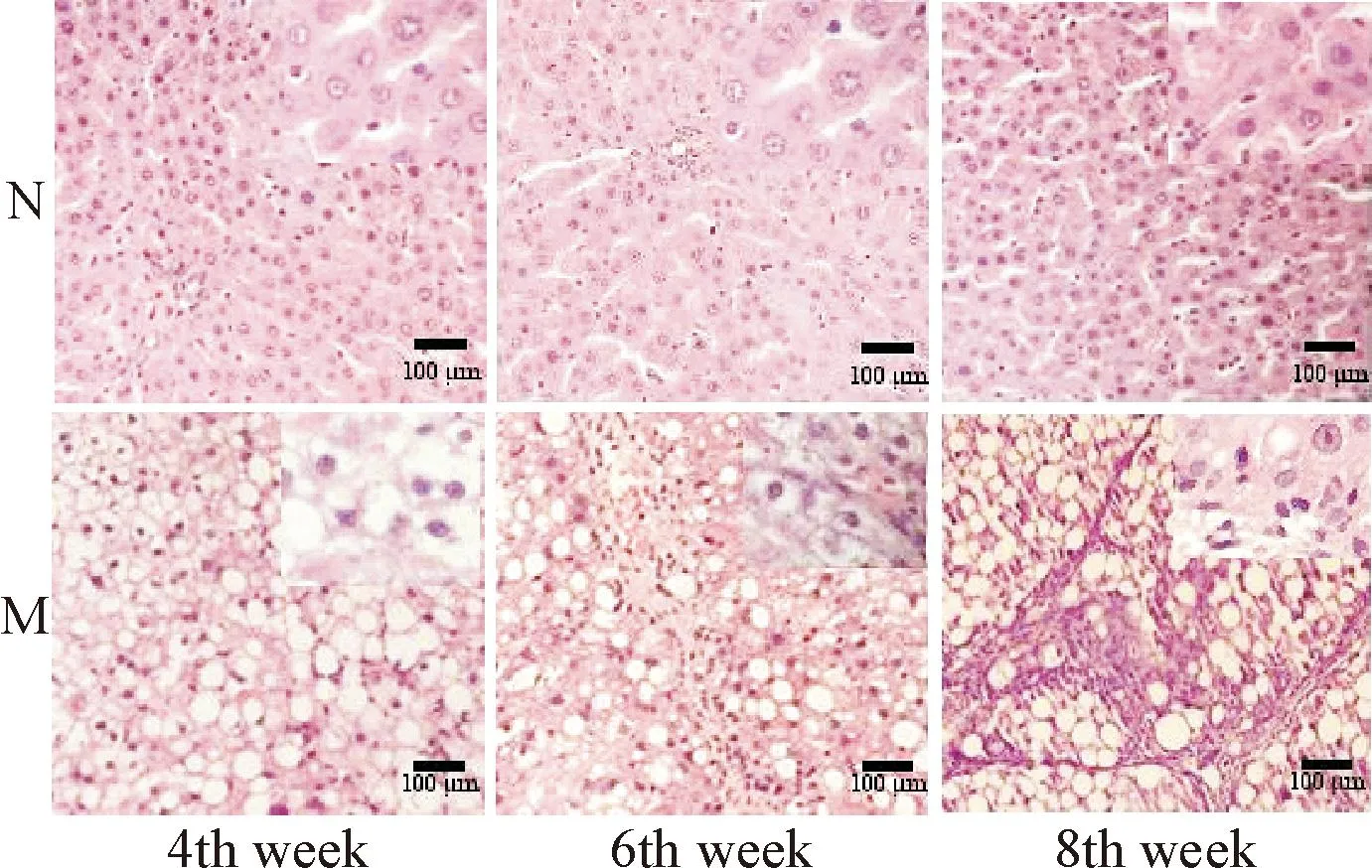
Figure 1. Pathological changes of liver tissues (HE staining). N: normal control group; M: liver cirrhosis model group.
圖1肝組織HE染色
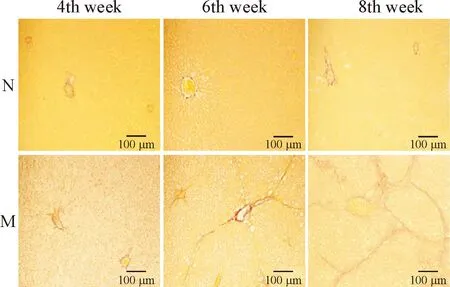
Figure 2.Pathological changes of liver tissues (VG staining). N: normal control group; M: liver cirrhosis model group.
圖2肝組織VG染色
2血漿中ALT、內毒素和Hcy水平變化
與相應的正常對照組相比,隨著病程的進展,肝硬化模型組動物血漿中ALT、內毒素和Hcy的水平逐漸顯著增高(P<0.05),見表2。
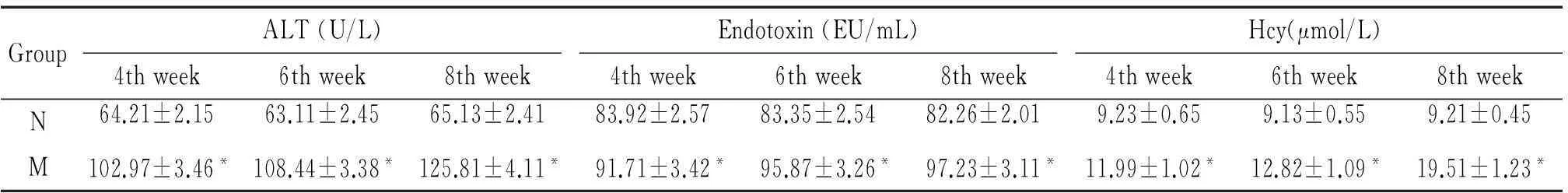
表2 血漿中ALT、內毒素和Hcy水平變化
*P<0.05 vs N group.
3肝組織中iNOS、TNF-α、IL-6、Arg-1和IL-10水平變化
肝硬化模型組各個時點肝組織中iNOS、TNF-α 和IL-6的水平均顯著高于其相應的正常對照組(P<0.05),以6周組最高,4周組次之,8周組最低;而肝組織中Arg-1和IL-10的水平在肝硬化4周未見明顯變化,在6周和8周顯著升高(P<0.05),見表3、4。
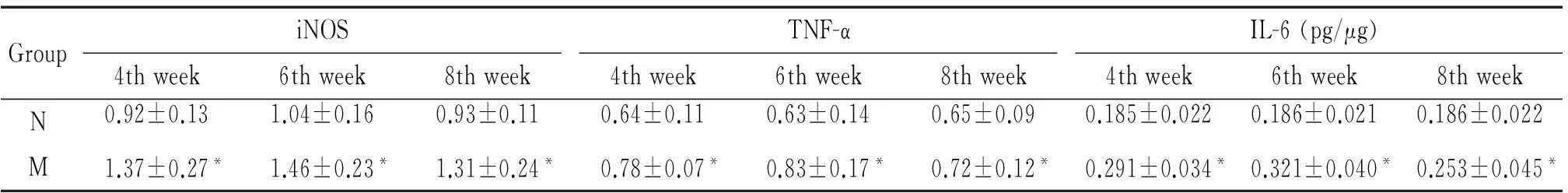
表3 肝組織中iNOS、TNF-α和IL-6水平變化
*P<0.05 vs N group.

表4 肝組織中Arg-1和IL-10水平變化
*P<0.05 vs N group.
4肝組織中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1 mRNA的表達
與相應的正常對照組相比,肝硬化模型組動物肝組織中Grp78的mRNA表達隨病程進展逐漸升高(P<0.05);NF-κB、IRF5和CD86的 mRNA表達均顯著升高(P<0.05),其中6周最高,4周次之,8周最低;CD206和TGF-β1的mRNA的表達在4周組未見明顯變化,在6周和8周組逐漸顯著升高(P<0.05),見圖3。
5相關性分析
大鼠血漿中內毒素水平與肝組織中Grp78的mRNA表達顯著相關(P<0.01);血漿中內毒素水平和肝組織中Grp78的mRNA表達分別與肝組織中CD86 和CD206的mRNA表達顯著相關(P<0.01),見表5。
討論
研究表明巨噬細胞極化在維持機體自穩態,非酒精性脂肪肝、腫瘤等多種疾病的發病,以及炎癥的發生、發展和消解過程中起關鍵的作用[8]。M1型巨噬細胞的主要功能是清除細胞外病原體,促進炎癥反應,合成和分泌TNF-α、IL-1、IL-6等促炎細胞因子,通過iNOS將精氨酸代謝成NO來殺滅病原體;M2型巨噬細胞的主要功能是抑制炎癥反應,參與組織修復、合成和分泌抗炎細胞因子IL-10以及通過Arg-1將精氨酸分解成聚胺,參與合成和穩定細胞外基質[9-10]。本研究中復合致病因素誘導肝硬化模型4周,巨噬細胞主要分化為M1型,肝臟的變化以炎性反應為主;6周,M1和M2型巨噬細胞的數量都顯著增多,以M1型為更多,肝臟炎性反應加劇,同時有少量纖維生成;8周,巨噬細胞主要分化為M2型,M2型巨噬細胞通過釋放大量的促纖維化細胞因子,引起肝星狀細胞過度活化,肝臟發生細胞外基質過度沉積的纖維修復反應。因此,慢性肝損傷后,肝內巨噬細胞極化的動態變化與肝硬化的發生發展過程密切相關。
我們前期的研究證實腸源性內毒素血癥(intestinal endotoxemia,IETM)引起的肝組織氧化應激和高同型半胱氨酸血癥可以引發肝臟發生內質網應激反應(endoplasmic reticulum stress,ERS),進而導致Grp78表達升高,在肝硬化發生發展過程中起重要作用[11]。本項研究中肝硬化模型動物血漿中內毒素、同型半胱氨酸的水平和肝組織中Grp78的mRNA表達均隨病程進展逐漸顯著升高,而且血漿中內毒素水平和肝組織中Grp78的mRNA表達存在顯著相關性,與之前的研究結果一致。另外血漿中內毒素水平和肝組織中Grp78的mRNA表達與M1型巨噬細胞標志物CD86的mRNA和M2型巨噬細胞標志物CD206的mRNA表達均存在顯著相關性,提示肝內巨噬細胞極化的轉化機制可能與腸源性內毒素血癥-內質網應激反應有關。另外,NF-κB信號通路在炎癥反應中發揮重要功能[12],而IRF5對M1型巨噬細胞極化起關鍵作用[13],本項研究還檢測了這2個調控巨噬細胞極化的轉錄因子的表達,結果NF-κBmRNA和IRF5 mRNA表達與M1型巨噬細胞的變化趨勢一致,6周最高,4周次之,8周最低,也呈現動態變化過程。
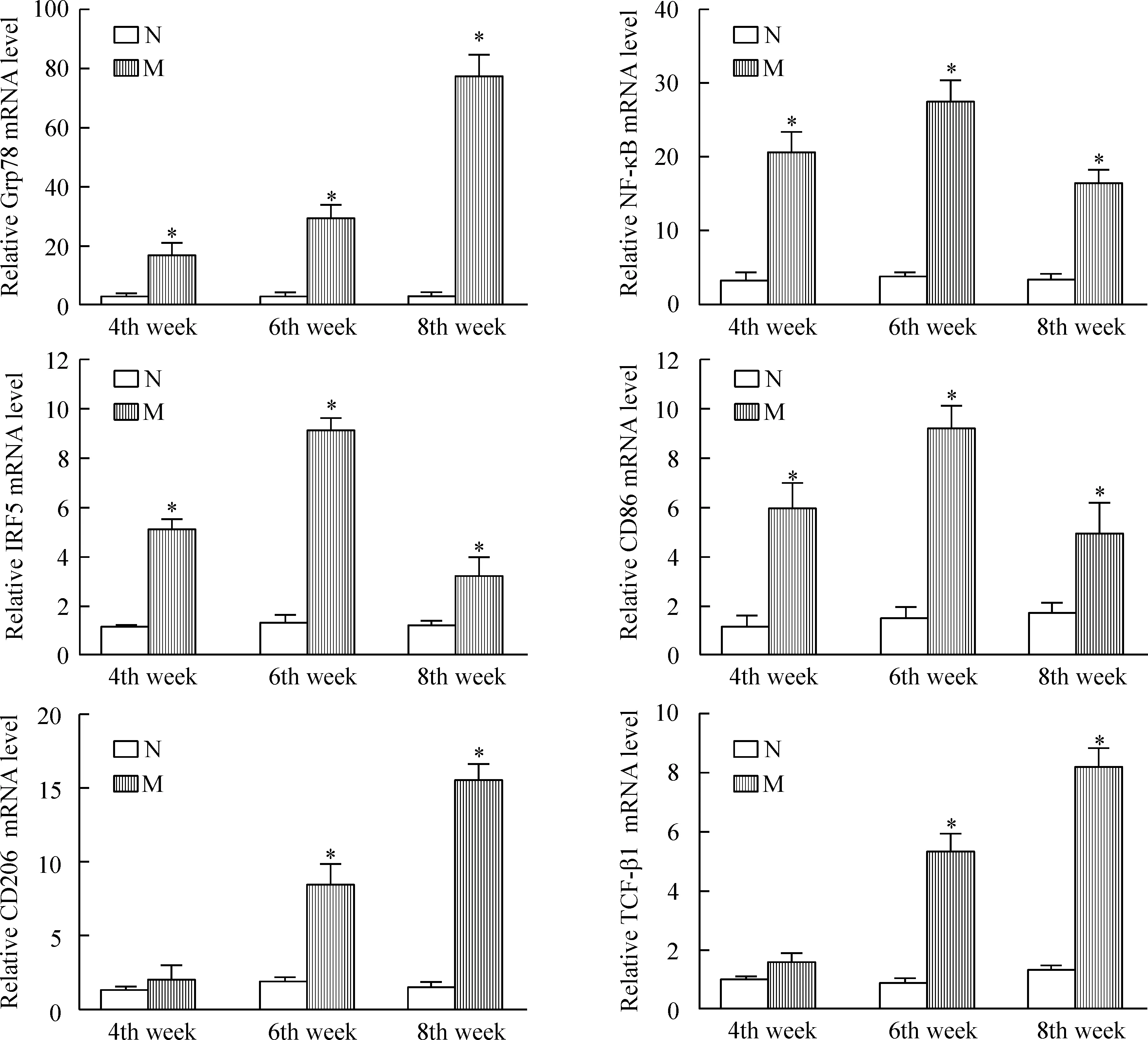
Figure 3. The mRNA levels of Grp78, NF-κB, IRF5, CD86, CD206 and TGF-β1 in the liver tissues. N: normal control group; M: liver cirrhosis model group. Mean±SD.n=6.*P<0.05 vs N group.
圖3肝組織中Grp78、NF-κB、IRF5、CD86、CD206和TGF-β1的mRNA表達

表5 各指標間相關性分析
衣霉素(tunicamycin,TM)或毒胡蘿卜素(thapsigargin,TG)誘導人肝癌細胞HepG2發生內質網應激反應之后,收集其培養上清液,作用于佛波酯誘導人單核細胞THP-1分化成的巨噬細胞,結果巨噬細胞Toll樣受體4的表達減少,NF-κB信號途徑被抑制,同時促炎細胞因子TNF-α、IL-6、IL-1β等表達減少,巨噬細胞發生內質網應激反應,巨噬細胞向M2型分化[14]。這提示從損傷因素作用于肝臟開始至肝硬化4周,IETM逐漸形成,通過高同型半胱氨酸血癥等因素引發肝臟發生內質網應激反應,NF-κB、IRF5等信號途徑被激活,促進巨噬細胞向M1型轉化,肝硬化4周以后,在IETM的作用下,肝臟內質網應激反應到達一定強度,可能通過某種機制抑制NF-κB 和IRF5的信號途徑,同時促進巨噬細胞向M2型分化可能是肝纖維化乃至硬化發生發展的一個非常重要的機制。
在各種實驗性肝損傷模型中,巨噬細胞的活化總是先于肝星狀細胞的激活,其分泌的生長因子、細胞因子等與肝臟其它細胞相互作用,影響肝纖維化乃至硬化的發生發展過程[15]。在肝硬化發生發展過程中,隨著腸源性內毒素血癥-內質網應激反應程度的不斷增強,巨噬細胞先分化為M1型,參與肝臟的炎性反應,肝硬化4周之后又分化為M2型,參與肝纖維化乃至硬化的發生發展,因此減輕腸源性內毒素血癥,抑制肝臟內質網應激反應可以抑制肝臟炎性反應,減少巨噬細胞向M2型巨噬細胞分化,減緩肝硬化進程。本項研究所獲結果僅涉獵冰山一角,深入開展肝臟疾病-腸源性內毒素血癥-內質網應激-巨噬細胞極化途徑在肝纖維化乃至肝硬化中所起作用機制的研究,將有望對臨床防治產生積極影響。
[參考文獻]
[1]Biswas SK, Chittezhath M, Shalova IN, et al. Macrophage polarization and plasticity in health and disease[J]. Immunol Res, 2012, 53(1-3):11-24.
[2]Wolfs IM, Donners MM, de Winther MP. Differentiation factors and cytokines in the atherosclerotic plaque micro-environment as a trigger for macrophage polarisation[J]. Thromb Haemost, 2011, 106(5):763-771.
[3]Karlmark KR, Weiskirchen R, Zimmermann HW, et al. Hepatic recruitment of the inflammatory Gr1+monocyte subset upon liver injury promotes hepatic fibrosis[J]. Hepatology, 2009, 50(1):261-274.
[4]Heymann F, Trautwein C,Tacke F. Monocytes and macrophages as cellular targets in liver fibrosis[J]. Inflamm Allergy Drug Targets, 2009, 8(4): 307-318.
[5]Wynn TA, Barron L. Macrophages: master regulators of inflammation and fibrosis[J]. Semin Liver Dis, 2010, 30(3):245-257.
[6]Zhang HY, Han DW, Zhao ZF, et al. Mutiple pathogenic factor-induced complications of cirrhosis in rats: a new model of hepatopulmonary syndrome with intestinal endotoxemia[J]. World J Gastroenterol, 2007, 13(25):3500-3507.
[7]Lee EJ, Schmittgen TD. Comparison of RNA assay me-thods used to normalize cDNA for quantitative real-time PCR[J]. Anal Biochem, 2006, 357(2):299-301.
[8]Martinez FO, Sica A, Mantovani A, et al. Macrophage activation and polarization[J]. Front Biosci, 2008, 13:453-461.
[9]陳芳艷, 賀福初, 姜穎. 肝纖維化發生發展及逆轉過程中肝巨噬細胞亞群分類[J]. 中國生物化學與分子生物學報, 2012, 28(10):879-887.
[10]Ohashi W, Hattori K, Hattori Y. Control of macrophage dynamics as a potential therapeutic approach for clinical disorders involving chronic inflammation[J]. J Pharmacol Exp Ther, 2015, 354(3):240-250.
[11]冀菁荃, 張慧英, 賈建桃, 等. 糖調節蛋白78在大鼠腸源性內毒素血癥促進肝硬化形成中的作用[J]. 中國病理生理雜志, 2010, 26(12):2447-2452.
[12]Perkins ND. Integrating cell-signalling pathways with NF-κB and IKK function[J]. Nat Rev Mol Cell Biol, 2007, 8(1):49-62.
[13]Krausgruber T, Blazek K, Smallie T, et al. IRF5 promotes inflammatory macrophage polarization and TH1-TH17 responses[J]. Nat Immunol, 2011, 12(3):231-238.
[14]Xiu F, Catapano M, Diao L, et al. Prolonged endoplasmic reticulum-stressed hepatocytes drivean alternative macrophage polarization[J]. Shock, 2015, 44(1): 44-51.
[15]Wijesundera KK, Izawa T, Tennakoon AH. M1- and M2-macrophage polarization in rat liver Cirrhosis induced by thioacetamide (TAA), focusing on Iba1 and galectin-3[J]. Exp Mol Pathol, 2014, 96(3):382-392.
(責任編輯: 林白霜, 羅森)
Effects of macrophage polarization during development of liver cirrhosis in rats
TIAN Xiao-xia1, ZHANG Hui-ying1, CHEN Yun-xia2, LI Xu-jiong3, WANG Li-min4, MENG Li2, LAI Li-na5, ZHAO Zhong-fu6, HAN De-wu7, CHENG Ji8
(1Department of Pathophysiology,2Department of Microbiology,3Department of Physiology,4Functional Integrative Laboratory,5Department of Pharmacology,6Institute of Hepatology, Changzhi Medical College, Changzhi 046000, China;7Institute of Hepatology, Shanxi Medical University, Taiyuan 030001, China;8Research Center for Liver Disease, Keck School of Medicine, University of Southern California, Los Angeles, CA 90089, USA. E-mail: zhanghy2001@163.com
[ABSTRACT]AIM: To explore the state of macrophage polarization and its relation with intestinal endotoxemia-endoplasmic reticulum stress in the development of liver cirrhosis induced by multiple pathogenic factors in rats. METHODS: The male SD rats (n=36) were randomly divided into normal control group and liver cirrhosis model group, and sacrificed at the end of the 4th, 6th and 8th weeks. The rat model of liver cirrhosis was induced by multiple pathogenic factors. The levels of alanine aminotransferase (ALT), endotoxin, homocysteine (Hcy) in the plasma, and inducible nitric oxide synthase (iNOS), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), arginase-1 (Arg-1) and interleukin-10 (IL-10) in the liver tissues were detected by ELISA. Histopathological change of the liver was observed under microscope with the staining of hematoxylin and eosin (HE) and van Gieson (VG). The expression of glucose-regulated protein 78 (Grp78), nuclear factor-kappa B (NF-κB), interferon-regulatory factor 5 (IRF5), CD86, CD206 and transforming growth factor-β1 (TGF-β1) at mRNA levels in the liver tissues were detected by the method of real-time fluorescence quantitative PCR.RESULTS: Compared with the corresponding normal control group, the levels of ALT, endotoxin, Hcy in the plasma and Grp78 mRNA in the liver tissues in liver cirrhosis model group were significantly and gradually increased (P<0.05). The mRNA expression of NF-κB, IRF5 and CD86, and the protein levels of iNOS, TNF-α and IL-6 in the liver tissues were significantly increased (P<0.05), and they successively increased from the 4th week to the 6th week and decreased reversely at the 8th week. The mRNA expression of CD206, TGF-β1, Arg-1 and IL-10 in the liver tissues were significantly increased from the 6th week to the 8th week (P<0.05), and no significant difference at the 4th week was observed. The level of endotoxin in the plasma was correlated with the mRNA expression of Grp78 in the liver tissues (P<0.01). Both endotoxin in the plasma and Grp78 mRNA in the liver tissues were correlated with the mRNA expression of CD86 and CD206 in the liver tissues (P<0.01).CONCLUSION: The pathway of liver damage-intestinal endotoxemia-endoplasmic reticulum stress-macrophage polarization may be critical in the pathogenesis of liver cirrhosis induced by multiple pathogenic factors.
[KEY WORDS]Liver cirrhosis; Liver fibrosis; Macrophage; Endoplasmic reticulum stress; Endotoxin
[文章編號]1000- 4718(2016)05- 0880- 06
[收稿日期]2015- 12- 23[修回日期] 2016- 02- 19
*[基金項目]國家自然科學基金資助項目(No. 81070339);山西省國際科技合作計劃(No. 2010081068);山西省回國留學人員科研基金資助項目(No. 211-091);山西醫科大學細胞生理學省部共建教育部重點實驗室主任基金資助項目(No. 2010-09);長治醫學院博士科研啟動經費項目(No.2010-01)
通訊作者△Tel: 0355-3151441; E-mail: zhanghy2001@163.com
[中圖分類號]R363
[文獻標志碼]A
doi:10.3969/j.issn.1000- 4718.2016.05.019
雜志網址: http://www.cjpp.net

